蜡梅AFLP反应体系优化及引物筛选
2011-07-11赵明晓冯志敏赵振利范国强
赵明晓,冯志敏,胡 湛,赵振利,范国强
(1.河南农业大学,河南 郑州 450002;2.信阳农业高等专科学校,河南 信阳 464000;3.焦作市园林局,河南 焦作 454003)
AFLP(Amplified fragment length polymorphism)是一种DNA多态性分子标记技术.既有RFLP的可靠性,又有RAPD的方便性[1].目前,在梅花、泡桐、苹果、白桦和板栗等[2~7]木本植物亲缘关系研究及遗传多样性[8]、图谱构建[9~11]、基因定位[12]、品种鉴定[13,14]、杂种优势预测和分子标记辅助选择育种[15]等方面得到广泛应用.蜡梅(Chimonanthus praecox)为中国特有的花卉植物,品种多,具有较高的观赏价值.近年来,研究人员对蜡梅SRAP[16],RAPD[17],ISSR[18]和 SSR[19]等技术体系进行了深入研究,在其AFLP技术体系方面虽然也有文献报道[20~22],但存在体系不完善等问题,并且在目前所建立的体系中都没有进行引物筛选工作,给蜡梅分子生物学研究带来了很多困难.为深入开展蜡梅分子辅助育种和基因组等研究奠定基础,作者进行了蜡梅AFLP技术体系优化及引物筛选工作.
1 材料与方法
1.1 试验材料
材料为河南农业大学校区中心花坛栽植4 a的素心蜡梅(Chimonanthus praecox)健康植株当年生枝条叶片.
1.2 试验方法
1.2.1 蜡梅基因组DNA提取 蜡梅基因组DNA的提取参照张延召等[23]的方法,利用紫外分光光度计和质量分数为1%的琼脂糖凝胶电泳检测其质量.
1.2.2 蜡梅AFLP体系优化
1.2.2.1 酶切体系 参照曹喜兵等[24]的方法.总体积为 20 μL,包括 600 ng 模板 DNA,0.2 μL 100 × BSA,3 U Pst I,3 U Mse I和2.0 μL 10 × NEB Buffer,加超纯水至20 μL.混匀后在PCR仪上37℃分别酶切 1,2,3,4,5,6 h 后,80 ℃失活20 min.然后,分别取其产物5 μL在质量分数为1%的琼脂糖凝胶上电泳(4~5 V·cm-1).根据电泳结果筛选出最佳酶切时间.
1.2.2.2 连接体系 接头(由北京奥科生物技术有限责任公司合成)的制备:Pst I接头(10 μmol·L-1):分 别 吸 取 2 μL 的 Pst I 正 (5’-CTCGTAGACTGCGTACATGCA-3’)、反 (5’-TGTACGCAGTCTAC-3’)接头,然后加入36 μL的双蒸水混合至 40 μL;Mse I接头(100 μmol·L-1):分别吸取20 μL 的 Mse I正(5’-GACGATGAGTCCTGAG-3’)、反(5’-TACTCAGGACTCAT-3’)接头,然后混匀.最后把接头放在离心机上点离拿出放入4℃冰箱20 min后,放入PCR仪上60℃制接头.连接体系总体系20 μL,该体系包括15 μL上述酶切产物,0.25 μmol·L-1Pst I 接头,2.5 μmol·L-1Mse I接头,不同量(1.0,2.0,3.0,4.0 U)的 T4连接酶及 1 μL 10 × T4Buffer,加去离子水至 20 μL,然后于PCR扩增仪上在22℃条件下分别连接8,10,12,14,16,18 h,根据连接结果筛选出最佳连接时间.
1.2.2.3 预扩增体系 (1)连接产物用量优化.在各体系中分别加入 5 μL 稀释为 1,5,10,15,20,25 倍的连接产物,2.0 mmol·L-1的 Mg2+,2 U Taq酶,0.5 μmol·L-1P00,0.5 μmol·L-1M00 和 300 μmol·L-1dNTP,然后分别用去离子水补至 20 μL.(2)Mg2+用量优化.在各体系中分别加入0.5,1.0,1.5,2.0,2.5 mmol·L-1的 Mg2+,5 μL 稀释10 倍的连接产物,2.0 mmol·L-1的 Mg2+,2 U Taq 酶,0.5 μmol·L-1P00,0.5 μmol·L-1M00 和300 μmol·L-1dNTP,分别用去离子水补至20 μL.(3)Taq酶用量优化.在各体系中分别加入1.0,1.5,2.0,2.5,3.0 U 的 Taq 酶,5 μL 稀释 10 倍连接产物,2.0 mmol·L-1的 Mg2+,0.5 μmol·L-1P00,0.5 μmol·L-1M00 和 300 μmol·L-1dNTP,然后用去离子水补至20 μL.(4)dNTP浓度优化.在各体系中分别加入 100,200,300,400,500 μmol·L-1的 dNTP,5 μL 稀释10 倍的连接产物,2.0 mmol·L-1的 Mg2+,0.5 μmol·L-1P00,0.5 μmol·L-1M00和2U Taq酶,然后分别用去离子水补至20 μL.(5)引物浓度优化.在各体系中分别加入0.3,0.5,0.7,0.9,1.1 μmol·L-1预扩增引物 P00 和M00,稀释 10 倍连接产物 5μL,300 μmol·L-1dNTP,2.0 mmol·L-1的 Mg2+,2 U Taq 酶,用去离子水补至 20 μL.
1.2.2.4 选择性扩增体系 (1)预扩增产物用量优化.在各体系中分别加入 5 μL稀释5,10,15,20,25,30 倍的预扩增产物,0.5 μmol·L-1Pst I引物,0.5 μmol·L-1Mse I引物,2.0 mmol·L-1的Mg2+,300 μmol·L-1dNTP,2 U Taq 酶,加去离子水补至20 μL以进行选扩.(2)Mg2+用量优化.在各体系中分别加入 0.5,1.0,1.5,2.0,2.5 mmol·L-1的 Mg2+,5 μL 稀释 10 倍的连接产物,2.0 mmol·L-1的 Mg2+,2 U Taq 酶,0.5 μmol·L-1Pst I引物,0.5 μmol·L-1Mse I 引物和 300 μmol·L-1dNTP,分别用去离子水补至 20 μL.(3)Taq 酶浓度优化.不同体系中分别加入 0.5,1.0,1.5,2.0,2.5 U Taq 酶,5 μL 稀释 20 倍预扩增产物,0.5μmol·L-1Pst I和 Mse I引物(引物 9),300 μmol·L-1dNTP,2.0 mmol·L-1的 Mg2+,加去离子水至20 μL.(4)dNTP浓度优化.在各体系中分别加入 100,200,300,400,500 μmol·L-1的 dNTP,5 μL 稀释 20 倍的预扩增产物,0.5 μmol·L-1Pst I和 Mse I引物(引物 9),2 U Taq 酶,2.0 mmol·L-1的 Mg2+,加去离子水至 20 μL.(5)引物浓度优化.在不同的体系中分别加入 0.3,0.5,0.7,0.9,1.1 μmol·L-1Pst I和 Mse I引物及 5 μL 稀释20 倍预扩增产物,300 μmol·L-1dNTP,2 U Taq酶,2.0 mmol·L-1的 Mg2+,加去离子水补至20 μL.
1.2.3 引物筛选 利用优化后的蜡梅 AFLP体系,对64对引物(由奥科生物科技有限公司合成)组合进行筛选,筛选出适合蜡梅AFLP的选择性扩增引物.扩增程序、PCR选扩产物电泳、染色及凝胶扫描参照曹喜兵等[24]的方法,每泳道上样量为5 μL扩增产物.电泳结束后,选择谱带清晰和数目较多的引物作为AFLP反应的最佳引物.
2 结果与分析
2.1 蜡梅基因组DNA的质量
利用紫外分光光度计测定提取的蜡梅基因组DNA 的结果为:A230=0.078;A260=0.314;A280=0.174.A260/280,A260/230,A230/280的值分别为 1.805,4.026,0.448.说明提取的 DNA 无蛋白质、RNA 和酚类等小分子物质的污染.由DNA琼脂糖凝胶电泳结果表明(图1),DNA片段达到5 000 bp以上,完全能满足AFLP分析要求.
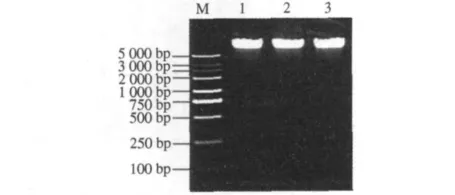
图1 不同DNA量的琼脂糖凝胶电泳检测Fig.1 Electrophoresis validation of different concentrations genome DNA
2.2 蜡梅AFLP体系优化
2.2.1 酶切反应体系优化 为了得到更好的选扩结果,选择600 ng蜡梅进行不同时间酶切处理,其琼脂糖凝胶电泳结果表明(图2),经 1,2,3,4,5,6 h酶切后,模板DNA皆能被完全切开,并且酶切片段几乎没差别,为保证蜡梅AFLP的后续试验结果,本试验选择2 h为该体系最佳的酶切时间.
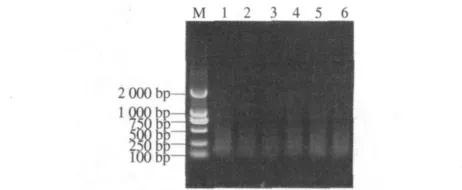
图2 不同时间酶切DNA琼脂糖凝胶电泳Fig.2 Agarose gel electrophoresis of DNA with different enzyme cut times
2.2.2 连接反应体系优化 根据琼脂糖凝胶电泳结果表明(图3),在反应体系中加入3.0 U的T4连接酶,0.25 μmol·L-1Pst I 和 2.5 μmol·L-1Mse I接头有利于蜡梅AFLP连接效果.在连接时间分别为8,10,12,14,16,18 h 条件下,随着连接时间的增加,预扩增产物量逐渐增加,为了试验最佳效果,本体系选择连接反应时间为12 h.
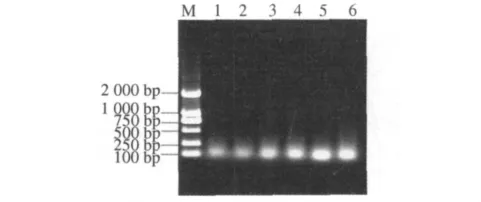
图3 不同时间连接DNA的琼脂糖凝胶电泳Fig.3 Agarose gel electrophoresis of DNA with different connection times
2.2.3 预扩增反应体系优化 不同连接产物稀释倍数结果表明(图4),连接产物用量对预扩反应有较大影响.当连接产物分别稀释1,5,10倍时,扩增片段大小几乎相同;当连接产物稀释超过10倍时,扩增产物量明显降低,因此,本体系中蜡梅AFLP预扩增连接产物以稀释10倍为宜.由不同Mg2+浓度对预扩增反应结果(图5)可以看出,当Mg2+浓度为0.5 mmol·L-1时扩增出的产物量比较模糊,而 Mg2+浓度分别为 1.0,1.5,2.0,2.5 mmol·L-1时均能扩增清晰的谱带;但 2.0 mmol·L-1时谱带丰寓而且最清晰,扩增效果最好.因此,本试验从扩增的结果和成本考虑,确定Mg2+的最优浓度为2.0 mmol·L-1.从不同Taq酶量对预扩增反应结果表明(图6).当Taq酶量为1.0 U时,扩增产物量较少,但当Taq酶量从1.5 U增加到2.5 U时,扩增产物明显增多,并且随着酶量的继续增大,扩增产物增加几乎相同.因此,选择2.0 U作为蜡梅AFLP预扩增最佳Taq酶用量.由dNTP用量对预扩增反应可以看出(图7),当dNTP浓度为 100 μmol·L-1时,预扩增产物量较低,当 dNTP浓度大于200 μmol·L-1时,预扩增产物量先升高后降低.这是dNTP与Taq酶对Mg2+竞争的结果,当 dNTP 浓度为 300 μmol·L-1时,预扩增产物量最大.因此,本试验选择300 μmol·L-1作为蜡梅预扩增最适dNTP浓度.由引物浓度对预扩增产物影响可以看出(图 8),当其浓度为 0.3μmol·L-1时,预扩增产物量较低,当其浓度从 0.5μmol·L-1增加到1.1μmol·L-1时,扩增产物增加量几乎相同.从试验成本考虑,选择 0.5 μmol·L-1为该体系的最佳引物浓度.

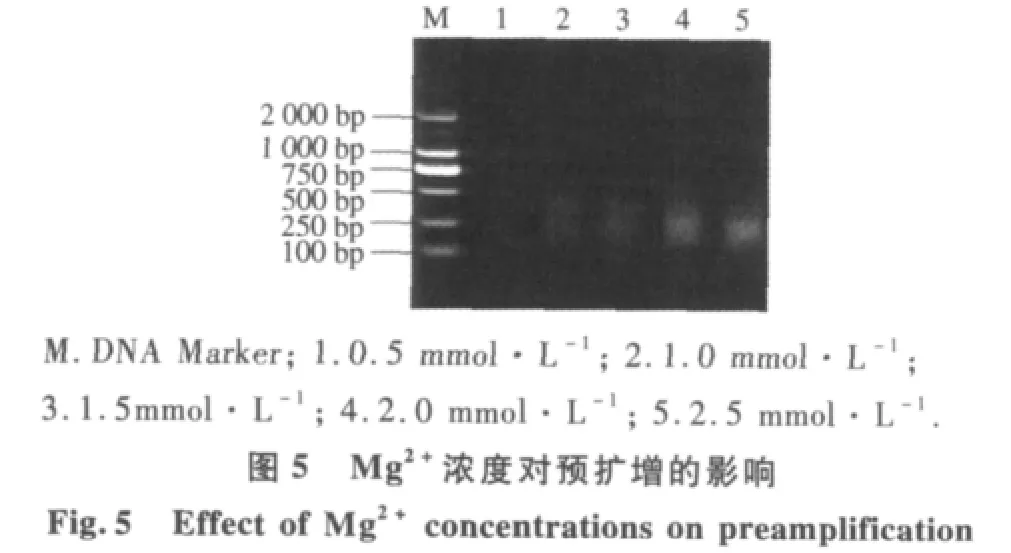
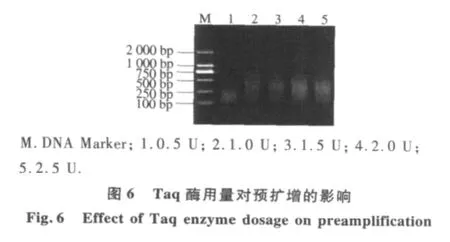
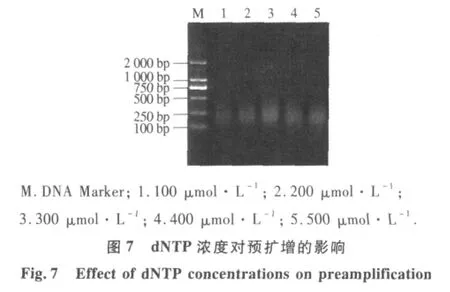
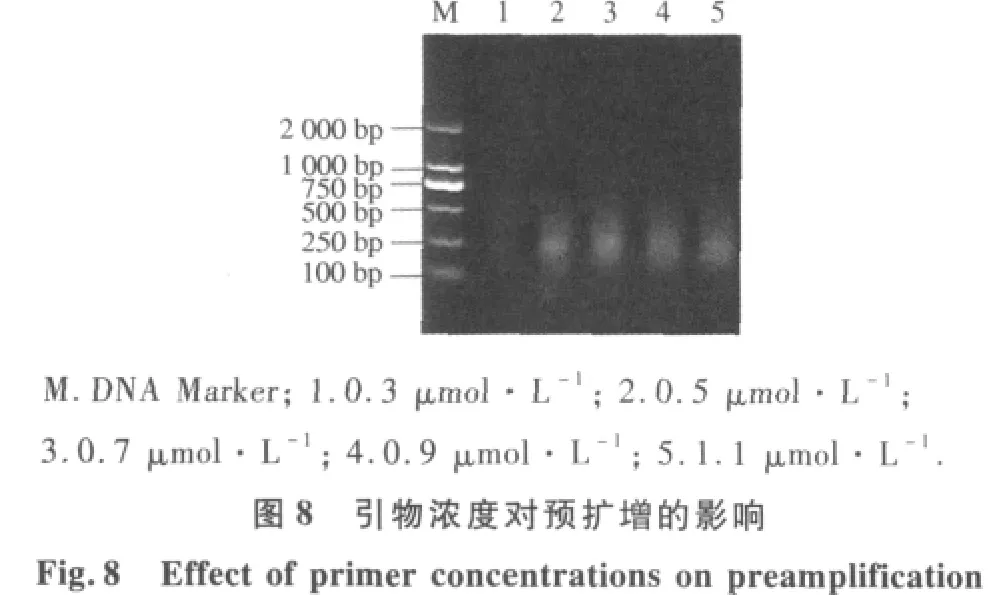
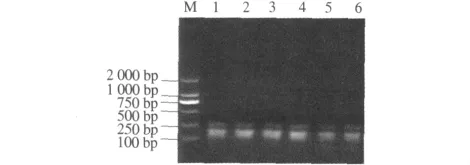
图9 连接产物稀释倍数对选扩影响Fig.9 Effect of connection product diluted times on selective amplification
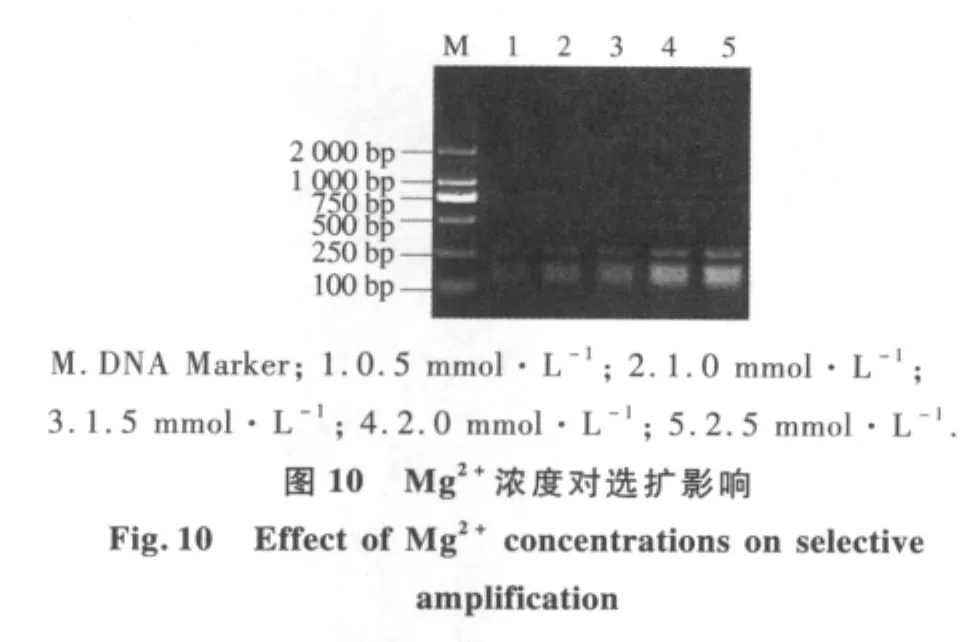
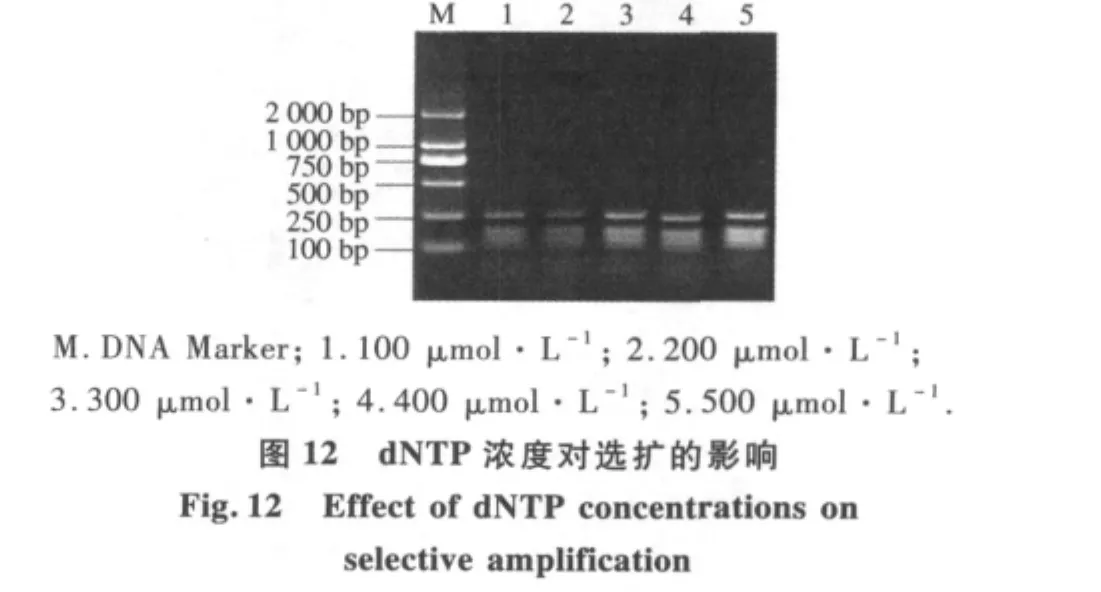
2.2.4 选择性扩增反应体系优化 不同预扩产物稀释倍数结果表明(图9),预扩产物用量对选择性扩增反应有较大影响.当预扩产物分别稀释5,10,15,20倍时,扩增片段大小几乎相同;当预扩产物稀释超过20倍时,扩增产物量明显降低,考虑到节省样品,本体系中蜡梅AFLP选择性扩增预扩产物选择稀释20倍.由不同Mg2+浓度对选择性扩增反应结果可以看出(图10),当 Mg2+浓度为0.5 mmol·L-1时扩增出的产物比较模糊,但随着Mg2+浓度的提高,扩增增出的产物量逐渐增加.因此,本试验从扩增的结果和成本考虑,确定Mg2+的最优浓度为2.0 mmol·L-1.不同Taq酶量对选择性扩增反应影响较大(图11).当Taq酶为0.5 U时,蜡梅AFLP扩增产物量较少,但当Taq酶增加到2 U时,扩增产物量明显增加.因此,选择2 U为Taq酶最适用量.dNTP浓度对于选择性扩增也有较明显的影响(图12).当dNTP浓度低于200 μmol·L-1时,选择性扩增产物量较低,当dNTP浓度大于200 μmol·L-1时,选择性扩增产物量先升高后降低.这是由于dNTP与Taq酶对Mg2+竞争的结果.当 dNTP 浓度为 300 μmol·L-1时,选扩产物量最大.因此,300 μmol·L-1为蜡梅 AFLP 选择性扩增体系中dNTP浓度的最适浓度.由不同引物浓度优化试验结果可以看出(图13),引物浓度对选择性扩增反应有较大的影响.当引物浓度为0.3 μmol·L-1时,扩增量较少,随着引物浓度增大,扩增产量逐渐增多,扩增产量趋于稳定.因此,本体系中,选取引物适宜浓度为 0.5 μmol·L-1.


2.2.5 蜡梅AFLP选择性扩增引物筛选 用上述方法优化出的蜡梅体AFLP反应体系,对64对引物组合进行筛选,筛选出了96对引物(表1).结果表明(图14),扩增产物电泳谱带清晰、分辨率高、重复性好、多态性强.因此,这些引物可用来开展蜡梅的分子生物学研究.

表1 蜡梅AFLP选择性扩增引物Table 1 Primer for AFLP of the selective amplification
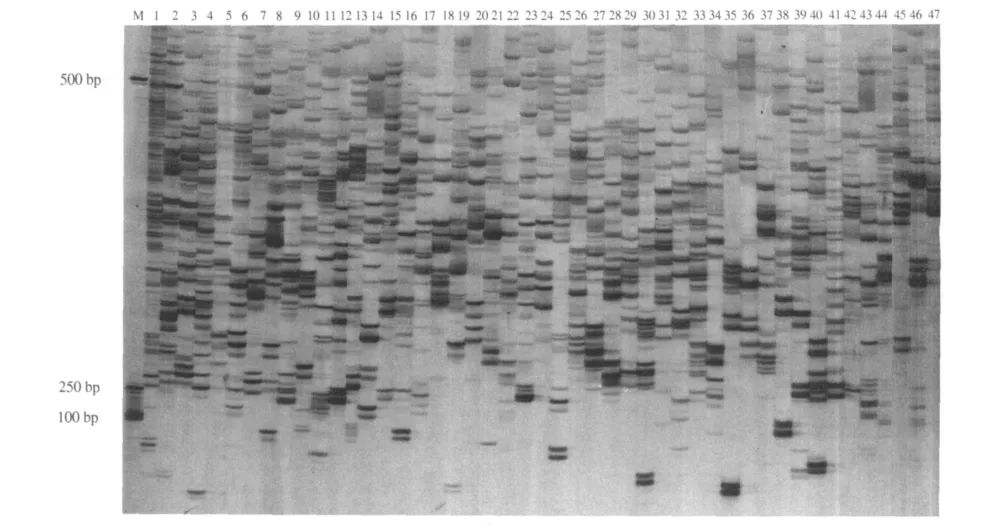
图14 47对引物的AFLP选择性扩增图Fig.14 AFLP of selective amplification with 47 pairs of primers
3 结论与讨论
本研究通过对蜡梅AFLP体系优化,得出其最佳酶切体系(20 μL)为模板 DNA 600 ng,Pst I和Mse I各为3 U,在37℃下双酶切2 h;在20 μL最佳连接体系中酶切产物为15 μL,3 U T4连接酶,0.25 μmol·L-1Pst I接头,2.5 μmol·L-1Mse I接头,1 μL 10 × T4buffer,在 22 ℃ 下连接 10 h;在20 μL最佳预扩反应体系中稀释10倍的连接产5 μL,2.0 mmol·L-1Mg2+,2 U Taq 酶,300 μmol·L-1dNTP,0.5 μmol·L-1Pst I 和 Mse I引物 (P+AGA/M+ATC);在20 μL最佳选择性扩增反应体系中5 μL 稀释 20 倍的预扩增产物,2.0 mmol·L-1的 Mg2+,2U Taq 酶,300 μmol·L-1dNTP,0.5 μmol·L-1Pst I和 Mse I引物(P+AGA/M+ATC).此外,经引物筛选试验,从64对引物组合中,选出了96对引物可用于蜡梅 DNA的 AFLP分析.
蜡梅为木本植物,其叶片中含有大量的酚类、多糖等次生代谢物质,严重影响基因组DNA的得率和纯度及下游工作的进行[21].本研究针对蜡梅叶片富含单宁和多糖等物质,利用张延召等[23]的方法提取其基因组DNA,可有效去除这些物质.该方法提取的DNA纯度高,片段大,用于AFLP反应中,能扩增出清晰的条带,为蜡梅的分子标记分析提供了基础.
[1]VOS P R,HOGERS M,BLEEKER M,et al.AFLP:A new technique for DNA fingerprinting[J].Nucleic Acids Research,1995,23(21):4407 -4414.
[2]明 军.梅花DNA指纹图谱的建立与研究[D].北京:北京林业大学,2002.
[3]曹喜兵,何 佳,翟晓巧,等.泡桐AFLP反应体系建立及引物筛选[J].河南农业大学学报,2010,44(2):145-150.
[4]SCOTT K D,ABLETT E M,LEE I S,et al.AFLP markers distinguishing an nutant of flame seedless grape[J].Euphytica,2000,113:245-249.
[5]祝 军,王 涛,赵玉军,等.应用AFLP分子标记鉴定苹果品种[J].园艺学报,2000,27(2):102 -106.
[6]连 莲,魏志刚,杨传平,等.白桦AFLP体系的建立及优化[J].东北林业大学学报,2007,35(5):1-4.
[7]YAMAMO T,SHIMADA T,KOTOBUKI K,et al.Genetic characterization of Asian chestnut varieties assessed by AFLP[J].Breeding Science,1998,48(4):359 -363.
[8]YUAN Z,YIN Y,QU J,et al.Population genetic diversity in Chinese pomegranate(Punica granalum L.)cultivars revealed by fluo-rescent-AFLP markers[J].Genet Genomics,2007,34(12):1061 -1071.
[9]孙涌栋,李贞霞,张兴国,等.黄瓜cDNA-AFLP分析体系的建立[J].华北农学报,2007,22(4):116-119.
[10]萧力争.晏嫦好,李家贤,等.凤凰单丛古茶树资源的遗传多样性AFLP分析[J].茶叶科学,2007,27(4):280-285.
[11]李艳梅,段会军,马峙英.西瓜种质资源的遗传多样性及亲缘关系的AFLP分析[J].华北农学报,2007,22(增刊):177-180.
[12]PERCIFIELD R J,HAWKINS J S,MCCOY J A,et al.Genetic diversity in hypericum and AFLP markers for species-specific identification of H.perforatum L.[J].Planta Med,2007,73(15):1614 -1621.
[13]黄玉辉,陈 涛,吴晓伟,等.甘蔗突变体AFLP分析[J].西南农业学报,2007,20(4):727-731.
[14]侯慧敏,廖伯寿,雷 永,等.花生锈病抗性的AFLP标记[J].中国油料作物学报,2007,29(2):89 -92.
[15]吴敏生,王守才,戴景瑞.AFLP分子标记在玉米优良自交系优势群划分中的应用[J].作物学报,2000,26(1):9-13.
[16]左丹丹,赵海涛,刘 春,等.蜡梅天然群体遗传多样性的SRAP标记分析[J].园艺学报,2009,36(8):1197-1202.
[17]卢建国,杜灵娟.蜡梅品种的RAPD分析[J].南京林业大学学报:自然科学版,2007,31(5):109 -112.
[18]赵 冰,张启翔.蜡梅种质资源遗传多样性的ISSR分析[J].植物研究,2008,28(3):315-320.
[19]赵明晓,范国强.蜡梅SSR反应体系建立及引物筛选[J]. 河南农业大学学报,2011,45(1):46 -50.
[20]赵 冰,张启翔.蜡梅AFLP分子标记技术体系的建立[J]. 武汉植物学研究,2007,25(1):93-97.
[21]单丽丽,肖 敏,陆瑞菊,等.古腊梅AFLP分子标记体系的建立及应用[J].上海农业学报,2008,24(3):25-29.
[22]周明芹,杨琴军,陈龙清.蜡梅AFLP-银染体系的建立与优化[J].华中农业大学学报:自然科学版,2007,26(3):394 -398.
[23]张延召,曹喜兵,翟晓巧,等.适用于AFLP分析的泡桐DNA提取方法研究[J].河南农业大学学报,2009,43(6):610 -614.
[24]曹喜兵,何 佳,翟晓巧,等.泡桐AFLP反应体系建立及引物筛选[J].河南农业大学学报,2010,44(2):368-371.
