慢性阻塞性肺疾病稳定期血清肺表面活性蛋白D和C-反应蛋白与各因素之间的关系探讨
2011-07-09周忠海颜春松
周忠海,雷 霆,颜春松
慢性阻塞性肺疾病 (COPD)是呼吸系统的常见病和多发病,我国40岁以上人群的 COPD患病率达8.2%[1]。目前COPD居全球死亡原因第四位,到2020年COPD死亡率将上升至第三位。COPD被认为是一种炎症疾病,以进行性气流受限和肺实质破坏为特征。该炎症过程不仅仅局限于肺部,还存在持续的低水平全身炎症反应[2]。C-反应蛋白 (CRP)被认为是一种非特异性系统炎症标志物,血清浓度与COPD患者的住院率和死亡率密切相关,但CRP主要产生于肺外器官,受多种因素影响,缺乏肺组织特异性。然而,肺表面活性蛋白D(SP-D)主要由肺部的Ⅱ型肺泡上皮及Clara细胞分泌,在肺损伤时血清SP-D显著升高[3]。本研究通过检测COPD稳定期CRP与SP-D浓度,探讨其浓度变化与其他因素的关系。
1 对象与方法
1.1 研究对象 2009年1月—2010年3月在我院门诊随访COPD患者35例 (COPD组)和门诊健康体检者13例 (对照组)。纳入标准:患者符合《COPD诊治指南 (2007年修订版)》中的诊断标准,急性加重缓解后超过2个月;排除标准:支气管扩张、结核、糖尿病、心力衰竭、心肌梗死、全身其他部位急性和慢性炎症性疾病、肿瘤性疾病、间质性肺疾病、风湿性疾病以及其他可能致血清CRP和SP-D浓度发生变化的疾病。
1.2 资料收集方法 在研究对象门诊随访及体检时,收集年龄、性别、吸烟量、是否戒烟,测量身高、体质量等临床信息,并测定肺功能 (通气功能+舒张试验)。
1.3 血标本收集和处理 抽取晨起空腹静脉血,CRP、中性粒细胞比例、白细胞数由本院检验科检测;5 ml不抗凝,静置1~2 h,待上层血清析出,立即以1 000 g转速离心10 min,将血清与血细胞迅速分离,取上层血清1 ml,装入编号EP管中,放入-70℃冰箱中冻存,待标本收集完全后,采用人SP-D定量ELISA试剂盒 (上海西唐生物有限公司)测定。
1.4 统计学方法 采用SPSS 13.0软件进行统计学分析,计量资料以 (±s)表示,采用方差分析,对各因素采用Pearson相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 COPD组与对照组临床状况比较 年龄、吸烟量、性别构成、白细胞数、中性粒细胞比例间差异无统计学意义 (P>0.05),而COPD组血清CRP与SP-D显著高于对照组,COPD组1 s用力呼气量占预计值百分数 (FEV1%预计值)、1 s用力呼气量占用力肺活量百分数 (FEV1/FVC)、体质指数显著低于对照组,差异有统计学意义 (P<0.05),具体见表1。
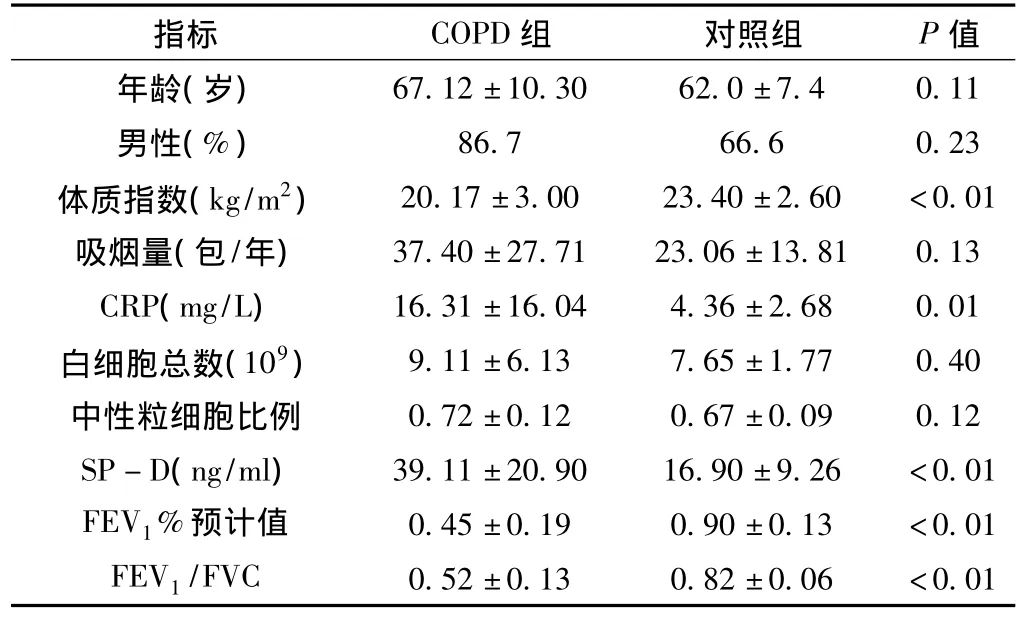
表1 COPD组与对照组的临床状况比较Table 1 Comparisons of clinical data between the COPD group and the control group
2.2 CRP及SP-D与其他指标的关系 COPD患者的体质指数与CRP之间具有显著正相关,Pearson相关系数为0.21;COPD患者血清SP-D与FEV1%预计值具有显著负向相关,Pearson相关系数为-0.48;CRP与SP-D无显著相关性,具体见表2。
3 讨论
COPD被认为是一种具有气流受限特征的可以预防和治疗的疾病,气流受限不完全可逆、呈进行性发展,与肺部对香烟烟雾等有害气体或有害颗粒异常炎症反应有关[1]。本临床研究的主要目的是为探索COPD稳定期血清CRP、SP-D的变化及与其他因素的相关性,本研究发现CRP和SP-D显著高于健康对照组,CRP与体质指数显著正相关,SP-D与FEV1%预计值显著负相关,二者与中性粒细胞比例、白细胞数、吸烟量及FEV1/FVC无显著相关性。
心血管危险因素、癌症以及可致急慢性炎症的疾病均可使CRP升高[4],运用RT-PCR和免疫组织化学技术,发现SPD广泛存在于全身多处黏膜表面,表达SP-D的器官还包括:气管、大脑、唾液腺、心脏、前列腺、肾脏和胰腺,表达SP-D的细胞还包括:肺泡巨噬细胞、皮肤、食道、小肠、泌尿道的上皮细胞等[5],上述部位的急慢性炎症病变均有可能使SP-D升高,本研究在制定纳入和排除标准时考虑到上述因素对SP-D的影响。CRP于炎症发生后6~8 h开始升高[6],Koutsokera等[7]研究显示,Anthonisen I型COPD急性加重患者经治疗后可在3 d显著降低,提示CRP随着炎症变化较快;另有研究显示,急性肺损伤小鼠血清SP-D受损后第5天开始显著升高,21 d时仍高于基础水平,1个月后与基础SP-D无显著差异[8],提示SP-D恢复正常需要1个月左右,故本研究选择COPD急性加重缓解超过2个月作为入选标准,以避免急性加重对二者浓度影响。
有证据显示,COPD存在“肺外或系统炎症”,并可通过系统炎症标志物升高的水平确定其严重程度[9]。CRP是这些炎症标志物中的一种,它主要由肝脏细胞合成,反应组织损伤及系统炎症严重程度。Gan等[10]研究发现,CRP在COPD稳定期吸烟者及肺功能降低者显著升高,这与本研究结果相似。本研究发现,CRP与体质指数存在正向相关性,这与Marie-Kathrin Breyer等的研究相似,去除肥胖患者本身存在脂肪量的影响,脂肪细胞增加可使脂肪细胞因子分泌增加,进一步使肝细胞产生和分泌CRP增加,体质指数低者与高者比较,CRP增高的程度显著减小[11],因此可出现CRP与体质指数负向相关性,这提示COPD可能存在脂肪诱导的全身炎症。
SP-D主要由Ⅱ型肺泡细胞和呼吸性细支气管上clara细胞分泌,属于胶原凝集素亚族,具有调节免疫和炎症的作用,有助于机体对病原体清除[12]。Sin等报道,SP-D是一种与肺特定相关,并可在血中检测到的蛋白,血中SP-D变化与肺部病理变化存在相关性,SP-D可能是COPD的肺部特异标记[13]。敲除SP-D基因鼠肺部的巨噬细胞被激活、金属蛋白酶产生增多、肺组织的肺气肿改变[8],说明SP-D与COPD发病及病情进展关系密切。本研究发现SP-D与FEV1%预计值存在负相关性,Sin等的研究也显示,重度和极重度COPD稳定期SP-D浓度与FEV1值呈负向相关,虽然肺部损伤严重者肺部合成SP-D降低,但肺损伤后,已合成存储在肺内SP-D可入血,这使肺损伤严重者SP-D浓度反而高,另外,COPD可导致全身炎症反应,可能存在其他部位分泌SP-D入血。本研究显示COPD患者血清SP-D显著高于健康人,这与Mutti等[14]的研究相似,COPD存在持续慢性肺部炎症,可促使SP-D分泌增加,肺上皮渗漏作用增强,可能与SP-D浓度升高有关。
综上所述,在COPD稳定期,CRP显著升高,BMI与CRP呈正向相关,在COPD病程中可能存在脂肪细胞诱导的全身炎症;SP-D显著升高,且与FEV1%预计值呈负相关,SP-D可能是监测COPD严重程度的生物标记物。
1 中华医学会呼吸病学分会慢性阻塞性肺疾病组.COPD诊治指南(2007年修订版)[J].继续医学教育,2007,21(2):31-41.
2 闫莉,刘春霞,平芬.慢性阻塞性肺疾病的非药物治疗[J].河北医药,2010,32(21):3064.
3 李瑞,王红.慢性阻塞性肺疾病治疗的研究进展[J].实用心脑肺血管病杂志,2008,16(6):80.
4 Black S,Kushner I,Samols D.C-reactive Protein [J].Biol Chem,2004,279(47):48487-48490.
5 Madsen J,Kliem A,Tornoe I,et al.Localization of lung surfactant protein D on mucosal surfaces in human tissues [J].Journal of Immunology,2000,164(11):5866-5870.
6 林云霞,胡华成.CRP在慢性阻塞性肺病急性加重期的临床意义[J].中国误诊学杂志,2009,9(9):2077.
7 Koutsokera A,Kiropoulos TS,Nikoulis DJ,et al.Clinical functional and biochemical changes during recovery from COPD exacerbations[J].Respiration Medcine,2009,103(6):926.
8 Sorensen GL,Husby S,Holmskov U.Surfactant protein A and surfactant protein D variation in pulmonary disease [J].Immunobiology,2007,212(45):381-416.
9 Agusti AG,Noguera A,Sauleda J,et al.Systemic effects of chronic obstructive pulmonary disease [J].Eur Respir J,2003,21(2):347-360.
10 Gan WQ,Man SF,Sin DD.The interactions between cigarette smoking and reduced lung function on systemic inflammation [J].Chest,2005,127(2):558-564.
11 Fantuzzi G,Mazzone T.Adipose tissue and atherosclerosis:exploring the connection[J].Arterioscler Thromb Vasc Biol,2007,27(5):996-1003.
12 Takahashi H,Chiba H,Shirator IM,et al.Elevated serum surfactant protein A and D in pulmonary alveolar microlithiasis[J].Respirology,2006,11(3):330-333.
13 Dahl M.Biomarkers for chronic obstructive pulmonary disease-Surfactant protein D and C-reactive protein [J].American Journal of Respiratory and Critical Care Medicine,2008,177(11):1177-1178.
14 Mutti A,Corradi M,Goldoni M,et al.Exhaled metallic elements and serum pneumoproteins in asymptomatic smokers and patients with COPD or asthma [J].Chest,2006,129(5):1288-1297.
