铁掺杂TiO2粉末的制备工艺与光催化活性研究
2011-07-02吕烨田鹏辛世刚毛媚赵婷婷于巧伟
吕烨 田鹏 辛世刚 毛媚 赵婷婷 于巧伟
沈阳师范大学( 沈阳 110034 )
TiO2因其光学和电子性能、成本低、化学稳定性和无毒性成为非常有前景的光催化剂之一、。然而由于其禁带较宽,只有一小部分波长短的太阳光能(λ<387 nm)才能被吸收,太阳能利用率很低;另外,受光激发形成的空穴和电子易于复合,降低了光量子效率,光催化效率降低。因此,对 TiO2的改性成为了当前人们研究的重要课题。而过渡金属Fe3+掺杂,既可减少光生电子与空穴的复合,又可以使光的吸收范围扩大至可见光区 。
本研究以钛酸四丁酯为前驱体,无水乙醇作为溶剂,硝酸作为负催化剂和稳定剂,用溶胶—凝胶法(sol-gel method)合成了TiO2凝胶,并制备了纯的和不同掺铁量的 TiO2粉末。在实验中通过改变原料的配比和温度等,对溶胶凝胶过程的机理进行探究。并对不同掺铁量、不同锻烧温度的样品的光催化性能进行了研究。
1 实验部分
1.1 主要仪器与试剂
(1)仪器
恒温磁力搅拌器 85-1(中外合资深圳天南海北有限公司);
WS70-1型红外线快速干燥器 (南通科学仪器厂);
箱式电炉 SRJX (上海锦屏仪器仪表有限公司);
UV9600紫外可见分光光度计(北京瑞利分析仪器公司);
PLS光化学反应系统(北京泊菲来科技有限公司);
砂芯过滤漏斗 (长春市华宇玻璃仪器有限公司);
SHZ-C型循环水式多用真空泵 (河南巩义英峪予华仪器厂)。
(2)试剂
钛酸四丁酯(分析纯)(国药集团化学试剂有限公司);
无水乙醇(分析纯)(沈阳化学试剂厂);
硝酸(优级纯)(沈阳化学试剂厂);
硝酸铁(分析纯)(沈阳化学试剂厂);
蒸馏水;
1.2 溶胶——凝胶法的反应机理
用溶胶——凝胶法制备纳米 TiO2粉体一般以钛醇盐 Ti(OR)4(R=-C2H5,-C3H7,-C4H9)为原料,钛醇盐与水发生水解反应,同时发生失水和失醇缩聚反应,生成物形成溶胶;经陈化,溶胶形成三维网络而形成凝胶;干燥凝胶以除去残余水分、有机基团和有机溶剂,得到干凝胶;干凝胶研磨后锻烧,除去化学吸附的烃基和烷基团,以及物理吸附的有机溶剂和水,得到纳米 TiO2粉体。
实验中水解、缩聚反应式如下:
水解反应:
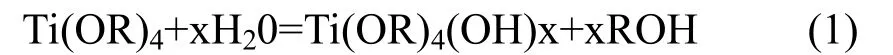
失水缩聚:
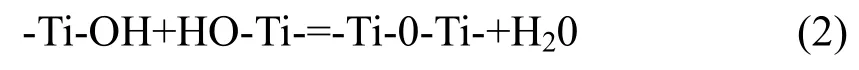
失醇反应:
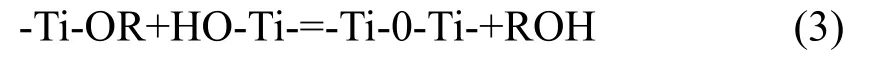
式中R可以是Me、Et、Pr、Bu等大小不同的烷基团,上述过程中水解反应一旦发生失水和失醇缩聚反应即相继进行。因为钛醇盐的水解活性很高,因此,需加催化剂来减缓其水解速度。常用的催化剂有盐酸、氨水、硝酸等。
1.3 催化剂的制备
(1)纯TiO2及掺铁TiO2的制备
① TiO2凝胶的制备
以钛酸四丁酯[Ti(OC4H9)4]为原料、无水乙醇(C2H5OH)为溶剂、硝酸为催化剂制备TiO2溶胶。实验中将无水乙醇分成二部分, 将钛酸四丁酯与总体积 2/3的无水乙醇均匀混合,充分搅拌,形成了A溶液;再将另外1/3的无水乙醇与适量的硝酸及去离子水充分混合配成 B溶液。在一定温度下,将B溶液用滴管滴加到A溶液中,同时并不断搅拌,使其反应充分。在室温下将溶液陈化制得 TiO2凝胶。实验中的胶凝时间的起点是加入的水与钛酸四丁酯相接触,其终点是得到的胶体倾斜时失去流动性。
掺铁TiO2的制备是将溶液B中的去离子水换成不同浓度的硝酸铁溶液,其他步骤与制备纯TiO2相同。
②TiO2粉体的制备
将上述条件下制得的 TiO2凝胶进行干燥,形成干凝胶。再将干凝胶于一定温度下在马弗炉中锻烧。取出后研磨得到 TiO2粉体。不同的锻烧温度下将得到不同晶型的TiO2。溶胶-凝胶法制备TiO2凝胶的工艺流程如图1所示。
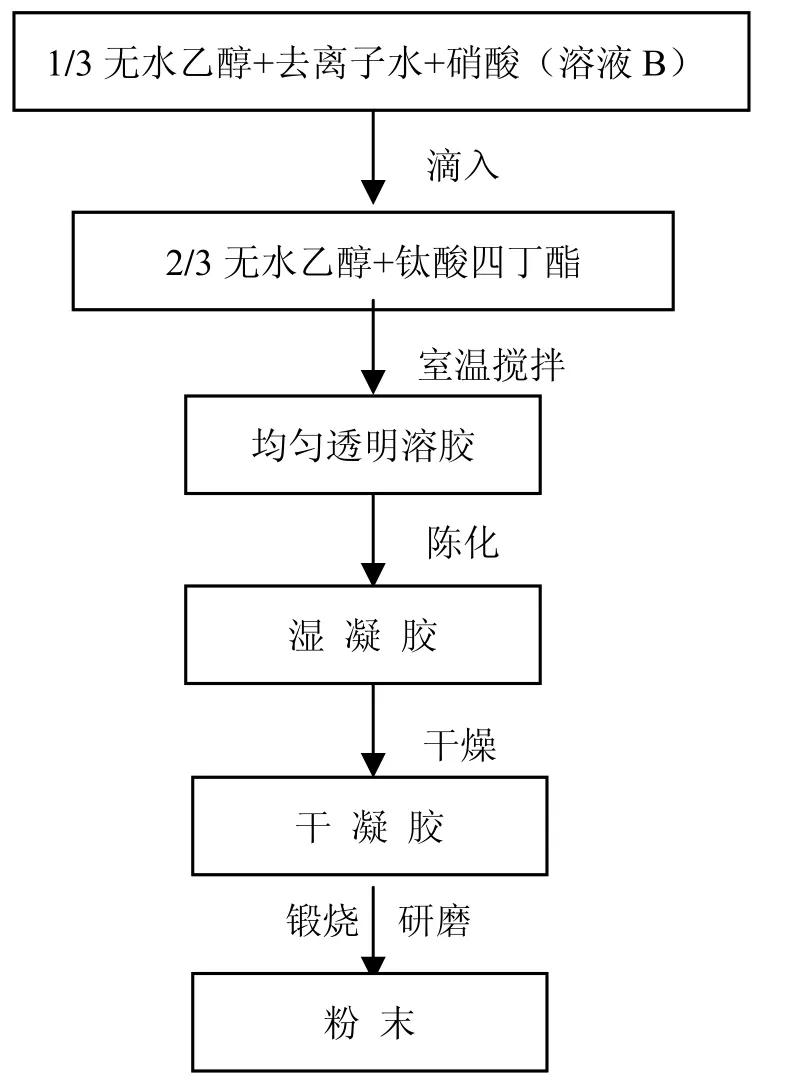
图1 溶胶-凝胶法制备TiO2的工艺流程
1.4 光催化性能实验
以紫外灯(254 W)为光源,以甲基橙溶液为降解对象。为了评价制得的 TiO2的光催化活性, 用反应一段时间后甲基橙的分解百分率,即甲基橙反应后浓度降低值与初始浓度之比来衡量光催化活性。
具体的过程为:将500 mL初始浓度为l0 mg/L的甲基橙溶液和0.5 g催化剂加入反应器中,暗态吸附30min后测初始吸光度值Ao,磁力搅拌下使甲基橙溶液在紫外光照射3 h发生降解反应。每隔0.5 h后取出一定量样品,经过砂芯漏斗抽滤除去TiO2粉末,取其滤液用紫外-可见分光光度计测在其最大吸收波长(λ=464 nm)处的吸光度A。
由于在较低质量浓度范围内甲基橙溶液的浓度和吸光度成正比,因此,试样的光降解率可以表示为:D =[( Ao-A)/Ao]×100 %。在相同的时间内光降解率越大,则TiO2光催化的活性越高。
2 实验结果与讨论
试验目的为了使得到的凝胶透明均匀稳定,并且通过影响试验的各方面因素控制凝胶时间。
2.1 加水量对凝胶时间的影响
n[Ti(OBu)4]:n[EtOH]:n[HNO3]=l:18:0.06,室温下,设n[H2O]:n[Ti(OBu)4]=N。在不同的掺水量下所测得的实验结果如表1和图2所示。
由图 2可以看出,掺水量对凝胶时间的影响较大。在N=3附近,胶凝时间最短,当N<3时,随着 N的增大,胶凝时间迅速变短。是因为加水量与所制备的溶胶的粘度有关,随加水量的增多,溶胶的粘度增大,缩聚物的交联度和聚合度也随之增大,从而使胶凝时间缩短。相反,当N>3时,从图表可见,胶凝时间随加水量增多呈现略微上升的趋势。这是由于过量的水冲淡了聚合物的浓度,使溶胶的粘度下降,凝胶时间略微延长。
2.2 硝酸含量对凝胶时间的影响
n[Ti(OBu)4]:n[Et0H]:n[H20]=l:18:3,室温下,设n[HNO3]: n[Ti(OBu)4]=N。在不同的硝酸含量下所测得的实验结果如表2和图3所示。

表1 不同掺水量与凝胶时间的关系

表2 不同硝酸含量与凝胶时间的关系
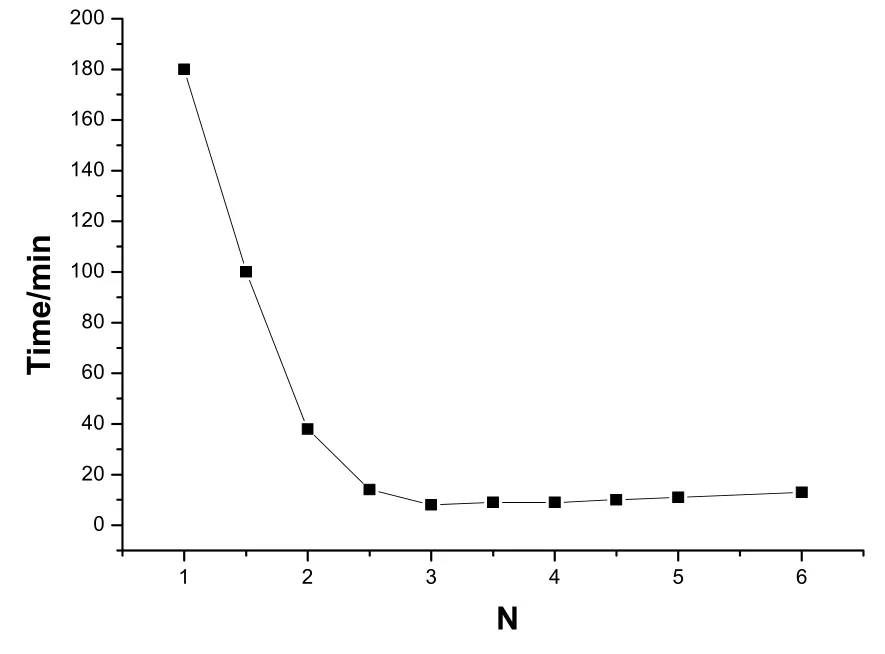
图2 不同加水量与凝胶时间关系
硝酸是作为此反应的稳定剂和催化剂。由图3可以看出, 凝胶时间随钛醇盐溶液中硝酸含量的增加而延长,且当 n[HNO3]: n[Ti(OBu)4」>0.35时凝胶时间显著增加,原因是在溶胶一凝胶过程中,加入的酸有两个作用:①抑制水解,溶液中加入H+,使H2O→H++OH-的反应逆向进行,水解反应变慢;②使M-OR中的OR基团质子化,从而使胶体粒子带有正电荷,阻止胶粒凝聚。因此,硝酸含量对凝胶时间有显著影响,硝酸含量越高,凝胶时间就越长。
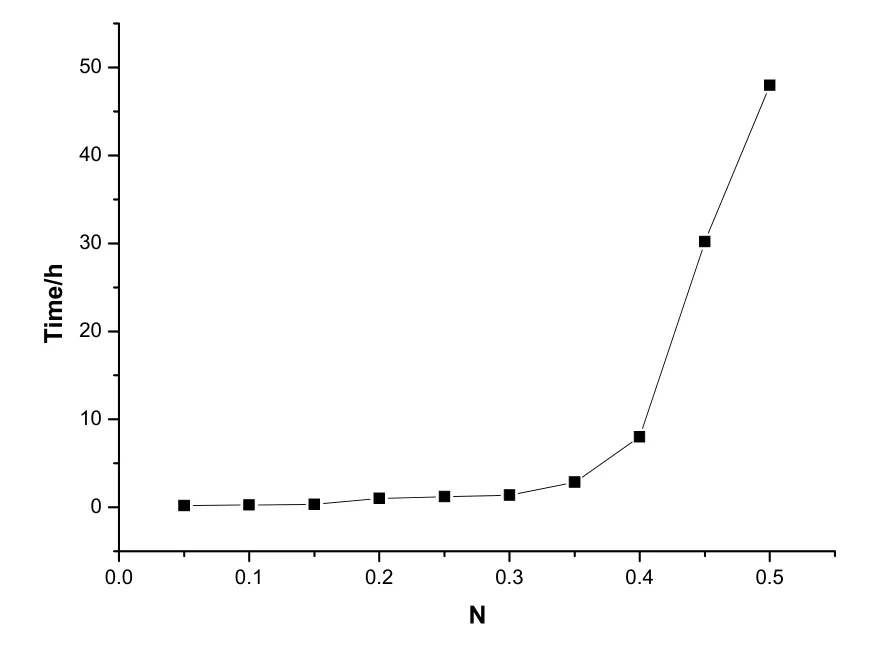
图3 不同HNO3量与凝胶时间的关系
2.3 乙醇量对凝胶时间的影响
室 温 下 ,n[Ti(OBu)4]:n[H20]:n[HNO3]=1:3:0.35,设 n[EtOH]: n[Ti(OBu)4]=N。在不同的乙醇量下所测得实验结果如表3和图4所示。
从图4可以看出, 溶剂乙醇量的多少对凝胶时间的影响较大。随着乙醇量的增加,凝胶时间相应延长。乙醇作为溶剂, 起着溶解和分散Ti(OC4H9)4的作用, 使 Ti(OBu)4分散均匀,并增大其流动性。当N=18时,凝胶时间明显增加,这是由于乙醇不仅能抑制钛酸四丁酯的水解反应,而且还发生酯醇解反应。当溶剂较少时,钛酸四丁酯和H2O的浓度较大,水解缩聚速度较快;当溶剂较多时,乙醇量的增加有利于分散Ti(OC4H9)4,且降低了 Ti(OC4H9)4的浓度, 使得Ti(OH)x(OBu)y单体很难接触,交联成链的可能性小,聚合反应速度很慢,从而减缓了水解速率, 溶胶体系更稳定,凝胶时间延长。
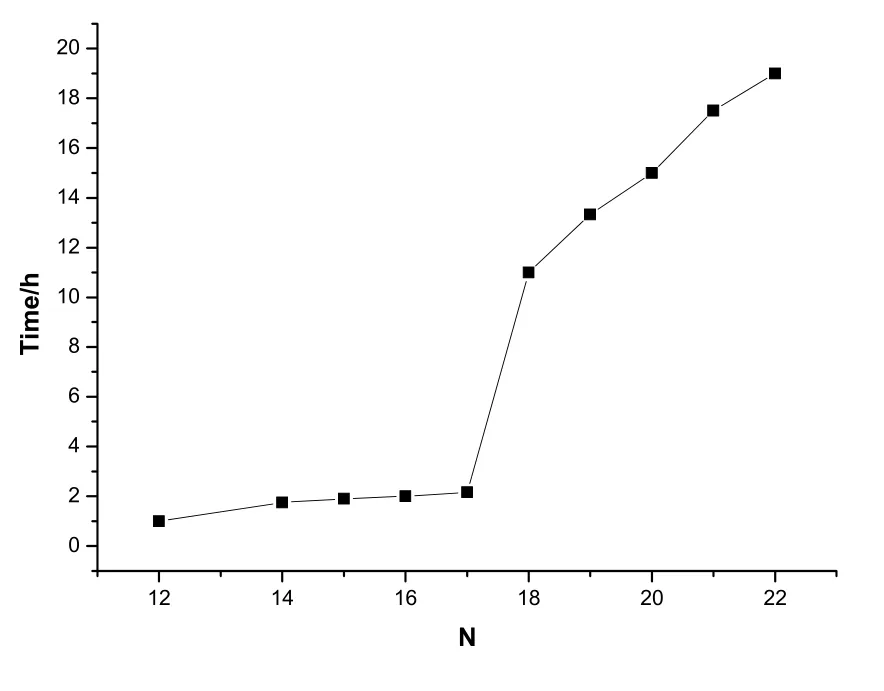
图4 不同乙醇量与凝胶时间的关系
2.4 水解温度对凝胶时间的影响
n[Ti(OBu)4]:n[Et0H]:n[H2O]:n[HNO3]=l:18:3:0.35,在不同的水解温度下测得的实验结果如表4和图5所示。由图5可知,反应温度越高,胶凝时间越短,溶胶越不稳定。水解温度t<30 ℃时胶凝时间较长,溶胶稳定,而温度在 50 ℃附近时,胶体极不稳定。 原因是温度越高,溶液分子运动加剧,接触几率越大,水解缩聚反应速率越快,反应越不易控制,进而大大缩短胶凝时间; 另一方面,当温度t>40 ℃时有机溶剂和水都会有部分挥发出来,使得水解缩聚反应物的浓度增大, 缩聚反应所得的聚合物的浓度也增加, 进一步缩聚和聚沉,从而使胶凝时间更快缩短。
2.5 其它因素对凝胶时间的影响
在实验中,还有许多对凝胶时间的影响因素,现介绍如下,以供大家在制作TiO2凝胶时探讨。
(1)鳌合剂对凝胶时间的影响
在制备 TiO2时可采用的鳌合剂有许多种,如冰醋酸(也称冰乙酸)、二乙醇氨、三乙醇氨、乙酰丙酮和异丙醇等。它们在反应中可生成含二配位基团的大聚合物,这些聚合物再发生水解缩聚反应,可形成三维空间的网状结构,从而起到延缓水解和缩聚反应的作用。
(2)加水方式对凝胶时间的影响
实验中发现,配制滴加液,是直接倒入还是采用滴加的方式,滴加速度的快慢都会直接影响到胶凝时间。若把水一次性倒入钛酸四丁酯溶液中,或把钛酸四丁酯溶液一次性倒入水中,水解缩聚反应很快完成,会产生块状沉淀或使溶液变浑浊,得不到稳定的溶胶。若将钛酸四丁酯、乙醇配成溶液 A,乙醇、去离子水、催化剂配成溶液 B,改用滴加方式,将B在剧烈搅拌下匀速滴入A中,由于无水乙醇和催化剂减小了水的浓度,使水解反应速度减慢,同时水解生成的聚合物会有一部分溶于乙醇,浓度降低,因而阻碍了 TiO2溶胶粒子的进一步团聚,从而得到稳定的溶胶。相反若直接把水一次性倒入钛酸四丁酯溶液中,由于水解速度过快,水解产生的聚合物来不及溶解而直接发生缩聚反应,使反应的聚合物迅速碰撞交联而形成沉积物,因而得不到稳定的溶胶。若按图l所示的Sol-gel工艺流程,先配制滴加液,再将滴加液慢慢滴加入钛酸四丁酯溶液中,并在滴加时不断搅拌,这样制得的溶胶会更加均匀、稳定,水解反应控制得更好,胶凝时间也会得以延长。
(3)搅拌对凝胶时间的影响
Sol-gel转变过程是一个二级反应的过程。其流变特征可分为4个阶段,①膨胀性流体阶段,此间若增强搅拌力度会促进水解和缩聚反应,缩短胶凝时间;②牛顿流体阶段,此间流体中粘度的变化同剪切速率无关,即增强搅拌对胶凝时间无意义;③假塑性流体阶段,在此阶段,胶体粒子之间发生交联,形成一定的网络结构,这时搅拌强度越大,对网络破坏越厉害,从而使溶胶向凝胶转变的延缓作用越明显,即胶凝时间越长;④凝胶形成阶段。通过以上各种条件的实验,确定制备稳定的TiO2凝胶的最佳条件如下。
⑴采用滴加式加入水且最好配成水、催化剂及无水乙醇的混合物;
⑵制备TiO2溶胶体系的配比
⑶水解温度应当控制在25 ℃左右。

表3 不同乙醇量与凝胶时间的关系

表4 不同水解温度与凝胶时间的关系
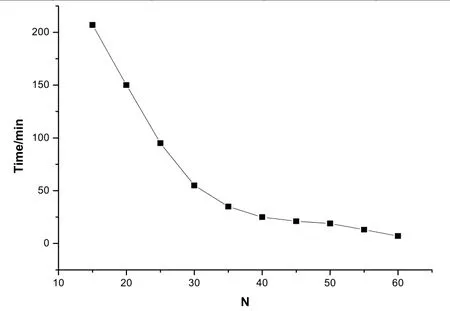
图5 不同水解温度对凝胶时间的影响
以此配比和条件制得的溶胶透明度好,比较稳定均匀,并且较容易控制凝胶时间。
2.6 掺铁量对光催化活性的影响
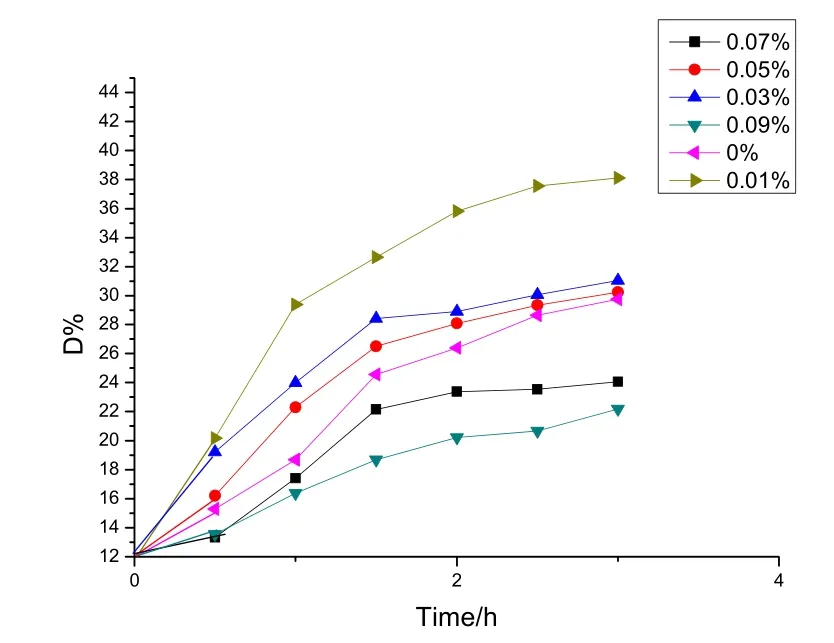
图6 不同掺杂量样品对甲基橙的光降解率
图6为不同掺铁量的催化剂在煅烧温度为500 ℃时紫外光下照射3 h对甲基橙的降解率。实验发现,用溶胶-凝胶法制得的 Fe- TiO2粉末,随着 Fe3+含量的增大光催化剂呈现出不同程度的红褐色,且含量越高颜色越深,这可能是因为Fe3+在高温下与氧作用生成Fe2O3。由图6可以看出,催化剂的光催化活性随着Fe3+掺杂量的增大而减小。掺杂量为 0.01%、0.03%和 0.05%的Fe-TiO2催化剂的催化效率均比纯的TiO2的催化效率高,掺杂量为0.07%和0.09%的Fe-TiO2催化剂的催化效率反而比纯的 TiO2的催化效率低,实验中Fe3+的最佳掺杂量为0.01%。这可能是由于:当Fe3+的掺杂量较低时, Fe3+进入到TiO2晶格中会置换出其中的部分Ti4+, 产生晶格置换缺陷, 这有助于电子-空穴对的分离, 延长·OH自由基的寿命, 从而能有效地提高光催化效率。并且 Fe3+的加入使 TiO2表面亲水性增强, 有利于高催化活性羟基的产生, 即光生空穴与表面羟基—OH 直接作用生成·OH,电子-空穴对在空间电荷的作用下, 发生有效分离, 空穴迁移到颗粒表面, 与颗粒表面的羟基作用生成具有高氧化性的氢氧自由基, 有利于光催化性能的提高。但随着掺杂量进一步增多反而不利于光催化性能的提高,当Fe掺杂量过大时,大量的过渡金属离子会成为复合中心,Fe3+捕获光生电子生成的大量 Fe2+又可能成为光生空穴的捕获剂而生成 Fe3+,从而间接地使光生电子和空穴发生复合。另外,由于进入 TiO2晶格中的 Fe3+达到饱和,剩余的部分Fe3+可能以氧化物的形式沉积覆盖在TiO2晶体表面,使催化剂表面TiO2活性位减少,降低了光催化效率。
2.7 煅烧温度对光催化活性的影响
图7为不同煅烧温度下的掺铁0.01%的Ti02粉末在紫外光下照射1 h光催化降解甲基橙的效率。从图7可以看出,随着煅烧温度的升高,催化剂的光催化活性呈现出先上升后下降的趋势,在450 ℃时催化剂具有最好的光催化效果。这可能是因为在 400 ℃之前粉末中的有机物尚未完全分解挥发掉,使粉末呈灰色,造成表面活性中心较少影响了光催化活性。在煅烧过程中,部分Fe3+会进入到TiO2晶格中取代部分Ti4+,导致局部的晶格畸变,从而增大了TiO2的光催化活性,随着煅烧温度的升高,这种增强作用越明显,在450~500 ℃时Fe的氧化物在催化剂表面分散均匀,能够作为光生电子的捕获陷阱,有利于电子与空穴的分离,因此光催化活性最好。但随着煅烧温度的继续升高,附着在TiO2表面上的Fe的氧化物会有团聚的趋向。当该氧化物过多聚集在一起时,就会增加电子一空穴对结合位的数量,反而会降低光催化活性。另外,随着锻烧温度的不断升高,TiO2由无定型态转变为锐钛矿相,随着温度的继续升高,晶相开始由锐钛矿转变为锐钛矿和金红石相的混合晶相,直至完全转变为金红石相。研究者普遍认为锐钛矿相比金红石相的催化活性好。
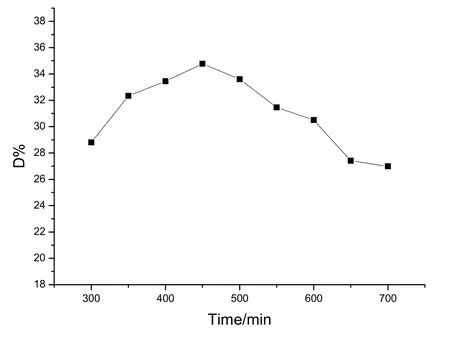
图7 不同煅烧温度样品对甲基橙的光降解率
3 结论
(1)在制备TiO2凝胶的过程中,对凝胶时间的影响因素主要有:加水量、硝酸量、溶剂量、水解温度等。实验结果表明无水乙醇与钛酸四丁酯的摩尔比为 18:1,钛酸四丁酯与蒸馏水的摩尔比为1:3,钛酸四丁酯与硝酸的摩尔比为1:0.35,水解温度控制在25 ℃左右时为制备稳定凝胶的最佳工艺条件。
(2)铁的掺杂量为0.01%(Fe原子与Ti原子的摩尔比)、煅烧温度为450 ℃时制备的TiO2粉末在紫外光下催化降解甲基橙的效果最好。
[1]刘彦.纳米TiO2的溶胶—凝胶法的凝胶机理及晶相转化.北京化工大学硕士研究生学位论文,2005.5.
[2]周林,郭秀生.掺杂铁纳米 TiO2的制备及其光催化性能研究.工业催化,2004.12(4).
[3]胡安正,唐超群.Sol—Gel法制备纳米TiO2的原料配比和胶凝过程机理探研.功能材料,2002.33(4).
[4]刘彦.纳米 TiO2的溶胶——凝胶法的凝胶机理及晶相转化.北京化工大学硕士研究生学位论文,2005.5.
[5]胡安正,唐超群.Sol—Gel法制备纳米TiO2的原料配比和胶凝过程机理探研.功能材料,2002.33(4).
[6]温敏,齐公台等.TiO2溶胶的制备及其胶凝过程影响因素分析.表面技术,2004.33(1).
[7]胡安正,唐超群.Sol—Gel法制备纳米TiO2的原料配比和胶凝过程机理探研,功能材料.2002.33(3).
[8]李巧玲,赵静贤等.铁掺杂 TiO2微米带的制备及其光催化性能.化学学报,2010.68(5).
[9]李明利,徐明霞等.可见光活性负载型 Fe2O3/TiO2光催化剂的制备.硅酸盐学报,2006.34(9).
[10]孙明,魏锡文等.铁掺杂TiO2纳米粉的制备、表征及其光催化活性.材料导报,2007.21.
[11]张小丽,毛健等.Ce改性TiO2纳米粒子的制备及光催化活性.稀有金属材料与工程,2006.35.
