海洋厌氧反硝化细菌Pseudomonas stutzeri抗菌活性物质的研究
2011-07-02顾晓洁穆军张翼梁羽甜李文
顾晓洁,穆军,张翼,梁羽甜,李文
(大连交通大学 环境与化学工程学院,辽宁 大连 116028)*
0 引言
由微生物引起的感染性疾病是我国最常见的疾病.随着感染性疾病发病率的上升和各类抗生素新药的不断涌现,临床治疗急需的新型抗感染药物将成为医药市场上增长新热点.海洋细菌中蕴藏着许多具有生物活性的新化合物,是开发新药的宝贵资源,在众多的海洋细菌活性代谢产物中,抗微生物活性一直受到广泛的关注,因而筛选抗菌活性化合物产物已成为药物研发的重要方面[1-2].
从海洋底泥中分离海洋厌氧细菌具有取材方便、细菌种类丰富的特点.然而,目前大多数具有抗菌生物活性的海洋细菌主要从海洋动物、植物体表或者体内分离得到,直接从海洋底泥中进行具有抗菌生物活性的海洋厌氧细菌分离与鉴定的研究则少有报道[3].反硝化细菌多属革兰氏阴性细菌,是指能引起反硝化作用的细菌.迄今为止,对于反硝化细菌的研究仅限于土壤[4]、大气[5]、污水处理[6]、水产养殖[7]和菌株的分离、鉴定与活性筛选[8]五方面.

图1 化合物1-4的结构式
本文以海洋厌氧反硝化细菌Pseudomonas stutzeri(No.DN7)的次生代谢产物为研究对象,从其乙酸乙酯部分得到4个活性单体化合物(结构式见图1),并对其进行鉴定和抗菌活性测试,为今后更多活性成分的制备分离奠定了基础,对新抗生素的筛选及新药的开发也具有重要的意义.
1 实验方法
1.1 材料、试剂与仪器
研究所用菌株于2007年10月从中国渤海海域的海洋底泥中分离获得.经大连交通大学资源与环境生物技术研究所穆军教授鉴定为Pseudomonas stutzeri(No.DN7),已于2008年10月30日保藏在中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为:CGMCC No.2732.活性指示菌:铜绿假单胞菌 (Pseudomonas aeruginosa)和枯草芽孢杆菌(Bacillus subtilis)购自中国科学院微生物研究所.
所用试剂除供高效液相色谱分析用甲醇之外,均为分析纯.
SDJ-超净工作台(上海博讯医疗设备厂),SPX-250B型生化培养箱(上海跃进医疗器械厂),三用紫外分析仪(上海精科实业有限公司),Thermo Scientific Multiskan Ascent型酶标仪(上海赛默飞世尔科技公司),P230型高效液相色谱仪(大连依利特分析仪器有限公司),C18-HPLC柱(Hypersil 5 μm 填料,4.6 mm ×250 mm,大连依利特分析仪器有限公司),EI-MS谱用JMSD300型质谱仪,Bruker AC2300型核磁共振仪(德国Bruker公司)).
1.2 提取与分离
100 L菌株发酵液浓缩至5 L,依次用等体积乙酸乙酯、正丁醇萃取.乙酸乙酯萃取部分去除溶剂得到固体约5.6 g.正丁醇萃取部分浓缩去除正丁醇,甲醇溶解后抽滤,弃去不溶物,反复3次脱去无机盐,合并滤液浓缩至干得到固体约27.1 g.对乙酸乙酯部分进行ODS硅胶柱层析,依次用30%、50%、70%、90%、100%甲醇洗脱.采用纸片法模型筛选层析各组份的抗菌活性[8],发现30%、70%甲醇洗脱部分具有明显活性(见附表).30%甲醇洗脱部分HPLC色谱分离条件:检测器 UV,柱温 25℃,流速 1 mL/min,波长 =254 nm,流动相为甲醇-水=30%,收集时间为20.1 min,得到化合物 1(5 mg);收集时间 25.9 min,得到化合物2(3 mg).70%甲醇洗脱部分HPLC色谱分离条件:检测器UV,柱温 25℃,流速1 mL/min,波长=254 nm,流动相为甲醇-水=70%,收集时间为16.6 min,得到化合物3(5 mg);收集时间18.1 min,得到化合物4(4 mg).
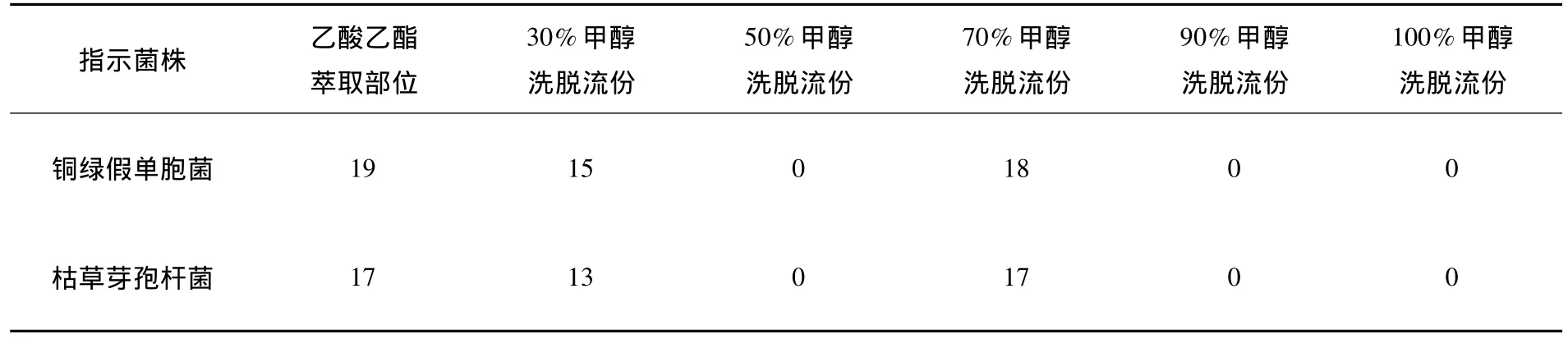
附表 DN7样品各组分抑菌圈直径 mm
1.3 单体化合物的活性评价
化合物1-4配制成所需浓度的甲醇溶液,按照浓度高低依次加入96孔板,45℃减压挥干.用无菌生理盐水将铜绿假单胞菌、枯草芽孢杆菌分别制成0.5麦氏浊度菌悬液.精密吸取20 μL的菌悬液加入装有20 mL液体M-H培养基的三角瓶中稀释1000倍,在96孔板每孔中加入100 μL稀释液,35℃培养16~24 h.每个样品均做3次平行实验.用酶标仪在595 nm和630 nm处测定其吸光度值,测定完毕后,每空加入25 μL 5 mg/mL MTT(四氮唑蓝)溶液染色,20 min后在540 nm处再次测定吸光度值.通过公式:抑菌率(%)=(阴性对照OD值-样品OD值)/阴性对照OD值×100,计算化合物1~4在540 nm处的抑菌率(见图2~5).
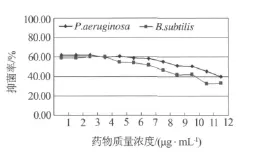
图2 化合物1的抑菌率
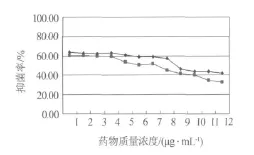
图3 化合物2的抑菌率
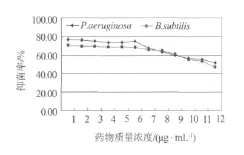
图4 化合物3的抑菌率
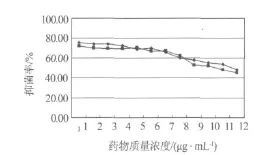
图5 化合物4的抑菌率
2 结构鉴定
化合物1:淡黄色针晶.EI-MS(m/z):145(M+),144(M+-H,100%).1H NMR(500 MHz,MeOD)δ:7.29(2H,m,H-5,6),7.47(1H,dd,J=5.3 Hz,3.7 Hz,H-7),7.85(1H,d,J=2.8 Hz,H-2),8.23(1H,dd,J=5.3 Hz,3.4 Hz,H-4),8.83(1H,b,NH),9.97(1H,s,CHO).13C NMR(125 MHz,MeOD)δ:187.4(CHO),139.6(C-2),122.4(C-4),123.6(C-6),125.0(C-5),113.1(C-7).以上数据与文献[9]报道一致,故确定化合物1为3-吲哚甲醛.
化合物2:无色针晶.EI-MS(m/z):152(M+),151(M+-H,100%).1H NMR(500 MHz,CDCl3)δ:7.72(2H,dd,J=3.3,5.7 Hz,H-2,H-6),7.52(2H,dd,J=3.3,5.7 Hz,H-3,H-5),3.9(3H,s,-OCH3).13C NMR(125 MHz,CDCl3)δ:160.9(C-7),132.7(C-1),131.9(C-4),131.1(C-3),131.1(C-5).以上数据与文献[10]报道基本一致,故鉴定化合物2为对羟基苯甲酸甲酯.
化合物3:白色固体.EI-MS(m/z):278(M+),277(M+-H,100%).1H NMR(500 MHz,MeOD)δ:7.74(2 H,m,H-3,6),7.60(2 H,m,H-4,5),4.08(4 H,d,J=6.8 Hz,H-1',1″),2.04(2 H,J=6.7 Hz,H-2',2″),0.99(12H,d,J=6.8 Hz,H-3',3″,4',4″).13C NMR(125 MHz,CDCl3)δ:169.3(C-7,8),133.6(C-1,2),132.4(C-4,5),130.0(C-3,6),72.9(C-1',1″),28.9(C-2',2″),19.4(C-3',3″,4',4″).以上数据与文献[11]报道一致,故确定化合物3为邻苯二甲酸二异丁酯.
化合物4:白色固体.EI-MS(m/z):278(M+),277(M+-H,100%).1H NMR(500 MHz,MeOD)δ:7.73(2 H,m,H-3,6),7.60(2 H,m,H-4,5),4.29(4 H,t,J=6.7 Hz,H-1',1″),1.72(4 H,J=7.2 Hz,,H-2',2″),1.45(4 H,J=7.4 Hz,H-3',3″),0.98(6 H,t,J=7.5 Hz,H-4',4″).13C NMR(125 MHz,CDCl3)δ:169.3(C-7,8),133.6(C-1,2),132.3(C-4,5),129.9(C-3,6),66.7(C-1',1″),31.7(C-2',2″),20.2(C-3',3″),14.0(C-4',4″).以上数据与文献[12]报道一致,故确定化合物4为邻苯二甲酸二正丁酯.
3 结论
本文采用抗菌活性追踪的方法,首次从海洋厌氧反硝化细菌Pseudomonas stutzeri(No.DN7)次生代谢产物的乙酸乙酯部分分离并鉴定了4个活性单体化合物.同时,应用MTT法对化合物1-4进行活性评价,研究结果表明化合物3、4具有较好的枯草芽孢杆菌和铜绿假单胞菌的抑菌活性,化合物1、2的抑菌活性一般.该结论为今后更多活性成分的制备分离奠定了基础,对新抗生素的筛选及新药的开发也具有重要的意义.
[1]KELECOM A.Secondary metabolites from marine microorganisms[J].Anaisda AcademiaBrasileirade Ciências,2002,74(1):151-170.
[2]BUGNI TS,IRELAND CM.Marine-derived fungi:a chemically and biologically diverse group of microorganisms[J].Natural Product Report,2004,21(1):143-163.
[3]ZHANG Y,MU J,GU XJ,et al.A marine sulfate-reducing bacterium producing multiple antibiotics:biological and chemical investigation [J].Marine Drugs,2009,7(3):341-354.
[4]林丽玉,高霞灵,吴萍茹,等.海洋药物资源的微生物的分离技术[J].中国海洋药物,1999,3:15-18.
[5]岳进,史奕,黄国宏,等.大气CO2浓度增高对麦田土壤硝化和反硝化细菌的影响[J].生态学杂志,2004,5:67-70.
[6]薛蕾,蒯琳萍.一株新反硝化菌的鉴定及在废水处理中的应用[J].环境科学与技术,2008,31(7):98-100.
[7]李平,张山,郑永良.反硝化真菌-细菌优化组合及脱氮能力研究[J].环境科学与技术,2006,29(3):9-10.
[8]FU BF,ZHANG Y,MU J,et al.Isolation,identification,and antimicrobial activity of a denitrifying bacterium from marine sediments[C].The 3rd International Conference on Bioinformatics and Biomedical Engineering,iCBBE,2009.
[9]李文林,毛士龙,易杨华,等.丰头皮海绵化学成分研究[J].中国海洋药物,2000,3:1-4.
[10]葛洁虹,高程海,王萍,等.南海二叉黑角珊瑚化学成分研究[J].中药材,2010,33(9):1403-1405.
[11]ZHANG W,LOU HX,LI GY,et al.A new triterpenoid from Entodon okamurae broth[J].Journal of Asian Natural Products Research,2003,5(3):189-195.
[12]李莉娅,邓志威,李军,等.中国南海海绵C inachyrella australiensis化学成分研究[J].北京大学学报(医学版),2004,36(1):12-17.
