老年冠心病患者血清白细胞介素6及高迁移率族蛋白B1水平的观察
2011-06-28史恒川刘俊恒朱建一
史恒川 刘俊恒 朱建一
冠心病(coronary heart disease,CHD)是由多种因素引起的疾病,炎症反应在冠状动脉粥样硬化(AS)的发病过程中起到极其重要的作用[1]。白细胞介素6(interlekin-6,IL-6)又称前炎症细胞因子,是炎症反应的一个中枢性调节因子;高迁移率族蛋白 B1(HMGB1)作为一种敏感性的、非特异性的炎性标志物,在炎症、肿瘤、动脉粥样硬化等病理过程中起着重要的作用[2]。本文通过观察CHD患者体内的 IL-6、HMGB1水平变化,来探讨它们之间的关系。
1 资料与方法
1.1 研究对象 入选对象92例,均为本院2009年8月至2010年11月确诊的CHD患者,符合世界卫生组织(WHO)制定的 CHD诊断标准[3],男 53例,女 39例,年龄65~88岁,平均(76.7±6.2)岁,包括稳定型心绞痛(SAP)34例,不稳定型心绞痛(UAP)28例,心肌梗死(AMI)30例。根据冠状动脉造影检查显示病变累及左前降支,左回旋支与右冠状动脉的支数,分为单支病变者(34例),双支病变者(30例),三支病变者(28例)。冠脉造影以冠状动脉狭窄≥50%作为诊断标准。同期选择来我院进行健康体检的老干部78例,年龄63~89岁,平均(75.4±7.6)岁。男45例,女33例。经体检各项标准均正常,多层螺旋CT(MSCT)冠状动脉造影成像未发现可辨认的斑块或狭窄,排除近期内有肝胆疾病、心脏疾病、急性损伤、感染、风湿活动、恶性肿瘤等疾病。2组人群的年龄比较,差异无统计学意义(P>0.05)。
1.2 研究方法 所有研究对象均抽取早晨空腹静脉血,标本采集后3 h内分离血清并于-20℃冰箱保存。IL-6、HMGB1均采用酶联免疫吸附试验(ELISA)法测定,HMGB1试剂盒为美国ADL公司产品,IL-6试剂盒为深圳晶美生物工程有限公司产品,严格按照试剂盒说明书进行操作,用GENESIS RPM 150全自动酶免疫系统检测,绘制标准曲线求出标本中IL-6、HMGB1的浓度。
2 结果
2.1 CHD各组临床资料之间的关系 比较CHD各组中CHD危险因素如性别、高血压、肥胖、糖尿病、吸烟、CHD家族史,入选对象在CHD危险因素方面差异无统计学意义(P>0.05)。见表1。
表1 CHD各分组CHD危险因素比较(n)
2.2 CHD组及各分组与对照组IL-6、HMGB1水平比较 与对照组相比,CHD组病人血清IL-6、HMGB1水平均显著升高,差异有统计学意义(P<0.01)。见表2。
2.3 CHD患者各组与对照组IL-6、HMGB1水平比较CHD各组中IL-6、HMGB1水平与对照组比较,差异有统计学意义(P<0.01),随着病情的进展,CHD各组中IL-6、HMGB1水平逐渐增高,且各组间两两比较差异有统计学意义(P<0.05)。见表2。
表2 CHD组与对照组IL-6、HMGB1水平比较(±s)
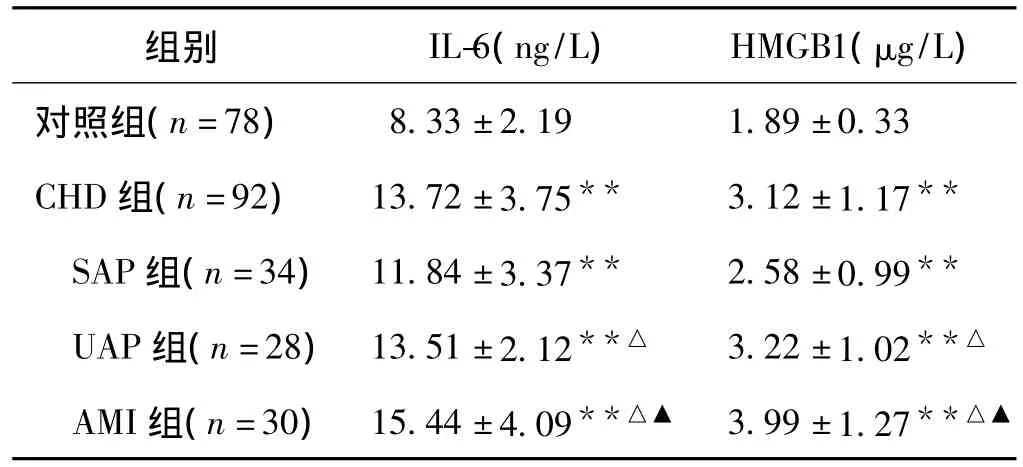
表2 CHD组与对照组IL-6、HMGB1水平比较(±s)
注:与对照组比较,**P<0.01;与SAP组比较,△P<0.05;与UAP组比较,▲P<0.05
组别 IL-6(ng/L) HMGB1(μg/L)对照组(n=78)8.33±2.19 1.89±0.33 CHD组(n=92) 13.72±3.75** 3.12±1.17**SAP组(n=34) 11.84±3.37** 2.58±0.99**UAP组(n=28) 13.51±2.12**△ 3.22±1.02**△AMI组(n=30) 15.44±4.09**△▲ 3.99±1.27**△▲
2.4 CHD组中冠脉病变程度与IL-6、HMGB1水平之间的关系 CHD组中,随着冠状动脉病变支数的增加,IL-6、HMGB1水平也逐渐增高,两两比较差异有统计学意义(P<0.05)。见表3。
3 讨论
CHD以AS为病理基础,炎症与AS的形成有密切的关系,炎症细胞与炎症因子在AS发生、发展过程中起着重要作用。IL-6主要是由单核细胞和巨噬细胞产生多生物活性的细胞因子,可诱导急性期炎性反应的产生,促进多种免疫细胞的分化及活化,在炎症反应过程中扮演重要角色,是CHD的一个重要危险因子,被认为是心血管事件危险最强有力的预测因子之一[4]。IL-6可以促进血管内皮细胞表达黏附分子和其他炎症递质,增强局部的炎症反应,趋化、活化中性粒细胞和单核细胞至炎症部位,同时活化的炎症细胞又大量表达IL-6,形成一个正反馈过程,从而加重损伤部位的炎症反应。
表3 CHD组冠脉病变程度与IL-6、HMGB1水平比较(±s)

表3 CHD组冠脉病变程度与IL-6、HMGB1水平比较(±s)
注:与单支病变组比较,**P<0.01;与双支病变组比较,△P<0.05
CHD 分组 IL-6(ng/L) HMGB1(μg/L)单支病变组(n=34)12.72±2.05 2.52±0.79双支病变组(n=30) 14.01±1.92** 3.04±0.93**三支病变组(n=28) 15.99±3.33**△ 3.79±1.21**△
本文中老年CHD患者IL-6水平明显高于对照组(P<0.01),提示IL-6可能参与了动脉粥样斑块的形成和发展的各个阶段,这与国内学者研究一致[5]。在CHD组各分组比较中,IL-6含量为AMI组>UAP组>SAP组,各组间水平有显著性差异(P<0.05)。推测血清IL-6水平升高可侵蚀斑块内的基质,从而导致不稳定斑块破裂,影响急性冠状动脉综合征的发生、发展。将IL-6水平与冠状动脉造影结果相比较,结果显示IL-6水平在单支、双支及三支病变间有统计学差异(P<0.05或P<0.01),且随着冠状动脉病变范围的增加,IL-6水平有逐渐增高的趋势,提示IL-6水平与老年CHD的冠脉病变程度有一定的相关性。研究显示[6-7],IL-6 与CHD的预后关系密切,其浓度升高者发生CHD、急性冠脉综合征的危险性增加,发病后病死率高。
研究表明,HMGB1作为一种晚期炎性因子,介导炎症的发展过程,在AS中发挥着重要的调节作用[8]。HMGBl是一种广泛存在于高等真核细胞中的染色体结合蛋白,位于大多数细胞的胞核和胞浆中,作为基因调控蛋白,参与DNA的重组、修复。在一般环境条件下,HMGBl的表达量维持在基础水平[9]。组织细胞的坏死、损伤,均可使HMGBl游离并释放至细胞外和血液中。正常血管壁内存在HMGB1的表达,分布比较均匀,内皮细胞损伤后其细胞内的HMGB1将释放到胞外。HMGB1可以诱导邻近内皮细胞表达分泌细胞黏附因子1(ICAM-1)、血管细胞黏附分子-1(VCAM-1)和白细胞介素(ILs)等炎症因子[10],这些炎症因子会趋化、活化单核和(或)巨噬细胞在炎症部位的浸润,进一步加重内皮细胞的损伤,同时活化的炎症细胞也会主动分泌HMGB1,进而产生更多的炎症因子,形成一个正反馈过程,加快AS的形成。HMGB1还可以诱导邻近内皮细胞高表达晚期糖基化终产物受体(RAGE),而研究显示RAGE参与了糖尿病、淀粉样变性和动脉硬化症等病理过程[11]。当血管内皮细胞损伤后,大量分泌的HGMB1可刺激血管平滑肌细胞(VSMC)的增殖,移行入内膜,导致内膜增厚,国外研究表明[12],HMGB1是机械损伤和(或)炎症引发的血管重构的强力刺激因子,在动脉粥样硬化和再狭窄的血管重构中发挥重要作用,参与动脉粥样硬化和血管成形后再狭窄等病理过程,病理研究显示HGMB1在人AS病变中表达增高,其中在脂肪纤维化病变中表达最高并且与巨噬细胞浸润明显相关[13]。本文中老年CHD患者HMGB1水平明显高于对照组(P<0.01),提示HMGB1可能是先天免疫细胞对内皮细胞损伤反应的关键分子,从而在AS早期引发剧烈的炎性反应。在CHD组各分组比较中,HMGB1水平随着CHD病情的加重明显增加,且随着冠状动脉病变累及支数的递增,炎症范围的扩大,HMGB1也呈上升趋势,差异有统计学意义(P<0.05)。提示HMGB1水平与冠状动脉病变的程度密切相关,其水平与AS形成和发展密切相关,同时也与CHD进展及不良事件有关。
本研究表明,与正常健康老年人相比,老年CHD患者 IL-6、HMGB1 水平明显升高,提示 IL-6、HMGB1都可以通过炎症反应促进AS的发生和发展,并与CHD的进展及不良事件呈正相关,可作为预测冠状动脉事件的指标。
[1]Hansson GK.Inflammtion,atherosclerosis,and coronary artery disease[J].N Engl J Med,2005,352(16):1685-1695.
[2]Yang H,Wang H,Czura CJ,et al.The cytokine activity of HMGB1[J].J Leukoc Biol,2005,78(1):1-8.
[3]叶任高,陆再英,陈灏珠,等.内科学[M].5版.北京:人民卫生出版社,2000:310-311.
[4]Gotsman I,Stabhoh A,Planer D,et al.Serum cytokine tumor necrosis factor-alpha and interleukin-6 associated with the severity of coronary artery disease:indicators of an active inflammatory burden?[J].Isr Med Assoc,2008,10(7):494-498.
[5]刘俊恒,倪黎刚,史恒川.老年冠心病患者血清脂联素及肺炎衣原体抗体等水平的观察[J].实用老年医学,2009,23(6):445-447.
[6]Lindmark E,Diderholm E,Wallentin L,et al.Relationship between interleukin 6 and mortality in patients with unstable coronary artery diease:effects of an early invasive or noninvasive strategy[J].JAMA,2001,286(17):2107-2113.
[7]韦叶生,唐任光,刘运广,等.冠心病患者白细胞介素-6血清水平检测的临床意义[J].陕西医学杂志,2005,8(8):907-909.
[8]Yang H,Wang H,Czura CJ,et al.The cytokine activity of HMGB1[J].J Leukoc Biol,2005,78(1):1-8.
[9]Lum HK,Lee KL.The human HMGB1 promoter is modulated by a silencer and an enhancer-containing intron[J].Biochim Biophys Acta,2001,1520(1):79-84.
[10]Fiuza C,Bustin M,Talwar S.Inflammation-promoting activity of HMGB1 on human microvascular endothelial cells[J].Blood,2003,101(7):2652-2660.
[11]Erlandsson Harris H,Andersson U.Mini-review:the nuclear protein HMGB1 as a proinflammatory mediator[J].Eur J Immunol,2004,34(6):1503-1512.
[12]Degryse B,Bonaldi T,Scaffidi P,et al.The high mobility group(HMG)boxes of the nuclear protein HMGl induce chemotaxis and eytoskeleton reorganization in rat smooth muscle cells[J].J Cell Biol,2001,152(6):1197-1206.
[13]Kalinina N,Agrotis A,Antropova Y,et al.Increased expression of the DNA-binding cytokine HMGB1 in human atherosclerotic lesions:role of activated macrophages and cytokines[J].Arterioscler Thromb Vasc Biol,2004,24(12):2320-2325.
