黄葵素对结核分枝杆菌的抑杀作用研究
2011-06-20伍参荣申可佳贾本真李芳荣
伍参荣 ,蔡 锐 ,李 珊 ,申可佳 ,贾本真 ,李芳荣
(1.湖南中医药大学病原免疫学教研室,湖南 长沙 410208;2.湖南中医药研究院,湖南 长沙 410006)
结核病是一种慢性传染病,近20年来,由于艾滋病的传播以及耐药等因素的影响,全球结核发病率呈上升势。目前认为,耐药性结核分枝杆菌广泛传播是结核病流行的主要原因[1],临床上已发现结核分枝杆菌菌株对多种一线抗结核药物耐药[2],因此,研制新型抗结核药物有其必要性,从中药中筛选抗结核新药是其有效途径之一。黄葵素是从天然药物中筛选出的新型化合物—小檗碱离子对化合物 (专利号:200510136655),研究中发现该药能抗多种病原体,特别是抗胞内菌感染。现将其抗结核杆菌研究结果报告如下。
1 材料与方法
1.1 材料
1.1.1 试验菌株 H37RV标准菌 (ATCC:27294)本室保存菌株; 多药耐药菌株(INH/R,SM/R,RFP/R,EMB/R,KA/R,IRO/R)编号 005101 由湖南省结核病院检验科提供。从培养基中称取0.1 mg菌落,加入0.5 mL生理盐水与苏通培养液(体积比为1∶3)的混合稀释液分别接种于改良罗氏培养基[3]斜面上。置37℃培养。18 d后分别取改良罗氏培养基上生长良好的菌落于研磨器中,加少量含0.05%Tween80的生理盐水研磨均匀,稀释成白色均匀混浊的菌液。显微镜下计数,调整细菌浓度为3×107个/mL(供试验用)。
1.1.2 试验药物 黄葵素干粉由湖南中医药研究院药物研究所提供,批号:20070212,用含2%乙醇生理盐水稀释成1 g/mL,4℃保存备用。利福平胶囊(0.3 g/粒,浙江医药股份有限公司新昌制药厂,批号:20061209001),实验时先用少许乙醇溶解,再用无菌蒸馏水稀释至5 mg/mL。
1.1.3 动物 KM小鼠70只,SPF级体质量 (18.0±2.0)g雌雄各半,购自湖南莱克景达实验动物有限公司,许可证号:SCXK2009-0004。 饲养于(21±2)℃、湿度(55±15)%、可以方便获取食物和水的负压感染动物房内。
1.2 方法
1.2.1 体外抗菌实验[3-4]改良罗氏培养基分别制成含药和不含药平皿,即:不含药的空白对照组;阳性对照组 (利福平5 mg/mL);含不同浓度黄葵素组(100,50,25, 12.5,6.2,3.2 mg/mL),各组培养基每平皿15 mL。取上述菌悬液0.1 mL接种于各含药培养基表面,每个浓度设5个平皿,置37℃培养,每5 d观察1次,40 d后以模型对照组结核分枝杆菌长满培基表面为终止培养标准,计数各皿菌落数。
1.2.2 药物抑制培养后结核分枝杆菌恢复培养试验 经含药培养基培养40 d后,对无肉眼可见菌落生长的培养基表面物,进行结核分枝杆菌恢复培养。用生理盐水洗下无菌落生长的培养基表面颗粒状物,离心沉淀后接种于改良罗氏培基平皿,37℃培养,每5 d观察1次,40 d后终止培养,计数菌落数,标准菌株H37RV为对照,每浓度做5皿。进一步评价药物对结核分枝杆菌的抑制作用。
1.2.3 药物小鼠体内抗菌实验[5-6]小鼠按体质量分层后随机分为7组,每组10只,分别为正常组、模型组、黄葵素组、阳性药对照组。除正常对照组外,其他组小鼠造模;每只小鼠尾部静脉注射0.1 mL经0.05%Tween80生理盐水稀释的H37Rv菌液,含活菌数约 3×105个。 (1)正常小鼠对照组(NG):每只小鼠尾部静脉注射0.1 mL 0.05%Tween80的无菌生理盐水。从第2天灌胃生理盐水1次/d,每周灌胃5次,0.2 mL/只,持续 6周。(2)模型组:包括标准株
H37RV(MH37RG)和多耐药株模型(MDNG)对照组:感染1 d后,每只小鼠生理盐水每天灌胃1次,每周灌胃 5 次,0.2 mL/只/次,持续 6 周。 (3)阳性药对照(利福平组RFG)即H37RV(RFH37RG)和多耐药株(RFDNG)治疗组:感染1 d后,每只小鼠利福平150 mg/kg每天灌胃 1次, 每周灌胃 5次,0.2 mL/只/次,持续6周。④黄葵素治疗组(黄葵素组HKSG)即标准株H37Rv(HKSH37RG)和多耐药株(HKUSDNG)治疗组:感染1 d后,每只小鼠黄葵素75 mg/kg灌胃,灌胃前用0.5%黄耆胶制成混悬液,每天灌胃1次,每周灌胃 5次,0.2 mL/只/次,持续 6周。
1.2.4 药物对组织载菌量的影响 采用二氧化碳窒息法处死小鼠,75%的乙醇溶液消毒小鼠体表5 min,于生物安全柜内解剖小鼠,取脾脏和肺脏,分别置于灭菌研磨器中,每个脏器加2.0 mL无菌生理盐水匀浆,并进行系列稀释,每个脏器稀释5个浓度,每个浓度做3个试管,每管取0.1 mL涂布于改良罗氏培基中,37℃培养,观察菌落生长情况,40 d后计数菌落。
1.2.5 药物对感染组织病理学的影响 每组随机取5只小鼠无菌分离出小鼠脾脏和肺脏,置入10%的甲醛溶液固定,苏木精-伊红(HE)和抗酸染色切片,观察感染组织病理变化。
1.3 统计学分析
2 结果与分析
2.1 黄葵素对结核杆菌的体外抑杀作用
表1可以看出黄葵素对H37RV标准菌抑杀作用强于多耐药株,黄葵素100 mg/mL时对H37RV标准菌抑杀作用和利福平比较无统计学意义 (P>0.05);同样黄葵素在100 mg/mL时显示出对临床多耐药株的较好的抑杀作用,与利福平组比较,各时间点差别均显示出统计学意义(P<0.05)。
表1 黄葵素试管中对结核杆菌生长的抑制作用 (n=5,±s)

表1 黄葵素试管中对结核杆菌生长的抑制作用 (n=5,±s)
注:LSD分析P<0.05,示Q检验与模型组比较*P<0.05;与利福平组比较#P<0.05。
组 别HKSG1 HKSG2 HKSG3 HKSG4 HKSG5 HKSG6 RFG培基对照模型对照药物浓度mg/mL 100 50 25 12.5 6.2 3.2 5不同观察时间H37RV落生长数(个)10~25 d 30 d 35 d 40 d——— 2.00±0.01* 3.30±1.00* 4.00±1.00*— 6.22±1.21* 7.05±1.02* 9.16±1.87*— 7.65±2.31* 7.65±2.31* 10.00±2.12*— 10.00±1.20* 13.50±2.12*15.00±1.34*— 13.89±3.12* 22.52±3.46*42.00±3.60———— 20.00±2.12 39.00±3.41 41.96±3.33不同观察时间多耐药株菌落生长数(个)10~20 d 25 d 30 d 35 d 40 d— — 2.00±0.02*# 2.00±0.02*# 5.80±0.02*#— 2.00±0.018# 8.01±1.02*# 15.12±2.15*# 31.00±3.00*#— 4.00±1.00*# 12.21±2..038*# 21.33±2.14*# 35.09±3.14*#— 8.00±1.13*# 11.00±2.538*# 22.00±2.63*# 36.00±3.76*#— 8.21±1.26*# 12.00±2.25*# 22.00±2.34*# 36.63±3.15*#— 22.00±2.96# 37.76±3.98*# 39.49±3.46*# 39.49±3.46*#— 19.880±2.36 40.37±2.67 43.00±3.134 43.00±3.13— — — — —— 2 0.00±1.36 39.87±3.10 42.57±3.19 42.57±3.19
药物试管中抑制培养后的结核杆菌恢复培养结果显示:黄葵素100 mg/mL恢复培养30 d后肉眼观察无可见菌落生长,40 d时肉眼可见菌落数为4.02±1.12,而空白管为51.43±3.10,显示出药物对H37RV标准菌较好的抑杀作用。
2.2 黄葵素小鼠体内抑杀结核杆菌的作用
表2可以看出黄葵素与利福平治疗组与模型组比较均能显示出较好的抗菌作用(P<0.05)。黄葵素对H37RV标准菌感染小鼠抑杀作用与RFG组比较无差异(P>0.05),对多耐药株感染小鼠体内的抑杀作用强于RFG,RFG多耐药株组小鼠肺组织与脾组织载菌量高于HKSG,有统计学意义(P<0.05),提示黄葵素对结核杆菌多耐药株有较好的抑杀作用。
2.3 药物对结核杆菌感染小鼠组织病理学的影响
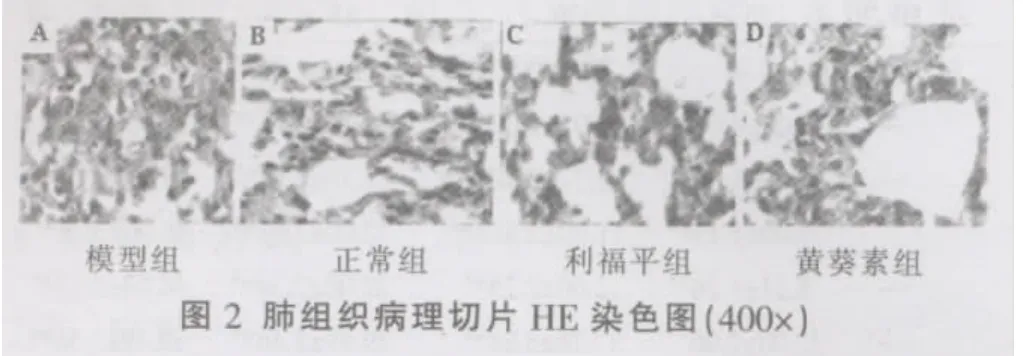
(1)药物对标准株H37Rv感染小鼠肺组织病理学影响 各组肺组织病理切片图显示 (图1~3),治疗6周后模型组小鼠正常肺组织结构消失,充血实变,肺泡腔内充满淋巴细胞、巨噬细胞,肺泡间隔不存在,肺部病变严重、广泛,增生性改变不明显;利福平治疗组无明显的病理改变;黄葵素治疗组肺组织结构无明显的病理变化。高倍镜下观察:模型组小鼠肺组织内可见圆形的结节状病灶,灶内可见较多的上皮样细胞、淋巴细胞及纤维组织,和多核巨细胞。黄葵素组与利福平组小鼠肺组织高倍镜下与模型组比较淋巴细胞以及多核巨细胞明显减少,未见结节状病灶。模型组结核结节内可见成簇排列的抗酸杆菌;黄葵素治疗组小鼠肺组织抗酸染色菌密度明显低于模型组,有效减少了肺组织病变部位定植的结核杆菌数量。

表2 黄葵素对结核杆菌感染小鼠肺和脾组织载菌量的影响 (n=10)

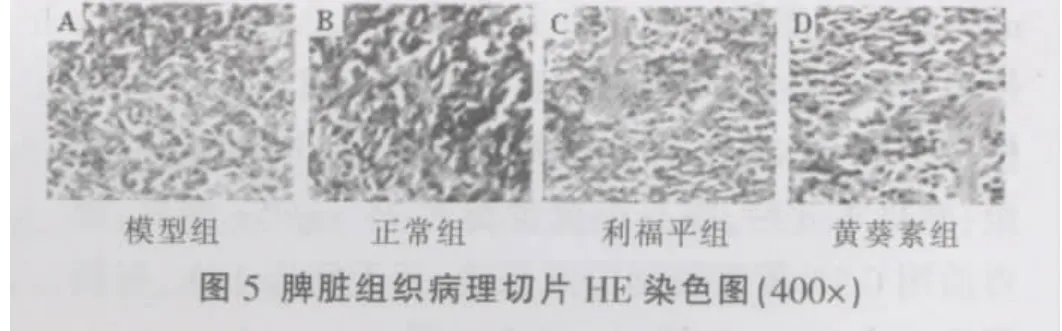
(2)药物对H37Rv感染小鼠脾组织病理学影响模型组小鼠感染H37Rv后脾淋巴小结增大,脾窦及红髓的外套丛充血,淋巴细胞增生,淋巴小结内生发中心增生;黄葵素、利福平组小鼠脾脏淋巴小结轻度增大,病变程度较模型组小鼠明显减轻;高倍镜下模型组小鼠脾组织淋巴小结内淋巴细胞、巨噬细胞、中性粒细胞浸润,可见渗出物;黄葵素与利福平组治疗组小鼠脾组织淋巴小结内淋巴细胞、巨噬细胞、中性粒细胞浸润较模型组小鼠明显减少,无炎性渗出;模型组脾组织内结核杆菌数量明显多于黄葵素组、利福平治疗组(图 4~6)。


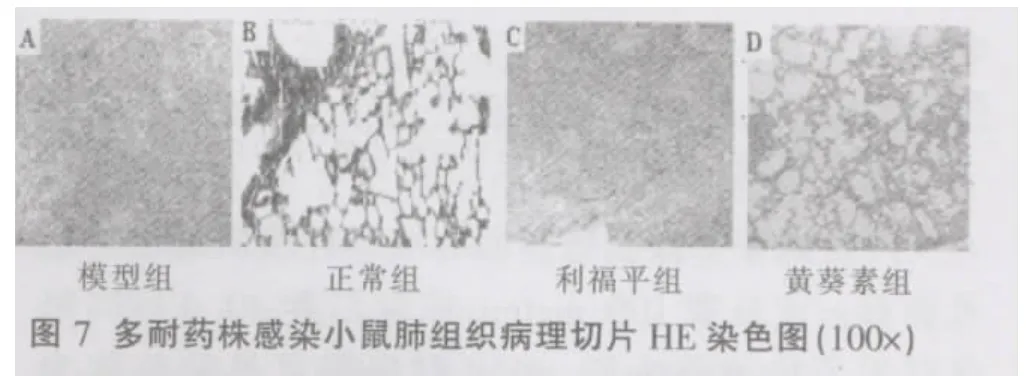
(3)药物对多耐菌株实验小鼠肺组织病理学影响多耐药株模型组、利福平组小鼠肺组织正常肺泡结构消失,有弥漫性病变,多个结核结节融合,呈现浸润型肺结核表现,肺泡腔内可见浆液、单核细胞、淋巴细胞和中性粒细胞,有肺水肿。高倍镜下肺组织结核结节内干酪样坏死,结节的边缘淋巴细胞和成纤维细胞明显增多;肺结核结节灶内有紫红色短杆状微弯曲的杆菌密布。黄葵素治疗组未见明显的结节融合与干酪样坏死,病变部位局限,肺间隔炎症较轻,肺间质及血管周围炎细胞浸润少,病变部位抗酸杆菌散在分布,含菌量较模型组、利福平组小鼠减少(图7~9)。


(4)药物对多耐菌株实验小鼠脾组织病理学影响 图10~13可见模型组、RFG小鼠脾组织内脾索及脾窦可见大量的中性粒细胞、单核细胞及网状内皮细胞;脾索及脾窦破坏严重,脾小体萎缩,有多个结核结节,和结核杆菌。与模型组比较HKSG小鼠脾组织充血,病变较轻,淋巴小结轻度增大,病变部位的细菌量也较少。



3 讨论
结核病是一种的慢性传染病,又称为痨病和“白色瘟疫”。自20世纪90年代以来,结核病在全球“死灰复燃”,每年有近900万新发病例,150多万人死亡[7]2-5。造成严重的公共卫生问题和重大的经济社会问题。结核病呈上升趋势根本的原因是结核分支杆菌耐多药性的产生,使原有的抗结核病治疗方案(即一线抗痨药,二线抗痨药治疗方案)受到了很大的冲击,使原有的抗结核病的治疗规程失去了应有的作用[7]135,[8]。因此,研制新型抗结核药物有其必要性。
黄葵素为小檗碱离子对化合物,本次体外抗菌作用研究结果显示:黄葵素与利福平组比较,对H37RV标准菌有抑杀作用,两组差别无统计学意义(P>0.05);但对多耐药株的抑杀作用均强于利福平组,各时间点差别均显示出统计学意义(P<0.05)。
通过尾静脉注射结核杆菌建立小鼠结核感染模型[9-10]观察感染小鼠组织的病理变化,研究表明黄葵素能明显减轻小鼠肺、脾组织的结核病理损伤,以及减少细菌在组织内的定植。对结核分枝杆菌标准株感染鼠脏器的保护与利福平作用相当 (P>0.05);更重要的是黄葵素能有效的杀灭定植在小鼠体内的多耐药结核菌,减轻耐药细菌对脏器的损害程度。
器官载菌量是动物实验中观察抗结核感染疗效的重要指标[11],本次研究结果表明:药物治疗60 d后,黄葵素与利福平治疗组均能显示出较好的抗菌作用,两组间差别无统计学意义(P>0.05);对小鼠体内感染的多耐药株菌抑杀作用黄葵素强于利福平,多耐药株利福平治疗组小鼠肺组织载菌量比黄葵素组高2.01(P<0.05),脾脏组织载菌量比黄葵素组高1.19(P<0.05),提示黄葵素对感染机体的多耐药结核杆菌有较好的抑杀作用。
综上所述,从天然药物中筛选出的离子对化合物黄葵素在体内外均显示出较好的抗结核杆菌作用,其机理值得深入探讨。
[1]刘剑君,姜世闻,成诗明.中国结核病控制现状分析及对策[J].中国防痨杂志,2003,25(3):129-131.
[2]Shah NS,W right A,Bai GH,et a1.Worldwide emergence of extensively drug-resistant tuberculosis[J].Emerg Infect Dis,2007,13(3):380-387.
[3]俆叔云.药理实验方法学[M].北京:人民卫生出版社,2000:1 712-1 728.
[4]欧阳建军,白于乾,伍参荣,月华胶囊对耐多药结核分枝杆菌效力的体外研究[J].湖南中医药大学学报,2003,23(5);272-274.
[5]张家敏,张小贤,蒋锦琴.脱乙酰基利福喷丁抗结核杆菌生长活性的研究[J].现代中西医结合杂志,2004,13(19):2 537-2 538.
[6]陆 宇,王 彬,赵伟杰,等.氯法齐明与其他抗结核药物联用对结核分枝杆菌的作用研究[J].结核病与胸部肿瘤,2010,(2):98-102.
[7]Behera D.Global Tuberculosis Control:Surveillance,Planning,Financing[R].Geneva:WHO,2007.
[8]Burgos M,DeRiemer K,Small PM,et a1.Effect of drug resistance on the generation of secondary cases of tuberculosis[J].Infect Dis,2003,188(12):1 878-1 884.
[9]Shah NS,Wright A,Bai GH,et a1.Worldwide emergence of extensively drug-resistanttuberculosis [J].Emerg InfectDis,2007,13(3):380-387.
[10]李定越,卢润生,蒋绍双,等.结核病实验动物模型[J].四川医学,2003,24(7):761-762.
[11]Shimada M,Andoh A,Hata K,et al.IL-6 secretion by human pancreatic periacinar myofibroblasts in response to inflammatory mediators[J].J Immunol,2002,168(2):861-868.
