颅脑损伤患者外周血髓过氧化物酶的变化及临床意义
2011-06-15邹国英蒋洪敏
邹国英,蒋洪敏
(1.湖南省脑科医院检验科,长沙410007;2.中南大学湘雅二医院检验科,长沙410007)
目前研究认为颅脑损伤后同样存在炎症反应,在损伤早期抑制炎症反应,可能起到神经保护和改善恢复结果的作用,适量控制炎症反应的强度、范围及持续时间,是颅脑损伤后炎症反应期的一种重要治疗手段。其中以中性粒细胞的浸润为主要因素,而髓过氧化物酶(M PO)是中性粒细胞活化的标志物[1]。本文研究观察了颅脑损伤后MPO的动态变化,探讨其与颅脑损伤程度的关系及临床意义。
1 资料与方法
1.1 一般资料 2007年10月至2008年5月本院创伤脑外科的住院患者90例,男 62例,女 28例,年龄(38.5±16.6)岁;入选标准:患者经CT扫描发现原发和(或)继发颅脑损伤,排除严重合并伤者,所有患者均符合颅脑损伤诊断标准,患者均为发病12 h内住院,测定血常规、血糖、糖化血红蛋白、血脂,检查肝、肾、心功能等,排除糖尿病、高脂血症、高血压及肝、肾、心血管疾病。按GCS评分将患者分为轻度损伤(13~15分)29例,中度损伤(9~12分)29例,重度损伤(3~8分)32例。
1.2 方法
1.2.1 标本采集 受检者于伤后3 h内采集第1次标本,取肘静脉血 3 mL,其后 6、12、24、48、72 h 各采集 1 次,每次采集两管,一管为无抗凝剂标本,3 000 r/min离心10 min,取血清-80℃保存,用于 MPO检测,一管为EDTA-K2抗凝标本,用于血细胞计数及分类,立即检测。
1.2.2 血常规检查 使用德国西门子拜耳ADVIA 2120全自动血细胞分析仪及其配套试剂。
1.2.3 MPO测定 使用南京建成生物工程研究所提供的试剂盒,用日本岛津UV-2501PC紫外分光光度计比色测定。
1.2.4 血糖代谢、血脂及肝、肾、心功能检查 血清葡萄糖、血液糖化血红蛋白、血清高密度脂蛋白(HDL-C)、载脂蛋白A-Ⅰ(apoA-Ⅰ)、载脂蛋白B(apoB)、总胆红素(TBIL)、直接胆红素(DBIL)、总蛋白(TP)、清蛋白(ALB)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、肌酸激酶(CK)、肌酸激酶同工酶(CK-MB)、总胆汁酸(TBA)、肌肝(CREA)、β2-微球蛋白(β2-MG)检测使用宁波美康生物科技公司试剂盒,总胆固醇(TC)、三酰甘油(TG)、尿素氮(BUN)、尿酸(UA)、乳酸脱氢酶(LDH)检测使用上海科华试剂盒,用德国西门子拜耳ADVIA 1650全自动生化分析仪检测。
1.3 统计学处理 使用SPSS16.0统计软件。各组之间比较方差齐用方差分析的 LSD检验,方差不齐用方差分析的Games-Howell检验。相关性分析采用Spearman相关分析。回归分析采用直线回归分析。P<0.05为差异有统计学意义。
2 结 果
2.1 颅脑损伤患者中性粒细胞的浸润改变
2.1.1 血清MPO活性比较 不同损伤程度的颅脑损伤患者3 h血清MPO活性受损伤程度的影响(P<0.01),随损伤程度加重而活性增加(P<0.05),见表 1。
2.1.2 血液白细胞计数及分类比较 不同损伤程度的颅脑损伤患者3 h血液WBC、NEUT#、NEUT%均受损伤程度的影响(P<0.01)。各损伤组之间除轻度与重度损伤组 WBC、NEUT#有差别外(P<0.01),其余各组之间差异无统计学意义(P>0.05),见表1。
表1 颅脑损伤患者中性粒细胞的浸润改变(±s)
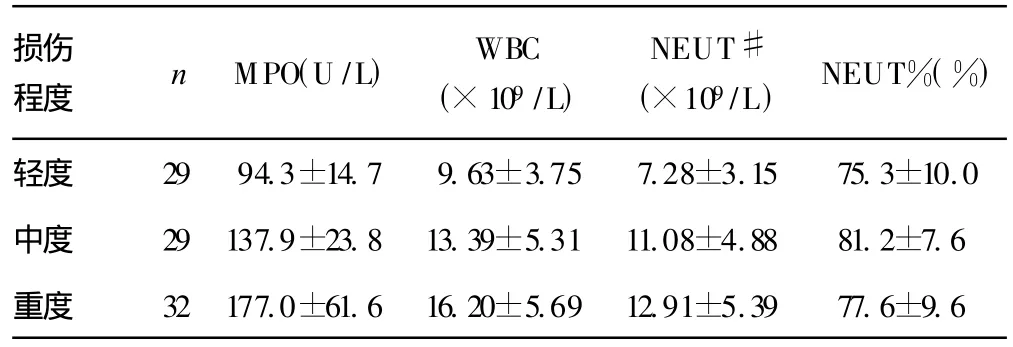
表1 颅脑损伤患者中性粒细胞的浸润改变(±s)
损伤程度 n MPO(U/L) WBC(×109/L)NEUT#(×109/L) NEUT%(%)轻度 29 94.3±14.7 9.63±3.75 7.28±3.15 75.3±10.0中度 29 137.9±23.8 13.39±5.31 11.08±4.88 81.2±7.6重度 32 177.0±61.6 16.20±5.69 12.91±5.39 77.6±9.6
2.2 不同程度颅脑损伤患者外周血M PO活性动态变化 不同损伤程度血清MPO活性均受病情进程的影响(P<0.01),随病情发展伤后3 h血清MPO活性开始增加,于12 h达高峰,以后逐步下降,72 h后降至受伤时水平,只有轻度患者可降至正常水平,见图1。
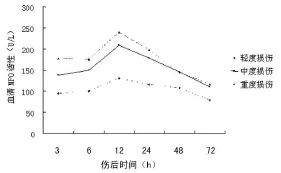
图1 不同程度颅脑损伤患者外周血MPO活性的动态变化
2.3 颅脑损伤患者外周血M PO活性与 WBC、NEUT#、NEUT%的相关性 颅脑损伤患者外周血MPO活性只与NEUT%存在正相关性(P=0.011)。用直线回归分析,颅脑损伤患者外周血MPO活性与NEUT%有显著相关意义(P=0.047),回归方程为Y=0.937X+71.571。
3 讨 论
MPO是一种相对分子质量为140×103的糖基化四聚体血红素蛋白,具有多态性。MPO由活化的中性粒细胞、单核细胞及特定组织内[如动脉粥样硬化(As)斑块内]巨噬细胞的亚群分泌,血液中95%的MPO是由活化的中性粒细胞脱颗粒后以胞吐方式释放到管腔的,占所有细胞蛋白质总量的4%,是中性粒细胞活化的标志物。正常情况下,MPO以氯和中性粒细胞呼吸爆发产生的过氧化氢为底物,催化产生主要产物次氯酸和多种自由基,在机体天然免疫应答中发挥重要作用[2]。当机体处于炎症、氧化应激状态时,不能有效清除自由基和氧化剂,引起多种病理过程和组织损伤。
炎症反应已成为TBI继发性损伤的重要原因,尤其是在最初的48 h以内,炎症反应最为活跃[3]。颅脑损伤时首先激活单核巨噬细胞系统,分泌大量的细胞因子如 TNF-α、IL-1β,诱导其他炎症因子如白细胞介素-6(IL-6)、白细胞介素-1受体1(IL-1R1)、环氧酶-2(COX-2)、诱导型一氧化氮合酶(iNOS)的释放[4],启动中性粒细胞(PM N)的运动、吞噬,在多种细胞因子作用下,可溶性细胞黏附分子-1(sICAM-1)、可溶性 L-选择素和可溶性E-选择素(sL-和sE-Selectins)表达上调[5],介导白细胞在内皮细胞表面最初的滞留和滚动,并穿过血管壁进入脑实质。炎症过程中内皮和白细胞黏附分子上调,促使白细胞释放[6]。同时有研究发现脑损伤大鼠中,补体活性标志物补体因子C9和MPO阳性细胞增加,表明补体激活也参与炎症反应[7]。多种途径同时并存并相互作用参与炎症反应,导致MPO活性增加。
本研究发现颅脑损伤患者不仅WBC、NEUT#、NEUT%增高,而且血清MPO活性增加,表明颅脑损伤后患者有中性粒细胞的浸润改变,Ambrosini等[8]研究也指出急性颅脑损伤后MPO活性呈高水平状态。高表达的MPO能活化与细胞凋亡有关的因子Akt及Caspase-3,促进神经细胞的凋亡,而后二者又反过来对MPO活化有抗凋亡作用,加之MPO能延长中性粒细胞的凋亡,形成恶性循环,加重组织的损伤[9]。Breckwoldt等[10]用酶活性核磁共振成像发现MPO存在于脑损伤部位,并且与缺血梗死面积呈正相关。本研究也表明M PO与颅脑损伤程度有关,损伤程度越严重MPO活性就越高。不同损伤程度血清MPO活性还受病情进程的影响,随病情发展伤后3 h血清MPO活性开始增加,于12 h达高峰,以后逐步下降,72 h后降至受伤时水平,只有轻度患者可降至正常水平。有研究表明,在鼠颅脑损伤后6 h MPO开始升高,24~48 h达高峰,在海马回和周围皮质72 h、而颞回120 h仍可检测到MPO活性[11],这与本研究有一致性。外周血MPO活性仅与NEUT%存在正相关性,且在病情进程过程中作者发现其他三者不受影响,表明血清MPO活性能敏感地表现出随病情发展的变化。Furuichi等[12]报道证实,白细胞浸润程度与脑缺血的预后密切相关,轻度白细胞浸润者脑梗死体积小、神经功能恢复好,而重度白细胞浸润者脑梗死体积大、预后差,故 TBI患者MPO活性的测定对病情的评估、继发性脑损伤及治疗有指导作用。
Clausen等[13]研究证实活性氧物质 ROS抑制剂可降低MPO活性,避免脑微脉管系统损伤。脉管系统中,白细胞表达的CD18在中性粒细胞-内皮细胞交互作用中非常重要,CD18缺乏的老鼠颅脑损伤模型中,伴随着MPO活性下降,减轻了脑水肿,降低了病死率[14]。Jiang等[15]在鼠缺血模型中运用中性粒细胞阻止剂,防止中性粒细胞黏附,发现对脑缺血损伤有保护作用。由此表明通过测定血清MPO活性,可以了解病情变化,通过“保护神经”的抗感染治疗制止中性粒细胞的浸润[16],使MPO活性下降,改善脑血流、保护血脑屏障、减轻脑水肿、降低颅内压和自由基产生,达到有效治疗颅脑损伤的目的。
[1] Lau DL,M ollnau H,Eiserich JP,et al.Myeloperoxidase mediates neutrophil activation by association with CD11b/CD18 integrins[J].J Clin Invest,2005,10(2):431-436.
[2] Harrison JE,Schultz J.Studies on the chlorinating activity of myeloperoxidase[J].J Biol Chem,1976,25(1):1371-1374.
[3] Harting M T,Jimenez F,Adams SD,et al.Acute,regional inflammatory response after traumatic brain injury:Implications for cellular therapy[J].Surgery,2008,144(5):803-813.
[4] Jin W,Wang H,Yan W,et al.Disruption of Nrf2 enhances upregulation of nuclear factor-kappaB activity,proinflammatory cytokines,and intercellularadhesion molecule-1 in the brain after traumatic brain injury[J].Mediators Inflamm,2008,2008:725174.
[5] Briassoulis G,Papassotiriou I,Mavrikiou M,et al.Longitudinal course and clinical significance of TGF-beta1,sL-and sE-Selectins and sICAM-1 levels during severe acute stress in children[J].Clin Biochem,2007,40(5/6):299-304.
[6] Wong D,Prameya R,Dorovini-Zis K.Adhesion and migration of polymorphonuclear leukocytes across human brain microvessel endothelial cells are differentially regulated by endothelial cell adhesion molecules and modulate monolayer permeability[J].J Neuroimmunol,2007,184(1/2):136-148.
[7] Gong Y,Xi G,Wan S,et al.Effects of aging on complement activation and neutrophil infiltration after intracerebral hemorrhage[J].Acta Neurochir(Suppl),2008,105:67-70.
[8] Ambrosini A,Louin G,Croci N,et al.Characterization of a rat model to study acute neuroinflammation on histopathological,biochemical and functional outcomes[J].J Neurosci Methods,2005,144(2):183-191.
[9] Kebir DE,Jozsef L,Pan W,et al.Myeloperoxidase delays neutrophil apoptosis through CD11b/CD18 integrins and prolongs inflammation[J].Circ Res,2008,103(4):352-359.
[10]Breckwoldt MO,Chen JW,Stangenberg L,et al.T racking the inflammatory response in stroke in vivo by sensing the enzyme myeloperoxidase[J].Proc Natl Acad Sci USA,2008,105(47):18584-18589.
[11]Royo NC,Wahl F,Stutzmann JM.Kinetics of polymorphonuclear neutrophil infiltration after a traumatic brain injury in rat[J].Neuroreport,1999,10(6):1363-1367.
[12]Furuichi Y,Noto T,Li JY,et al.M ultiple modes of action of tacrolimus(FK 506)for neuroportective action on ischemic damage after transient focal cerebral ischemia in rats[J].Brain Res,2004,1014(1/2):120-130.
[13]Clausen F,Lorant T,Lewén A,et al.T lymphocyte trafficking:a novel target for neuroprotection in traumatic brain injury[J].J Neurotrauma,2007,24(8):1295-1307.
[14]Titova E,Ostrowski RP,Kevil CG,et al.Reduced brain injury in CD18-deficient mice after experimental intracerebral hemorrhage[J].J Neurosci Res,2008,86(14):3240-3245.
[15]Jiang N,Chopp M,Chahwala S.Neutrophil inhibitory factor treatment of focal cerebral ischemia in the rat[J].Brain Res,1998,788(1/2):25-34.
[16]Fleming JC,Norenberg MD,Ramsay DA,et al.The cellular inflammatory response in human spinal cords after injury[J].Brain,2006,129(Pt 12):3249-3269.
