通腑泻热活血方对脓毒症热毒炽盛证患者炎性因子的影响
2011-06-13李淑芳熊旭东
王 倩 李淑芳 熊旭东
上海中医药大学附属曙光医院(上海200021)
脓毒症是指由感染引起的一种全身炎症反应综合征[1],包括重症脓毒症和脓毒性休克,死亡率较高。研究显示,脓毒症的高死亡率与疾病过程中的炎症反应有关[2],炎症反应也是影响其预后的重要因素。因此,在脓毒症治疗中积极控制炎症反应、防止多脏器功能障碍发生具有重要意义。笔者应用通腑泻热活血方治疗脓毒症热毒炽盛证,取得较好疗效。现报告如下。
1 资料与方法
1.1 临床资料 选取2008年6月-2010年3月上海中医药大学附属曙光医院感染科、ICU入院患者60例,诊断符合《中医病证诊断疗效标准》[3]及《中医诊断学》[4]中相关标准。感染部位为肺部;均知情同意,愿意接受试验。排除严重脓毒症及合并MODS、休克者;年龄<18岁者;妊娠及哺乳期妇女;6个月内接受过化疗者;目前或前3个月内接受糖皮质激素或其他免疫抑制剂、免疫调节剂治疗者;有免疫系统疾病者;HIV阳性者;终末期肝或肾功能衰竭者;使用呼吸机辅助通气或血流动力学不稳定者。随机分为两组。其中治疗组30例,男性 18例,女性 12例;平均年龄(78.02±7.28)岁。对照组30例,男性19例,女性11例;平均年龄(77.97±10.05)岁。两组资料差异无统计学意义(P>0.05),具有可比性。
1.2 治疗方法 对照组选用第2、3代头孢菌素(如头孢呋辛、头孢他定、头孢曲松、头孢噻肟等)或根据病原学结果再予调整。同时积极处理原发病、对症治疗、维持水/电解质及酸碱平衡、营养支持及保持呼吸道的通畅等。治疗组加用通腑泻热活血方:生大黄粉3g(后下),山栀 10g,玄参 15g,黄芩 15g,赤芍 15g,当归 15g。每剂浓煎200mL。每日1剂,早晚分服。两组均以10d为1疗程。
1.3 观察项目 比较两组治疗前后中医证候评分[3,5]:将出现的主症分无、轻、中、重4级,记分权重;兼症分有、无2级,记分权重。舌象、脉象均不记分。记录频度为:治疗前、治疗5d、治疗10d。同时记录三大常规、肝肾功能、C反应蛋白(CRP)、胸片;用ELISA法检测炎症介质(TNF-α、IL-6、IL-1β)。
1.4 疗效标准 参照 《中医病证诊断疗效标准》[4]及《中药新药临床研究指导原则》[6]中风温肺热病证候评分标准拟定。根据各项观察指标的评分标准,计算出疗效指数:疗效指数=(治疗前症状积分-治疗后症状积分)/治疗前症状积分×100%。痊愈:证候消失或基本消失,疗效指数≥95%。显效:证候明显改善,70%≤疗效指数<95%。有效:证候均有好转,30%≤疗效指数<70%。无效:证候无明显改善,甚或加重,疗效指数<30%。
1.5 统计学处理 应用SPSS 11.5统计软件。计量资料以(±s)表示,采用 χ2检验、方差分析及 Kruskal-Wallis秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组疗效比较 治疗组30例痊愈10例,显效12例,有效5例,无效3例,总有效率90.00%。对照组30例,痊愈9例,显效10例,有效6例,无效5例,总有效率83.33%。两组总有效率无显著差异(P>0.05)。
2.2 两组咳嗽咯痰、发热积分比较 见表1。治疗组治疗5d后咳嗽咯痰、发热积分明显改善(P<0.05),对照组无明显改善(P>0.05),治疗组优于对照组(P<0.05);两组治疗10d后咳嗽咯痰、发热积分均明显改善(P<0.05),组间无明显差异(P>0.05)。
表1 两组咳嗽咯痰、发热积分比较 (±s)
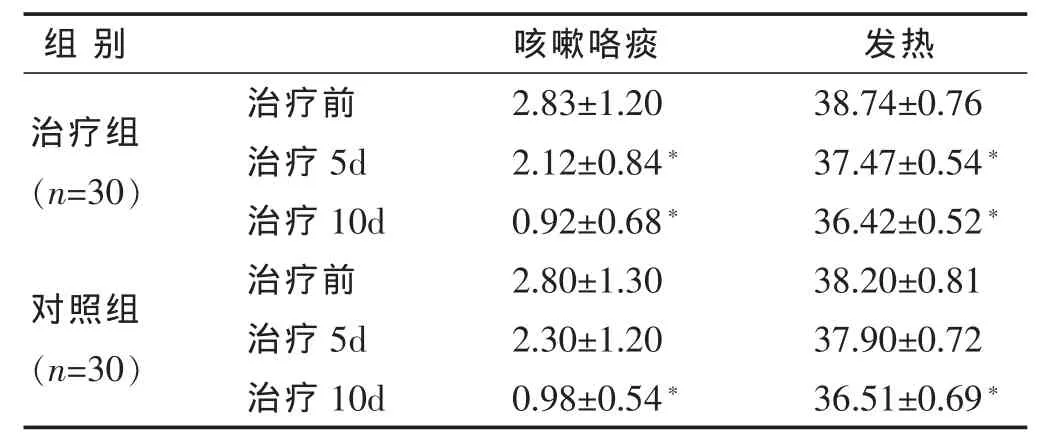
表1 两组咳嗽咯痰、发热积分比较 (±s)
与本组治疗前比较,*P<0.05;与对照组同期比较,△P<0.05。下同。
组别 咳嗽咯痰 发热治疗组(n=30)治疗前 2.83±1.20 38.74±0.76治疗 5d 2.12±0.84* 37.47±0.54*治疗 10d 0.92±0.68* 36.42±0.52*对照组(n=30)治疗前 2.80±1.30 38.20±0.81治疗 5d 2.30±1.20 37.90±0.72治疗 10d 0.98±0.54* 36.51±0.69*
2.3 两组治疗前后血常规、CRP水平比较 见表2。治疗组治疗后WBC、NE明显下降(P<0.05),对照组无明显改变(P>0.05);两组治疗后CRP均明显下降(P<0.05),组间无明显差异(P>0.05)。
表2 两组治疗前后血常规、CRP水平比较 (±s)

表2 两组治疗前后血常规、CRP水平比较 (±s)
CRP(mg/L)治疗组 治疗前 12.81±5.83 82.13±9.15 202.74±80.22 70.33±61.20(n=30) 治疗 10d 9.03±2.15*△71.37±9.82*△ 206.53±90.14 23.67±7.34*对照组 治疗前 11.79±6.23 78.92±10.02 217.02±78.37 65.97±57.19(n=30) 治疗 10d 10.77±5.18 72.34±10.01 204.93±88.74 21.37±40.18*组别 WBC(×109/L)NE(%)PLT(×109/L)
2.4 两组治疗前后炎症介质水平比较 见表3。两组治疗后 TNF-α、IL-6及 IL-1β 均明显下降(P<0.05),治疗组优于对照组(P<0.05)。
表3 两组治疗前后炎症介质水平比较 (pg/L,±s)

表3 两组治疗前后炎症介质水平比较 (pg/L,±s)
组 别 TNF-α IL-6 IL-1β治疗组 治疗前 82.34±40.35 44.47±12.31 78.87±25.14(n=30) 治疗 10d 58.60±35.87*△ 34.87±14.79*△ 56.47±32.45*△对照组 治疗前 87.04±60.55 46.18±14.13 80.98±33.14(n=30) 治疗 10d 72.61±54.32* 39.76±13.65* 71.20±42.97*
3 讨 论
根据脓毒症的临床症状,当属于中医学 “外感热病”范畴。本病病因病机复杂,分型多,而临床多见热毒炽盛证。中医认为,外感六淫,邪毒入里化火,或内有郁热,蓄而成毒,热毒积聚,内陷营血。 邪热郁肺,蒸液成痰,肺失宣肃,则咳嗽咯痰;毒蕴于腑,腑气不通则大便秘结,小便短黄;热毒内陷于营血之中,则伤津耗液,症见胸腹灼热,口渴冷饮,面红目赤,舌绛少津,苔黄,脉数。因此临床上根据其病因病机,提出通腑泻热活血为本病的治疗大法,以荡涤肠胃、攻实祛瘀、泻热逐邪。方中大黄、黄芩共为君药,二者具有釜底抽薪、急下存阴之功,山栀、玄参、当归、赤芍为臣药,其中山栀[6]清降心、肝、肺、胃及三焦之火,当归活血祛瘀,赤芍、玄参[7]清热凉血滋阴。药理研究显示,大黄可增加胃肠蠕动,改善胃肠功能,修复肠黏膜屏障,达到减少炎性介质释放、调节机体免疫功能的目的[8]。当归和赤芍能抑制高迁移率族蛋白B-1(HMGB1)的聚集,抑制由LPS介导的TNF-α的释放,防止致命性内毒素血症的产生[9-10]。玄参具有较强的抗炎活性,能减少炎症反应[11]。
在脓毒症发生发展的过程中,中性粒细胞(PMN)的激活与多器官功能障碍综合征(MODS)的发生、病情的严重程度及预后密切相关[12]。在此过程中,活化的PMN所释放的各种蛋白酶和炎症因子起着关键性的作用,进而引起器官功能的损害[13]。CRP是一种急性时相蛋白,与多种炎症因子相关,在全身炎症反应综合征(SIRS)状况下,血清中CRP水平迅速上升。因此,CRP是一种重要的急性炎症反应物质,可以反映细胞因子介导的全身炎症反应程度,是评价机体损伤的综合总体量化指标之一[14-15]。脓毒症时CRP越高,感染就越严重[15]。动态观测CRP的变化有利于判断疗效和疾病预后。
脓毒症时,由于机体产生的多种炎症反应形成“瀑布效应”,使炎症反应进一步扩大,甚至出现失控,从而导致以细胞自身性破坏为特征的全身性炎症反应。炎症因子中TNF-α为主要的炎性因子,也是炎性因子的最初启动者,它可通过激活细胞因子级联反应,诱导IL-1、IL-6、IL-8 等生成,从而导致炎症反应失控[16]。研究表明,IL-6和IL-1是脓毒症发生发展和转归中起关键作用的介质之一,其炎症作用可被IL-1Rα所阻止,它们合成及释放间的平衡在炎性疾病中起作重要作用[17-18]。
本观察表明,通腑泻热活血方可以抑制脓毒症早期促炎因子的释放,减轻炎症反应,疗效和症状较快改善可能与抑制促炎因子释放有关。但脓毒症时炎性因子的释放非常复杂,炎性因子之间相互影响,本研究只是观察其中很小一部分,结论可能存在偏颇,具体机制仍有待进一步研究。
[1]Levy MM,Fink M P,Marshall JC,etal.2001 SCCM/ESICM/ACCP/ATS/SIS InternationalSepsisDefinitionsConference[J].Intensive CareMed,2003,29 (4): 530-538.
[2]Hotchkiss R S,Karl IE.The Pathophysiology and treatment sepsis[J].NEngl JMed,2003,348 (2): 138-150.
[3]国家中医药管理局.中医病证诊断疗效标准[M].南京:南京大学出版社,1994:2.
[4]朱文锋.中医诊断学[M].北京:中国中医药出版社,2002:15.
[5]中华人民共和国卫生部.中药新药临床研究指导原则[M].北京:人民卫生出版社,1993:11-15.
[6]田智勇,于培明,许启泰.中药栀子的研究进展[J].时珍国医国药,2004,15(11): 782-784.
[7]国家药典委员会.中国药典(一部)[M].北京:化学工业出版社,2005:76.
[8]吕少敏,明自强,俞林明,等.大黄对脓毒症患者降钙素原、C 反应蛋白和白细胞的影响[J].中国中医急症,2006,5(10):1086-1087.
[9]HaichaoWang,Wei Li,Jianhua Li,etal.The Aqueous Extract of a Popular Herbal Nutrient Supplement,Angelica sinensis,Protects Mice against Lethal Endotoxemia and Sepsis[J].J Nutr,2006,136(11):360-365.
[10]魏利召,郑江,蒋栋能.赤芍拮抗内毒素活性的实验研究[J].中国临床药理学与治疗学,2005,10(3):326-328.
[11] 曾华武,李医明,贺祥,等.玄参提取物的抗炎和抗氧活性[J].第二军医大学学报,1999,20(9):614-616.
[12] Ikei S M1 Ogawa Y.Yamaguchi1 Blood concentrations of polymorphonuclear leucocyte elastase and interleukin-6 are indicators for the occurrence ofmultiple organ failures at the early stage of acute pancreatitis [J].Gastroenterol Hepatol,1998,13(6): 1274-1283.
[13] MoraesTJ,ChowCW,DowneyGP.Proteasesand lunginjury[J].CritCareMed,2003,31(4):189-194.
[14]李俊,黄宏强,周志民,等.清热通腑法对脓毒症患者血清降钙素原和C反应蛋白水平的影响[J].辽宁中医杂志,2009,36(5):692-693.
[15] Rey C,LosArcosM,Concha A,etal.Procalcitonin and C-reactive protein asmarkersof systemic inflammatory response syndrome severity in critically ill children [J].Intensive Care Med,2007,33(3):477-484.
[16] Murphy K,Haudek SB,Thompson M,et al.Molecular biology ofseptic shock[J].New Horisons,1998,6(2):181-192.
[17] De Bont ES,De Leij LH,Okken A,et al.Increased plasma concentrationsof interleukin-1 receptorantagonist in neonatal sepsis[J].PediatrRes,1995,37(12):626.
