利用液膜扩散微型实验探究钒酸盐的变化规律
2011-06-12杨佐志王晓忠
杨 兴,杨佐志,王晓忠
(河北民族师范学院化学系, 河北 承德 067000)
0 引 言
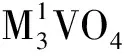
1 仪器及试剂
仪器:点滴皿,专为液膜扩散微型实验设计,获国家专利权的新玻璃器皿,此实验用自制代用品;点滴皿的代用品的裁制,即选取2~3 mm厚的表面平整无划痕的普通玻璃,用玻璃刀裁成10 cm×10 cm的正方形,再用纱布磨去四边的锋刃即可.酸度计或精密pH试纸.
试剂:NaVO3(0.1 mol/L、0.3 mol/L)、H2SO4(1 mol/L、2 mol/L)、NaOH(0.1 mol/L、1 mol/L)、H2O2(质量分数为3%、10%),均为分析纯.
2 偏钒酸钠(NaVO3)溶液随pH值降低的变化过程
2.1 实验步骤
分别取2~3滴0.3 mol/L的NaVO3和1 mol/L H2SO4于点滴皿上相距约1 cm处,用玻璃棒摊平使其形成溶液膜,并使其逐渐接近,当两种溶液膜相互接触后,停止外力作用,让溶液中的物质自然扩散反应.点滴皿上呈现有序的物色区域:无色、黄色、红棕色晶体、黄色、无色,并小心测试各区域的pH值.
2.2 NaVO3溶液随pH值降低过程的实验现象
照片1为NaVO3溶液与稀H2SO4的自然扩散反应.
2.3 NaVO3溶液随pH值变化的分析示意图
图2为NaVO3溶液随pH值变化的分析示意图.
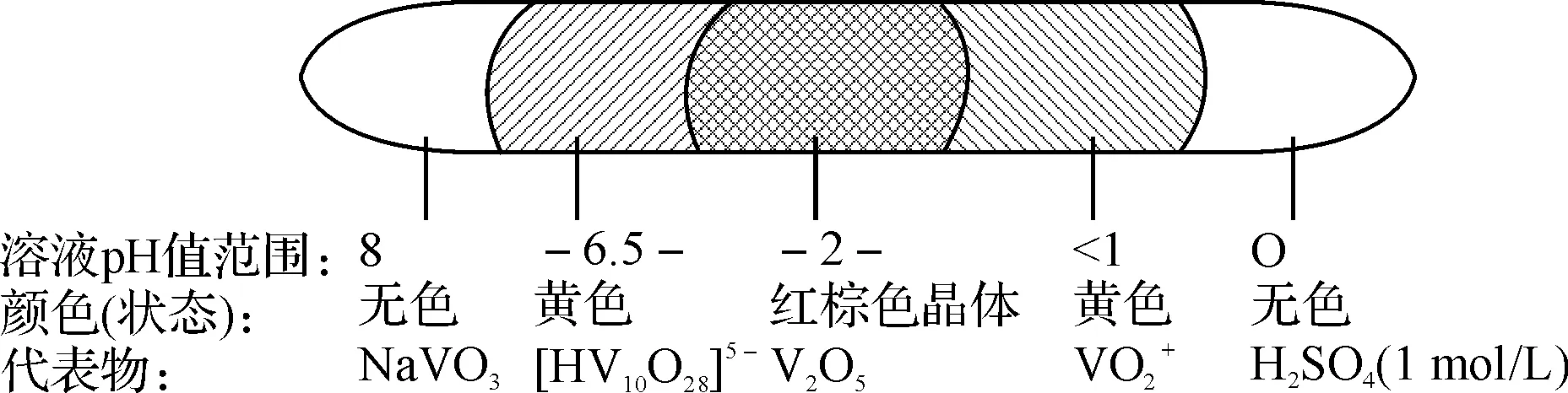
图2 NaVO3溶液随pH值变化示意图
2.4 对NaVO3与稀H2SO4两溶液膜之间自然扩散过程的理论分析
由于NaVO3溶于水发生水解-聚合反应:
……
测得0.3 mol/L NaVO3溶液的pH≈8(偏碱性),它与1 mol/L的H2SO4(pH=0)溶液膜接触后互相稀释,溶液的pH值从左至右逐渐减小,当钒酸盐溶液的pH趋于6.5时逐渐变黄色:



钒酸盐溶液的pH值趋于2时,析出红棕色晶体五氧化二钒水合物.

在点滴皿上的溶液膜中,钒酸盐从左(pH≈8)逐渐扩散至右(pH=0)的变化,形成五个综合对比的物区.如图1,出现了鲜明的对比现象,反映了钒酸盐溶液随pH值的变化规律.
3 钒酸盐与双氧水反应随溶液酸碱性的变化
3.1 实验过程
分别取2~3滴质量分数为10%的H2O2和0.3 mol/L NaVO3于点滴皿上形成溶液膜,并在1位加1滴0.1 mol/L NaOH,3位加1滴1 mol/L H2SO4,用玻璃棒把1、2、3溶液膜分别相连(每次用玻璃棒要清洗).
3.2 实验现象
1、2位溶液变黄色,3位溶液开始变黄色,随着反应进入强酸性而变红棕色.
照片2为钒酸盐与双氧水反应随溶液酸碱性的变化.

图3 钒酸盐与双氧水反应随溶液酸碱性变化图
3.3 现象及分析
参考图3,在点滴皿上偏钒酸钠与过氧化氢两种溶液膜之间,从弱碱性到弱酸性环境中得到二过氧钒酸离子[VO2(O2)2]3-黄色;强酸性环境中得到红棕色的过氧钒阳离子[V(O2)]3+,两者之间存在下列平衡:
H2O2+2H2O
由反应物与生成物形成鲜明对比,可利用此变化规律鉴定钒酸盐.
4 结 语
通过大量实验证明,此研究方法所用试液是滴量,仪器和操作步骤都比较简单,能清晰观察到物质自然变化过程中的规律性,提高了综合研究的效果.
参考文献:
[1] 北京师范大学无机教研室.无机化学[M].4版.北京:高等教育出版社,2008:750-753.
[2] 北京师范大学无机教研室.无机化学实验[M].3版.北京:高等教育出版社,2008:180.
[3] 杨兴.微型化学反应器皿:CN,201441917 U[P].2010-04-28.
[4] 天津大学无机化学教研室.无机化学[M].3版.北京:高等教育出版社,2008:408.
