千岛湖细鳞鲴种群线粒体COⅠ基因变异及遗传分化研究
2011-06-08曲宪成刘其根张开岳蒋骄云
曲宪成,张 勇,刘其根,张开岳,蒋骄云,冯 龙
(上海海洋大学水产与生命学院,上海 201306)
随着分子生物学技术的发展,基于DNA序列测定的分子数据已被广泛应用于种群遗传结构以及系统发育的研究中。线粒体DNA(mitochondrial DNA,mtDNA)具有分子小、编码率高、拷贝数多、进化速率快、遵循母系遗传等特征,使得其在鱼类分子进化、种群遗传结构等研究领域得到广泛应用[1]。由于其基因组的大小与基因的空间排列相当稳定,且不同基因进化速度不同,因此可以根据不同物种以及物种亲缘关系的远近以及研究的水平选取合适的线粒体基因片段进行种群结构分析。其中鱼类线粒体细胞色素氧化酶I亚基(cytochrome oxidase subunit I gene,COⅠ)功能保守,同时又具有一定进化速率,已成为群体结构与系统发育等领域应用较广的分子标记[2]。
千岛湖是人工修建水利大坝后形成的湖泊,湖泊的形成改变了原来的生态环境,环境的改变对鱼类种群会有一定影响[3]。细鳞鲴(Xenocypris microlepis)在千岛湖中分布广泛,数量较为庞大的种群。细鳞鲴隶属于鲤形目,鲤科,鲴属。头小,口下位,体侧扁,呈锥形,体银白色,背部灰黑色,鳞片细小,排列紧密。其肉质细嫩鲜美,食料来源广泛,饲养容易简便,深受人们欢迎。在我国大多数江河湖泊中均有分布,通常生活在江河、水库、湖泊中下层,以其发达的下颌角质刮食在水底的藻类和有机碎屑,具有净化水质的作用[3]。目前,细鳞鲴群体分析仅有乔德亮[4]利用形态学方法进行过探讨,还未见用分子遗传标记分析的报道。本研究采集了千岛湖中的地理位置相对较远的汾口(FK)、姜家镇(JJZ)、富文(FW)、临岐(LQ)4个地点的细鳞鲴群体,并利用线粒体COⅠ基因部分序列为标记,对这4个群体进行分析,一方面可以了解千岛湖细鳞鲴的种群遗传结构和遗传多样性,另一方面可以了解环境改变对鱼类群体的影响,并进一步从分子水平了解水利工程对生物多样性的影响,为保护生态环境和鱼类生物资源提供科学依据。
1 材料与方法
1.1 材料
研究所用标本于2008年7月至2008年8月分别采自千岛湖汾口(FK)、姜家镇(JJZ)、富文(FW)、临岐(LQ)4个地点。标本用95%的酒精固定,储存于4℃冰箱待用。
1.2 方法
1.2.1 基因组DNA的提取 基因组DNA采用酚-氯仿法[5]。溶解稀释使其最终浓度为150 ng/μL,-20℃保存备用。
1.2.2 线粒体COⅠ基因的扩增 扩增线粒体COⅠ基因的引物序列为:F:5′-CTA ARC RCT CGG CTA CCC TAC-3′;R:5′-GAG TGG TYA TGT GAC TGG CTT G-3′。引物由上海生工生物技术有限公司合成。PCR反应体系为:10×PCP buffer(Mg2+Plus)5 μL,2.5 mmol/L dNTPs 4 μL,10 μmol/L 引物各 2.5 μL,Taq 酶 1.25 U,以及模板 DNA 375 ng,加灭菌双蒸水至50 μL。Taq DNA聚合酶、标准分子量DNA、dNTP等试剂,均为TaKaRa公司产品。PCR反应条件为:94℃预变性5 min;94℃变性45 s,59.5℃退火30 s和72℃延伸2 min,共35个循环;最后72℃延伸7 min。PCR产物在1.5%琼脂糖凝胶中电泳,溴化乙锭(Ethidium bromide,EB)染色,凝胶成像系统检测。将PCR产物送上海杰李生物技术有限公司测序。
1.2.3 COⅠ基因部分片段分析 用获得的COⅠ基因序列设计引物,产物片段大小为560 bp,上游引物位于510 bp处,下游引物位于1 070 bp处。上下游引物分别为:F:5′-ATG AAA CCG CCA GCC ATC TC-3′;R:5′-ACA ATT CCT GTT AGT CCG CCT-3′,由上海生工生物技术有限公司合成。PCR反应体系同上。PCR反应条件为:94℃预变性5 min;然后进行94℃变性45 s,56.5℃退火30 s和72℃延伸1 min,共35个循环;最后72℃延伸5 min。PCR产物经琼脂糖凝胶电泳检测后,将有单一明亮条带的PCR产物送往上海杰李生物技术有限公司进行双向测序。
1.2.4 数据分析 双向测序结果用DNAStar软件进行编辑校对,ClustalW 软件[6]进行序列重排和同源比较。用Arlequin 3.1软件[7]计算群体的单倍型多样性(h)和核苷酸多样性(π),以及分子方差分析(AMOVA)和 Tajima′s D 值检验[8];并用 TCS 1.21软件[9]对单倍型作最小拓展网络(minimum spanning network)分析。
2 结果与分析
2.1 线粒体COⅠ基因全长
在COⅠ两端保守的tRNA序列区域设计引物(F:5′CTA ARC RCT CGG CTA CCC TAC-3′;R:5′-GAG TGG TYA TGT GAC TGG CTT G-3′),对细鳞鲴基因组DNA进行PCR扩增。扩增产物用1.5%的琼脂糖凝胶电泳检测结果显示(图1),具有明亮单一条带。PCR扩增产物经双向测序,获得了1 551 bp的细鳞鲴的COⅠ基因序列。
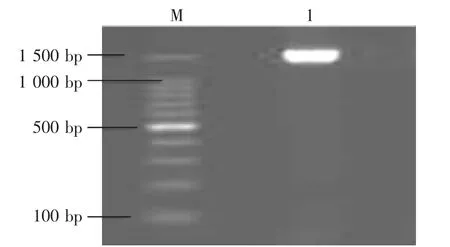
图1 细鳞鲴线粒体COⅠ基因扩增电泳图谱
将获得的序列与银鲴(X.argentea)AP009059,黄尾鲴 (X.davidi)GQ289558 和圆吻鲴 (D.tumirostris)DQ026431进行同源性分析,结果表明:此序列与银鲴,黄尾鲴和圆吻鲴的COⅠ基因序列相似度分别为94%、94%和92%,具有较高同源性。
2.2 COⅠ基因序列分析
2.2.1 序列变异分析结果 线粒体COⅠ基因部分片段扩增产物双向测序后,共获得4个群体84个个体COⅠ基因部分序列,长度为560 bp。部分扩增产物电泳图见图2。4个群体COⅠ基因片段序列的A、T、G、C含量具有一定的偏倚性,A+T含量明显高于G+C含量(表1)。84个样本基因序列共有3个变异位点,分别发生在第45、264、395三个位点,4 个单倍型,分别为 hap1(FK1)、hap2(FK7)、hap3(LQ12)、hap4(FW26);其中,FK、LQ 以及 FW 各有两个单倍型,JJZ只有一种单倍型(表2)。其中,有一个共享单倍型,为4个群体共有。
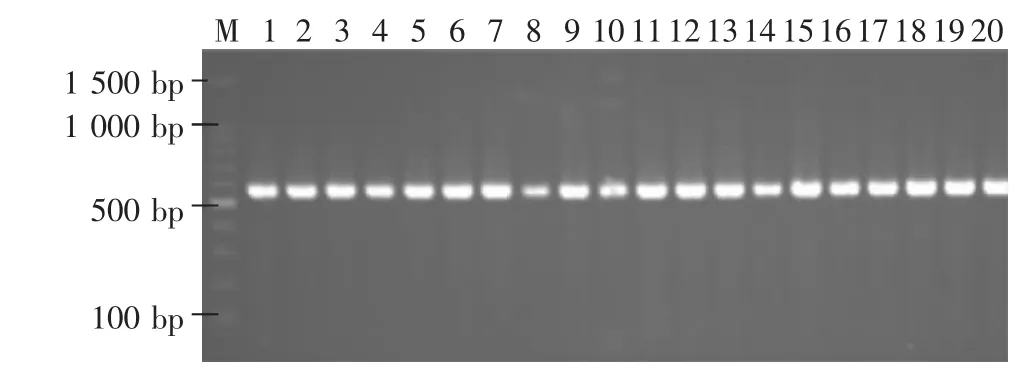
图2 560 bp的COⅠ基因部分片段序列扩增产物电泳图
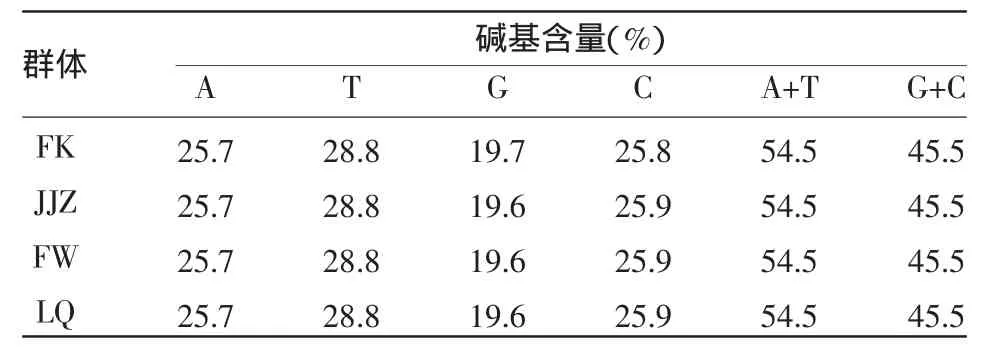
表1 细鳞鲴COⅠ基因部分片段碱基组成
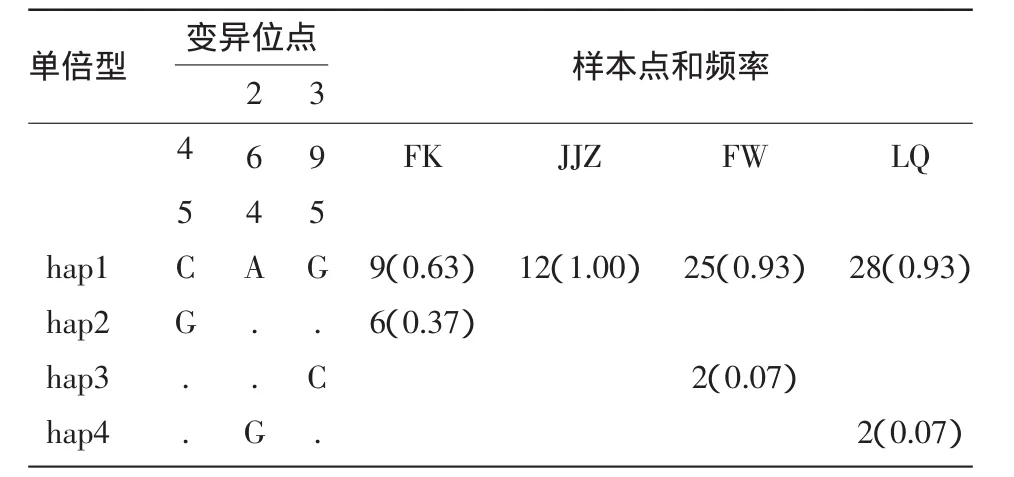
表2 四个单倍型的变异位点及样本数
2.2.2 种群遗传结构分析 FK群体的单倍型多样性(h)和核苷酸多样性(π)水平最高(表3),分别为0.500 0和0.001 9;其他3个群体单倍型多样性(h)和核苷酸多样性(π)水平较低。样本的单倍型多样性以及核苷酸多样性都处于较低的水平,种群的遗传多样性水平低。Tajima′s D中性检验结果表明,几个群体的Tajima′s D值均未达到显著水平。
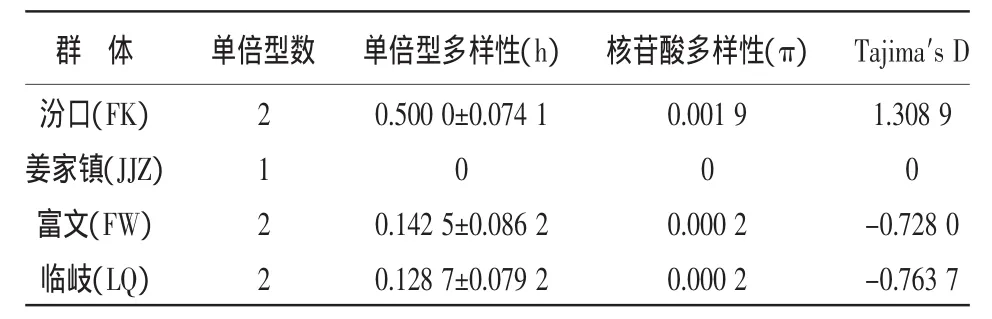
表3 细鳞鲴线粒体COⅠ基因部分片段的遗传多样性
分子方差分析(AMOVA)结果见表4。在4个群体总的遗传变异中,群体间遗传变异占23.56%,群体内遗传变异占76.44%,可见群体内变异是总变异的主要来源。但四群体总的遗传分化指数FST值为0.235 6,差异不显著,表明群体间没有明显的遗传结构变异。

表4 细鳞鲴四个群体的AMOVA分析
对所有单倍型做最小拓展网络(minimum spanning network)分析表明(图 3),FK1 是最主要、最原始的单倍型,其他的单倍型为拓展单倍型(方框内的字符为单倍型编号)。
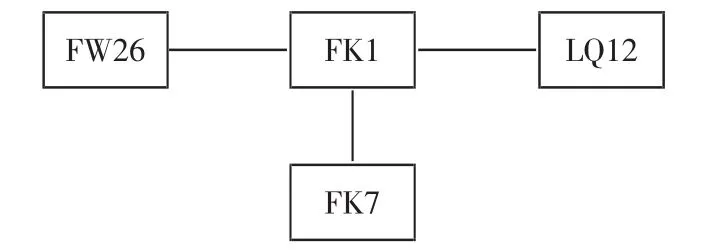
图3 所有单倍型最小拓展网络图
3 讨论
线粒体DNA是一种共价闭合、环状的双链DNA分子,其结构简单,呈母系遗传,种群之间的遗传差异易于被检出,因此被广泛地应用于鱼类种群分析的研究[2,10-11]。脊椎动物线粒体多个蛋白编码基因都包含有良好的系统发育信息[12]。COⅠ基因以及细胞色素b(cytb)两个蛋白编码基因在遗传结构中的应用最为广泛。其中COⅠ基因进化速率适中,既可用于种间分析,也适合于种群水平差异的检测;cytb基因的结构和功能研究的较为清楚,也适合于研究群体间的遗传差异[13]。除了蛋白编码基因,线粒体的控制区序列也是一个有效的分子标记,其进化速率稍快,被较多地应用于近缘物种间的系统进化以及种群遗传结构等方面的研究[10]。
本研究利用COⅠ基因两端保守的tRNA编码区设计引物获得了COⅠ基因序列全长,用部分COⅠ基因序列作为分子标记对千岛湖细鳞鲴群体进行了分析。通过扩增测序获得了1 551 bp的细鳞鲴COⅠ基因序列全长,获得的COⅠ基因序列与其他鲴属鱼类COⅠ基因序列相似度高,具有较高的同源性。利用部分COⅠ基因序列进行种群分析结果表明,4个群体细鳞鲴部分COⅠ基因序列仅有3个变异位点,变异率很低,84个样本仅有4个单倍型。核苷酸多样性(π)是表示每个种群内,各个单倍型的两两配对差异的平均值,是一个群体的遗传多样性指标。较低核苷酸多样性表明:一方面较低的遗传多样性水平说明千岛湖细鳞鲴群体间的基因交流受到了一定的影响,另一方面表明线粒体COⅠ基因分子标记作为检测千岛湖细鳞鲴群体遗传多样性的有效性有所欠缺。分子方差分析(AMOVA)结果显示群体间的变异对总的变异贡献较小,提示千岛湖四群体间没有产生遗传分化。
[1] 肖武汉,张亚平.鱼类线粒体的遗传与进化[J].水生生物学报,2000,24(4):384-391.
[2] 张凤英,马凌波,施兆鸿,等.3种鲳属鱼类线粒体COⅠ基因序列变异及系统进化[J].中国水产科学,2008,15(03):392-399.
[3] 袁思平,吴仲宁,蔡惠凤,等.樟溪河渔业资源调查及细鳞斜颌鲴人工繁育[J].宁波大学学报(理工版),2010,23(4):31-34.
[4] 乔德亮,李思发.细鳞斜颌鲴3个群体形态差异[J].生态学杂志,2010,29(12):2425-2430.
[5] Sambrook J,Fritsch E F,Maniatis T.Molecular cloning:A laboratory manual[M].New York:Cold Spring Harbor Laboratory Press,1989.
[6] Thompson J D,Gibson T J,Plewniak F,et al.The ClustalX windows interface:flexible strategies for multiple sequence alignment aided by quality analysis tools[J].Nucleic Acids Research,1997,25:4876-4882.
[7] Excoffier L,Laval G,Schneider S.Arlequin ver.3.0:An integrated software package for population genetics data analysis[J].Evolutionary Bioinformatics Online,2005,(1):47-50.
[8] Tajima F.Evolutionary relationship of DNA sequences in finite populations[J].Genetics,1983,105:437-460.
[9] Clement M,Posada D,Crandall K A.TCS:a computer program to estimate gene genealogies[J].Molecular Ecology,2000,9(10):1657-1660.
[10] 杨金权,胡雪莲,唐文乔.长江及其南部邻近水域刀鲚的种群遗传结构及种群历史 [J].上海水产大学学报,2008,17(5):513-519.
[11] 彭士明,施兆鸿,侯俊利,等.银鲳3个野生群体线粒体COⅠ基因的序列差异分析 [J].上海水产大学学报,2009,18(4):398-402.
[12] Zardoya R,Meyer A.Phylogenetic performance of mitochondrial protein-coding genes in resolving relationships among vertebrates[J].Molecular Biology and Evolution,1996,13(7):933-942.
