放射治疗中绝对剂量的测量
2011-06-08胡杰陶建民张莹余根培张颖
胡杰,陶建民,张莹,余根培,张颖
同济大学附属第十人民医院肿瘤及放射治疗科,上海,200072
肿瘤放射治疗主要采用直线加速器或钴60产生的高能光子(χ、γ线)和高能电子束来治疗恶性肿瘤,剂量准确是治疗成功的前提条件。国际辐射单位和测量委员会ICRU第24号报告提出原发肿瘤根治剂量的精确性应好于±5%[1],至今该标准仍是各肿瘤放射治疗单位质量控制追求的目标。绝对剂量测量是放射治疗中剂量误差的主要来源,包括两个方面的内容,一个是常规剂量校准,根据国际卫生组织WHO的规定,剂量校准允许误差精度为2%;另一个是调强放射治疗 (intensity modulated radiation therapy,IMRT)技术中的绝对剂量验证。IMRT技术由于在提高患者生存率和降低并发症方面的优势,已在放疗中得到广泛的普及和应用[2][3],绝对剂量验证的通过是IMRT技术实施许可的前提。但是在放射治疗单位,由于从事这项工作的人员水平和理解方面的问题,导致部分单位在绝对剂量测量方面发生较大的误差。本文通过针对绝对剂量测量使用的剂量系统、剂量系统的保管和使用、模体的选择、剂量校准和调强放射治疗中绝对剂量验证等方面存在的问题,提出我们的解决方法供同行参考。
1 绝对剂量测量使用的剂量系统
绝对剂量测量使用的剂量系统包括剂量仪和电离室:电离室通过同轴电缆与剂量仪相连,作用是收集电离辐射产生的次级电荷;剂量仪的主要作用是对收集到的电荷进行放大、累积和降噪处理。剂量仪的选择宜采用国际上认可的品牌,如NE公司的Farmer系列,Capintec公司的Capintec系列等;电离室选购必须结合本单位治疗设备类型和开展的放射治疗技术,如果只有高能光子线进行常规放射治疗,只须0.6 cc指型电离室进行剂量校准;如果有高能电子束,尤其是能量小于5 MeV的电子束,必须另配置一个平型板电离室用于电子束的剂量校准,因为0.6 cc指型电离室不能对能量小于5 MeV的电子束进行剂量校准[4]。开展IMRT技术,由于该技术导致的剂量分布梯度很大,而电离室都有一定的体积,最终测得的剂量可能因剂量分布被体积平均而变得不准确,使用前应考虑其大小,其横截面和有效测量长度要小于它所在的剂量均匀区。当多射束多角度照射时,还要确定电离室对入射角度的响应。此种要求的电离室应有足够高的空间分辨率,可以发现大小约为±1 mm的等剂量分布曲线位置差。因此,IMRT绝对剂量验证不能采用0.6 cc指型电离室,而必须配置灵敏体积小的电离室,多数放疗单位报告显示使用≤0.15 cc体积的电离室更为妥当,如采用capintec 0.07cc、0.14cc, PTW 0.1 cc和VICTOREEN0.1 cc电离室等。
2 剂量系统的保管和使用应注意的问题
由于剂量仪和电离室受潮会导致电荷泄漏而影响测量的准确性,日常保管必须放在密闭且有干燥剂的干燥箱内,放射物理师应定期检查干燥剂的颜色,并及时进行更换。若对剂量仪进行适当的干燥处理,剂量校准时照射时间短而电荷泄漏导致的读数基数较小,可以忽略不计。在相同照射条件下,小体积灵敏电离室收集到电离电荷量少,也就是说测量系统的有用信号较弱,而漏电和噪声对测量结果的影响相对较大,漏电的影响体现为系统误差。IMRT技术照射的时间很长,往往超过30 min,电荷泄漏可能达到几个cGy,此时必须先按照待验证的治疗计划所需要的治疗时间,预先测量电荷泄漏达到的剂量大小,在正式验证时予以扣除。剂量仪和电离室必须应用标准源(参考源)对其长期稳定性进行检查。如果确没有标准源,可用钴60ɣ源替代。该检查应每月进行一次。
剂量仪和电离室购置以后并不能直接使用,按照剂量校准的两个基本公式Dw=ND*Mu*Sw,air*Pu*Pcel和ND=Nx*W/e*Katt*Km,首先必须将剂量仪和电离室一起送到质量技术监督部门强检,取得照射量校准因子Nx后才能进行校准时的剂量计算。修正系数Katt、 Km随所用的电离室不同(主要是收集电极、壁材料不同)而有所变化,随着现在用于放射治疗校准电离室的品种和材料的增加,这两项修正的乘积可以从0.950(EXRADIN 0.5 cm3)到0.990(CAPINTEC 0.65 cm3 PR0.6C),变化幅度达4%。因此,引进对特定电离室的修正就显得十分必要。但是,IAEA277号报告所提供的电离室的这两项修正数据并不完善,尤其没有收集国产电离室的数据,使得使用国产剂量测量系统十分困难。如果计量检定部门在检定时直接向用户给出空气中吸收剂量校准因子ND,则这个问题将得到很好的解决。因此,我们建议使用国产剂量测量系统的单位,在剂量仪送质量技术监督部门强检时,要求直接给出吸收剂量校准因子ND取代Nx,对临床现场工作将更为方便有效,且质量技术监督部门直接给出ND并无技术困难。
目前我国质量技术监督部门强检只对0.6cc指型电离室进行,对平型板电离室和IMRT剂量验证用的小体积电离室不能进行检定给出Nx因子,且此类电离室的相关参数如Katt、Km很难找到。因此,只能用替代法测量并计算出平型板电离室或小体积电离室的吸收剂量校准因子ND。以小体积电离室为例,说明替代法测量方法。用直线加速器6MV—X线或钴60ɣ线,射野10 cm×10 cm,把小体积电离室连接到剂量仪上,电离室插入水等效模体中,电离室中心置于射野中心,测量深度5 cm,作气压、温度修正,开机100 MU 5次取剂量仪读数的平均MU值。同样位置,换上0.6 cc电离室,作气压、温度修正,开机100MU 5次取剂量仪读数的平均值MU0.6cc。吸收剂量计算公式如下:
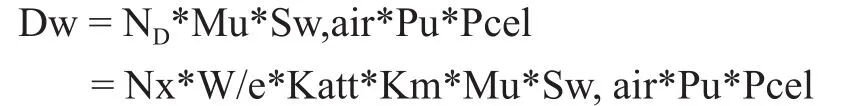
因此0.6 cc指型电离室的吸收剂量D0.6cc是
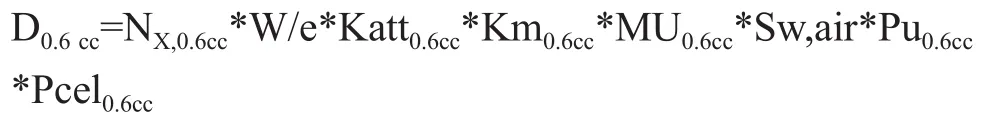
而同一点小体积电离室的吸收剂量D小是
D小= NX,小*W/e*Katt小*Km小*MU小* Sw,air *Pu小*Pcel小,设F小= NX,小*W/e*Katt小*Km小* Sw,air *Pu小*Pcel小,
则D小=F小*MU小,由于0.6cc指型电离室和小电离室测量的是同一点的吸收剂量,因此D小=D0.6cc,也就是
F小*MU小=NX,0.6cc*W/e*Katt0.6cc*Km0.6cc*MU0.6cc* Sw,air*Pu0.6cc*Pcel0.6cc从而可得F小=NX,0.6cc*W/e*Katt0.6cc*Km0.6cc*MU0.6cc* Sw,air *Pu0.6cc*Pcel0.6cc÷MU小。这样,在以后的剂量验证中,实际吸收剂量等于温度和气压修正后的剂量仪读数乘以小电离室的F小即可。考虑到加速器的短期稳定性不如钴60,如果本单位有钴60治疗机,用它来进行替代法测量并计算F小可能更好。
3 模体的选择
常规剂量校准目前多采用标准的30 cm×30 cm×30 cm水箱,测量时贮水达到所需的深度。也有单位采用其它尺寸的水箱,但要特别注意,电离室有效测量点后的水深度必须大于5 cm,以提供足够的反向散射。同时电离室有效测量点左右前后四个方向距离水箱边缘也必须大于5 cm,以满足侧向散射的要求。
尽管一些国际组织曾建议对IMRT计划验证进行体内剂量测量,但是除某些部位如射线出、入射侧皮肤表面和管腔外,就多数部位而言,进行体内剂量测量仍有困难。那么,将IMRT计划移植到模体上来测量模体内的剂量分布就是一种合理且可行的治疗前剂量验证方法。就模体的类型而言,按外形可分为人形模体和非人形模体;按电子密度可分为均质模体和非均质模体;按解剖部位分为头部、胸部和盆腔模体。它们的共同特点是可放置一定数量的不同电离室。选择何种模体取决于研究者的兴趣、目的和可获得性等因素。人形模体具有人体的几何形状,因而用于验证IMRT计划可以激发对IMRT的信心。但是此类模体也有缺陷,因为是不均质的,评价剂量的准确性时更困难,可能导致过多的治疗计划通不过绝对剂量验证。对于患者的质量保证,使用人形模体常常不如规则的几何模体更好。比如在头颈部,患者在特定的位置相对于激光系统的直径可能随头的旋转产生明显的变化。因此,如果人形模体和患者头部的倾斜程度不同,测量区域的直径和测得的剂量都会有较大的差异。虽然几何外形规则的模体看起来不象患者,但能准确地确定剂量仪与模体定位系统或其他系统的相对位置并测量绝对剂量。这在均质算法中规则的均质模体优势更明显。采用均质模体,应采用水等效材料制作如固体水。应特别引起注意的是绝对剂量验证不应采用有机玻璃,因为有机玻璃的密度、电子密度和有效原子序数等与水并不等效,增加了绝对剂量验证的误差来源。
4 剂量校准
吸收剂量计算公式中的Sw, air、Pu两个因子,依赖于具体的辐射质。钴60由于能量稳定,不需要测量,按平均能量1.25 MeV计算Sw, air、Pu因子。高能X线必须测量辐射质指数(quality index)TPR20,10或D20/D10,在此基础上计算Sw, air、Pu因子。高能电子束剂量校准Sw, air、Pu两个因子计算问题更复杂,笔者在《直线加速器高能电子束剂量校准时应注意的若干问题及对策》[5]中有较详细的阐述,不再展开讨论。
国际卫生组织WHO对剂量校准精度的要求是必须好于2%[6],因此100机器MU标准定标条件下校准点绝对剂量Dw实际测量值必须在98cGy—102cGy这一范围,而开展IMRT技术剂量校准误差应控制在1%以内以提高计划验证通过率。如果超出这个范围,必须由维修工程师及时进行调整,直到符合校准精度的要求为止。这个工作每个星期必须进行两次以上。目前很多单位高年资的物理师只注重放射治疗计划的设计,而把剂量校准这项基本工作交给一些低年资的物理师甚至一些刚工作的人员进行,我们认为这是不对的。标准定标条件下1MU=1cGy永远是放射治疗成功的基础和前提保证,这个工作没做好其它工作将没有任何实际意义,在此我们也呼吁每个单位高年资的物理师应亲自做好这项工作。
5 调强放射治疗中的绝对剂量验证
IMRT计划的绝对剂量验证是将已经确定的患者治疗计划移植到CT扫描经三维重建好的水等效模体中形成杂交计划并进行剂量计算,选择绝对剂量验证点通过点剂量得到该点的计算剂量。然后,调用杂交计划数据对水等效模体进行模拟调强照射,每个野及其子野的跳数完全按照患者的实际计划进行,通过完整计划的照射测量验证点的实际剂量,与计算剂量进行对比。实际剂量与计算剂量比对通过的标准,不同作者有不同的限值,误差评价目前引用较多的是Van Dyke标准。该标准规定,较复杂的情况下,计划与实测剂量差别的可接受性限值,在高剂量低梯度区域应在4%以内[7]。而low等采用的标准是高剂量低剂量梯度区的剂量差别不超过3%[8],这个标准已逐步为大多数放射肿瘤中心采用。也有部分单位将绝对剂量验证标准确定在5%,需要注意人不是刚性体,也不是均质的,考虑到这些因素对吸收剂量的影响,这个标准将导致患者实际吸收剂量误差必然超过5%。我们认为Van Dyke标准是一个基础要求,而low的标准是有待实现的目标。
许多放疗单位在绝对剂量验证中发现误差经常超过上述的标准,而不得不改用其它放射治疗技术。我们分析下来,存在两个应特别注意的原因。一个原因是调强放疗每个子野照射跳数(MU)远远少于常规放疗每个射野的照射跳数,可能少至几个,甚至只有1或2个MU的子野出现,而低MU照射时MU与cGy的对应关系不再是线性,甚至有较大的偏差(张颖等报道MU数越小偏差越大,当MU设置小于5时,偏差即超过2.5%,最大偏差达到10.3%),如果不做修正,将会导致验证时实际测量到的剂量与计划计算到的剂量间产生不可接受的误差[9]。我们认为在做调强放射治疗计划时,必须首先测量本单位加速器低MU照射时MU与cGy的对应关系并进行剂量学的修正,然后进行实际剂量的绝对验证,可提高验证通过率。另一个原因是绝对剂量验证点选取不对。绝对剂量验证测量点的选择一般标准是在高剂量低梯度区域内选择。由于调强放疗计划子野的形状非常复杂,选择测量点必须非常慎重。可行的方法是通过BEV进行观察,如果所有子野的叶片端面均不与等中心点相切,选择等中心点进行剂量验证比较可行。但如有子野的叶片端面与等中心点相切,则选择等中心点进行剂量验证会由于电离室的体积平均效应而引起较大的测量误差,因此测量点必须位于等中心点外的其它位置。为提高测量精度,选择测量点可以按如下方法:在照射计划的横断面内,在预选测量点及5 mm范围上、下、左、右各选择另外四个点通过点剂量测量计划内的5个剂量数值,如果周围四个点的剂量与预选测量点剂量的百分误差小于0.5%,则选择该点进行绝对剂量验证是可行的。
[1]ICRU Report No.24.Determination of absorbed dose in a patient irradiated by beams of X-orγ-rays in radiotherapy procedures[R].Bethesdel: ICRU, 1976.
[2]蒋国梁.原发性肝癌三维适形和调强放疗的基础和临床研究[J].中国工程科学, 2009, 11(10): 129-136.
[3]李珠明, 崔玉琴, 等.鼻咽癌调强放疗靶区剂量学研究及近期疗效观察[J].中国医学物理学杂志, 2009, 26(5): 1367-1370,1375.
[4]International Atomic Energy Agency.TRS 277 Absorbed Dose Determination in Photon and Electron Beams[R].Vienna:IAEA,1987.
[5]胡杰, 陶建民, 张莹, 等.直线加速器高能电子束剂量校准时应注意的若干问题及对策[J].中国医疗器械杂, 2010, 34(2): 94-96.
[6]World Health Organization.Quality Assurance in Radiotherapy[R].Geneva: WHO, 1988.
[7]Van Dyk J,Barrett RB,Cygler JE,et a1.Commissioning and quality assurance of treatment planning computers[J].Int J Radiat Oncol Biol Phys, 1993, 26: 261—273.
[8]Low DA,Mutic S, Dempsey JF, et al.Quantitative dosimetric verification of an IMRT planning and delivery system[J].Radiother Oncol, 1998, 49(3): 305-316.
[9]张 颖, 陶建民, 胡 杰, 等.直线加速器低MU照射对高能X线剂量学的影响[J], 同济大学学报医学版, 2010, 31(4):35-38.
