EGFR、VEGF和PTEN在结直肠癌中表达及与其临床病理特征的关系
2011-06-07谷化平尚培中
谷化平 尚培中
结直肠癌是消化道常见的恶性肿瘤之一。大量研究表明,结直肠癌的形成和转移的发生是一个多基因、多因子共同作用的结果。我们采用免疫组化方法,探讨表皮生长因子受体(epidermal growth factor receptor,EGFR)、血管内皮生长因子(vascular endothelil growth factor,VEGF)和张力蛋白同源物基因(phoshatase and tension homology deleted on chromosome fen,PTEN)蛋白表达与结直肠癌浸润、转移的关系,及EGFR、VEGF与 PTEN蛋白表达之间的相关性,为预测结直肠癌浸润转移提供客观参考指标。
1 材料与方法
1.1 材料
1.1.1 标本来源 选取我院2004年~2010年手术切除的结直肠腺癌标本98例(结肠癌57例,直肠癌41例),男性67例,女性31例,平均年龄(52.4±11.8)岁。取20例同期患者远癌切缘处正常大肠黏膜组织(距癌灶>4cm)作为对照组。标本均经40 g/L中性福尔马林液固定,石蜡包埋,4 μm厚连续切片。
1.1.2 试剂 鼠抗人EGFR、VEGF、PTEN抗体和LSAB试剂盒购自迈新生物技术公司(均为即用型)。
1.2 方法
1.2.1 免疫组织化学染色 采用微波-链霉菌素-生物素(MW-LSAB)免疫组织化学法和应用微波-金属盐抗原修复技术。即切片常规脱蜡水化后,放入枸橼酸缓冲液(10 mmol/L,pH 6.0)内,用微波仪(YWY781A医用型)170 W辐射5 min,冷却后水洗。其他操作流程同常规LSAB法,所不同者为三步抗原孵育和正常血清封闭用微波仪130 W分别辐射5 min,保温2 min即可。实验用已知EGFR、VEGF和 PTEN表达阳性的胃癌组织作为阳性对照,用磷酸盐缓冲液代替一抗作为阴性对照。H2O2-DAB显色。
1.2.2 结果判断 EGFR以细胞质和细胞膜出现棕黄色颗粒为阳性,VEGF以细胞质、PTEN以细胞核呈现棕黄色颗粒为阳性。根据阳性细胞比例分为4级:无阳性细胞为阴性(-);阳性细胞数<25%为弱阳性(+),25%~75%为阳性(++),>75%为强阳性(+++);(+)以上为阳性表达。
1.3 统计学处理
采用χ2检验比较组间阳性率差异。
2 结果
2.1 EGFR、VEGF和 PTEN蛋白在结直肠癌和正常肠黏膜组织中的表达
EGFR、VEGF和 PTEN阳性产物呈棕黄色或棕褐色。EGFR阳性定位于细胞质和细胞膜,结直肠癌组织中其阳性表达率为61.2%(60/98),正常肠黏膜组织中未见阳性表达(0,0/20),差异有显著性(χ2=21.05,P<0.05);VEGF阳性定位于细胞质,结直肠癌组织中其阳性表达率为66.3%(65/98),正常肠黏膜组织中阳性表达率为15.0%(3/20),差异有显著性(χ2=15.90,P<0.05);PTEN阳性定位于细胞核(图3),结直肠癌组织中其阳性表达率为48.0%(47/98),正常肠黏膜组织中其阳性表达率为100.0%(20/20),差异有显著性(χ2=14.72,P<0.05)。
2.2 EGFR、VEGF和 PTEN蛋白表达与结直肠癌临床病理参数的关系
EGFR、VEGF和PTEN蛋白阳性表达与结直肠癌肿瘤部位、大小、分化程度无关(P>0.05),而与结直肠癌Dukes分期、浆膜浸润和淋巴结转移相关(P<0.05),见表1。
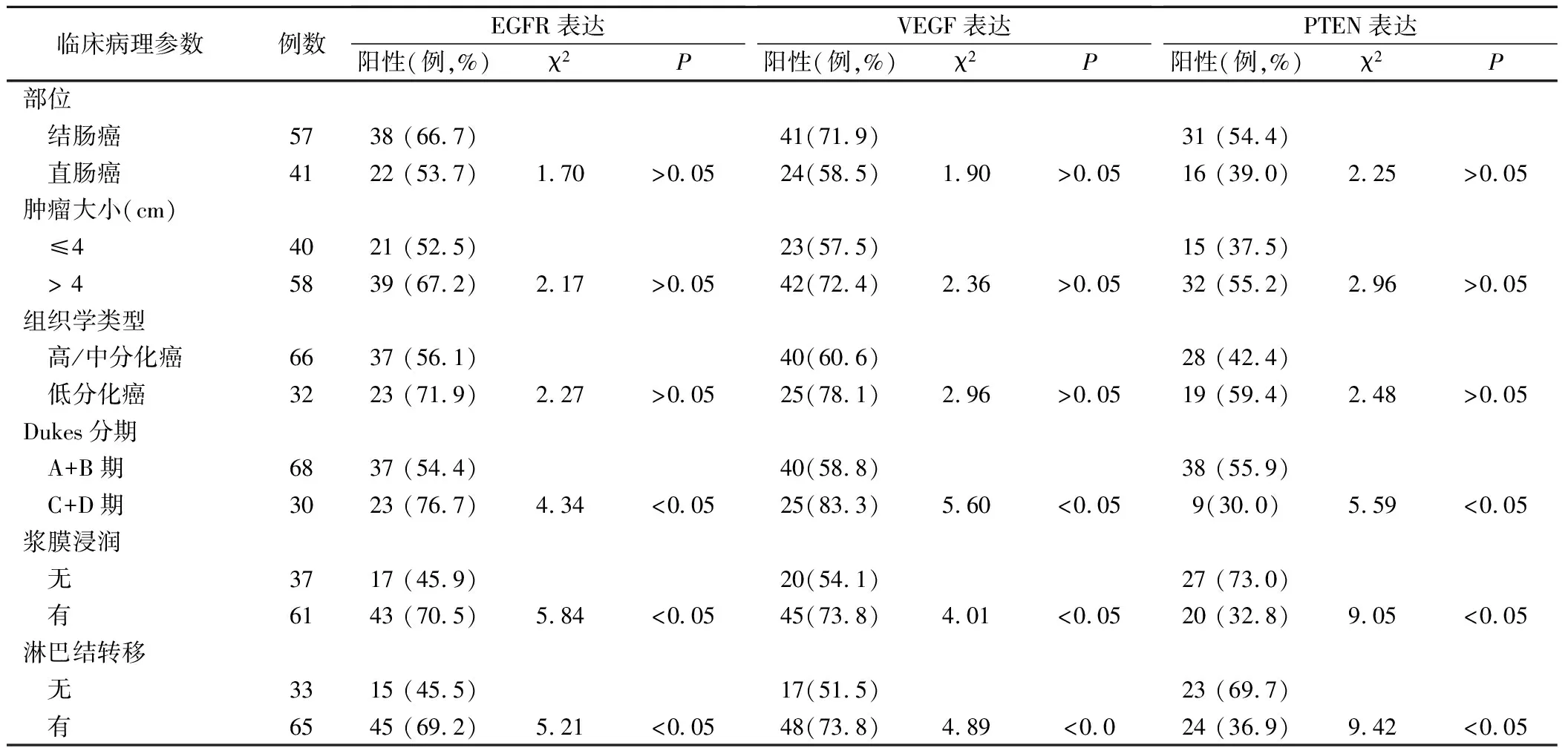
表1 EGFR、VEGF和 PTEN蛋白表达与结直肠癌临床病理参数的关系
2.3 结直肠癌组织中EGFR、VEGF和 PTEN表达间的关系
EGFR表达阳性的60例结直肠癌组织中,VEGF和 PTEN阳性表达例数分别为47例(78.3%)和18例(30.0%);EGFR阴性表达的38例结直肠癌组织中,VEGF和 PTEN阳性表达例数分别为19例(50.0%)和29例(76.3%);EGFR阳性表达的结直肠癌组织中VEGF阳性表达率高于EGFR阴性表达的结直肠癌组织,差异有显著性(χ2=8.36,P<0.05),而PTEN阳性表达率低于EGFR阴性表达的结直肠癌组织,差异有显著性(χ2=19.73,P<0.05);VEGF阳性表达的65例结直肠癌组织中,PTEN阳性表达20例 (30.8%);VEGF阴性表达33例中,PTEN阳性表达27例(81.8%);VEGF表达阳性的结直肠癌组织中PTEN阳性表达率低于VEGF阴性表达的结直肠癌组织,差异有显著性(χ2=22.85,P<0.05)。
3 讨论
EGFR属于酪氨酸激酶Ⅰ型受体家族,其家族成员包括EGFR(HER1)、HER2、HER3、HER4 4种同源受体。EGFR广泛表达于表皮细胞和基质细胞、部分神经胶质细胞和平滑肌细胞,在调节细胞生长和组织修复中起着十分重要作用,其信号系统所引起的细胞效应包括细胞增殖、迁移及黏附等多个环节。EGFR作为1种肿瘤标志具有许多有点,主要表现为EGFR基因在许多上皮来源的肿瘤组织中呈表达或过表达改变,EGFR的高表达可促进肿瘤细胞的增殖、血管生成、黏附、侵袭和转移、抑制肿瘤细胞的凋亡[1,2]。EGFR在颈部鳞癌、乳腺癌、胃癌、肺癌、前列腺癌、肾癌、卵巢癌及膀胱癌等上皮性肿瘤中均有表达及过表达,并与其肿瘤的临床进展、侵袭和转移相关[3,4],它的失调与肿瘤对化疗和放疗的耐受以及不良预后相关,为肿瘤的治疗提供了一个理想的分子靶点[5]。本研究结果显示,在98例结直肠癌组织中EGFR表达阳性率为61.2%,显著高于正常肠黏膜组织,并随着Dukes分期增高、浆膜浸润和淋巴结转移,其表达水平亦随着显著性增高。提示,EGFR表达与结直肠癌的发生、发展、生物学行为和临床进展密切相关,高表达是结直肠癌患者预后不良的标志。
VEGF是迄今所发现的最重要的促血管生成因子,它可通过血管内皮上的受体(VEGFR)介导的受体信号转导通路,促进血管内皮细胞增殖、迁移,阻止血管内皮细胞凋亡和管腔网状结构退化,增加血管渗透性。VEGF在正常成人与动物组织中表达水平较低,但在胎儿及正在进行生理性血管生长的组织中表达水平较高。VEGF在肿瘤中表达水平较高,它可促使肿瘤血管生成,在维持肿瘤的持续生长中起着重要作用,同时也是肿瘤转移的基础[6],因此VEGF表达水平与肿瘤的恶性程度、转移情况、微血管密度等呈正相关,与患者的预后呈负相关。以VEGFR信号转导通路为靶点进行肿瘤靶向治疗已在多种肿瘤中取得了实质性的疗效。本研究结果显示,在98例结直肠癌组织中VEGF表达阳性率为66.3%,显著高于正常肠黏膜组织,并随着Dukes分期增高、浆膜浸润和淋巴结转移,其表达水平亦随着显著性增高。提示,VEGF主要在结直肠癌发生发展、侵袭和转移过程中起着重要作用,临床上检测VEGF表达对预测肿瘤的转移潜能和指导治疗方面具有较大实用价值,是1个预测结直肠癌患者预后的重要生物学参考指标。
PTEN是迄今发现的第1个具有磷酸酶活性的抑癌基因。通过结构预测显示,PTEN与细胞骨架蛋白和张力蛋白高度同源,提示PTNE可能参与细胞骨架重组并影响细胞迁移能力。当PTEN抑癌基因突变或缺失可能构成1个新的信号转导途径,在调节细胞的增生和死亡、细胞的转移和黏连等方面均起重要作用,与人类恶性肿瘤的发生、发展关系密切[7]。PTEN突变或缺失可以促进血管内皮因子的形成,使血管内皮细胞增殖和肿瘤微血管的形成,从而使肿瘤的侵袭转移能力增高[8]。本研究结果显示,PTEN蛋白表达阳性率在结直肠癌中显著低于正常肠黏膜组织,并随着Dukes分期增高、浆膜浸润和淋巴结转移,其表达水平亦随着显著性减低。提示,PTEN的丢失与结直肠癌的发生、细胞恶性转化密切相关,在其肿瘤的转移过程中起着重要的抑制作用,可能是结直肠癌的发生和临床进展过程中的晚期事件。在临床病理活检中,检测其基因蛋白表达有助于深入了解肿瘤的发生发展,并可作为早期诊断、预后判断和评价肿瘤生物学行为的客观指标,尤其对指导临床采用基因治疗提供依据及新思路更具有重要意义。
在恶性肿瘤发生的癌基因研究中,许多学者提出了基因协同作用假说,认为在恶性肿瘤发生、发展和转移的各阶段,至少有2个或2个以上功能不同的异常激活的基因各自发挥不同作用,并在时间和空间上相互配合,协同促进了细胞的癌变。有研究发现在肿瘤的演进过程中,EGFR能通过增加VEGF表达或与其协同作用促进肿瘤内新生血管形成,去除EGFR的作用会阻碍血管的进一步发生[9],而PTEN可通过调节VEGF来抑制肿瘤细胞的运动性和血管形成[10]。本结果显示,在结直肠癌中EGFR和VEGF表达呈正相关,两者表达与PTEN表达呈负相关。表明在结直肠癌的系列病理过程中,EGFR、VEGF与PTEN具有相互协同效应,其机理有待进一步深入探讨。
[1] Tamas P,Solti Z,Bauer P,et al.Mechanism of epiclermal growth factor regulation of Vav2,a guanine nucleotide exchange factor for rac〔J〕.Biol Chem,2003,32(7):378.
[2] 戴春玲,符立梧.靶点药物Cetuxinab(C225)研究新进展〔J〕.生物化学与生物物理进展,2007,34(3):246.
[3] Carneiro A,Isinger A,Karlsson A,et al.Pprognostic impact of array-based genomic profiles in esophageal squamous cell cancer〔J〕.BMC Cancer,2008,11(8):98.
[4] Matkovic B,Juretic A,Separovic V,et al.Immunohistochemical analysis of ER,PR,HER-2,CK5/6,P63 and EGFR antigen expression in Medullary breast cancer〔J〕.Tu-mori,2008,94(6):838.
[5] Gross ME,Shazer RI,Agus DB.Targeting the HER-kinase axis in cancer〔J〕.Sem in Oncol,2004,31(ISupp13):9.
[6] Rmali KA,Puntis MC,Jiang WC.Tumou-associated angiogenesis in human colorectalr〔J〕.Colorectal Dis,2007,9(1):3.
[7] Huang J,Kontos CD.PTEN modulates vascular endothelial growth factorm ediated signaling and angiogenic effects〔J〕.J Biol Chem,2002,277(13):10760.
[8] 王恩华,滕 蕾,王培林.PTEN基因在原发性肝细胞癌中的表达〔J〕.青岛大学医学院学报,2007,43(2):153.
[9] Casanova MI,Larcher F,Casanova B,et al.A critical role for rasmediated epidermal gnwth factor receptor-dependent angiogenesis in mouse skin carcinogenesis〔J〕.Cancer Res,2002,62(12):3402.
[10] Yang I,Kuang LG,Zheng HC,et al.PTEN encoding product a marker for tumorigenesis and progression of gastric carcinoma〔J〕.World J Gastroenterol,2003,9(1):35.
