NF-κB和GM-CSF表达与乳腺癌骨转移相关性的研究
2011-06-07何战洋何萍青应学翔林燕苹王富文
何战洋 何萍青 应学翔 林燕苹 王富文
从世界范围来看,乳腺癌是女性最常见的恶性肿瘤,骨是乳腺癌最常见的转移部位,约65%~70%晚期乳腺癌患者会出现骨转移[1,2]。骨转移患者会出现疼痛、病理性骨折、脊髓压迫等症状,严重影响患者的生活质量。目前尚无简单的方法精准地预测乳腺癌骨转移的发生。乳腺癌骨转移是1个复杂的、非随机的、连续的多步骤的过程,需要特定基因的表达[2],然而其中的很多基因我们仍然不了解[3]。Park采用标准的乳腺癌骨转移动物模型,发现骨转移的乳腺癌细胞内的NF-κB表达活跃,导致GM-CSF水平升高,从而诱导破骨细胞的形成并导致骨质破坏[4],我们就乳腺癌组织中NF-κB、GM-CSF表达与骨转移发生的相关性及其与乳腺癌临床病理指标的相关性,进行回顾性分析。
1 材料与方法
1.1 材料
选取上海市第六人民医院2000年1月~2007年12月间收治的乳腺癌病例,术前均未行化疗、放疗、内分泌治疗,均为乳腺浸润性导管癌(非特殊型),且经病理专家复读确认,骨转移病例均经骨扫描和X线或CT等检查证实,符合标准的有52例乳腺癌骨转移和72例乳腺癌患者,以52例乳腺癌骨转移患者为实验组,72例乳腺癌患者为对照组,经统计学对比两组在年龄、组织学分级、肿瘤临床分期、肿块大小、淋巴结状态等无明显差异,所有患者均为女性,年龄33~76岁,平均年龄53.2岁。病例均获得2年以上随访,随访率为100%。按WHO标准对各病例进行分型和分级,其中组织学分级Ⅰ~Ⅱ级74例,Ⅲ级50例,并按照分子病理分型分为4组:luminal A型、luminal B型、HER-2过表达型、basal-like型,所有标本为病理科石蜡包埋的存档组织块,重新制作4μm连续切片,贴于涂有0.05%多聚赖氨酸的载玻片备用。
1.2 试剂与方法
兔抗人NF-κB p65单克隆抗体为美国cell signaling公司产品,GM-CSF 抗体购自ABCAM 公司,抗体稀释浓度为1∶50。采用柠檬酸钠缓冲液热抗原修复,S-P免疫组织化学法,以已知阳性片作为阳性对照,以PBS代替一抗作为阴性对照。
1.3 结果判断
NF-κB阳性染色定位于细胞核中,GM-CSF阳性染色定位于胞质和胞膜。染色为黄色或棕褐色颗粒。每例均随机观察5个高倍视野(×200)。对每例切片,采用半定量积分法判断结果。阳性细胞数<5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分;阳性染色黄色为1分,棕黄色为2分,棕褐色为3分。两者积分相乘,0分为阴性(-),1~4分为弱阳性(+),5~8分为中度阳性(++),9~12分为强阳性(+++)。
1.4 统计学方法
应用SPSS(16.0 for Windows)软件进行统计学处理。采用χ2检验及Spearman相关分析,以P<0.05判为差异有统计学意义。
2 结果
2.1 NF-κB和GM-CSF表达与乳腺癌骨转移的相关性
52例乳腺癌骨转移组中36例NF-κB阳性,阳性率为69.2%,72例对照组中30例NF-κB阳性,阳性率为41.7%,2组比较差异有统计学意义(P=0.002),见表1。52例乳腺癌骨转移中GM-CSF阳性18例,阳性率为34.6%,36例对照组中GM-CSF阳性46例,阳性率为63.9%,2组比较差异有统计学意义(P=0.001)。
NF-κB阳性表达66例中GM-CSF表达阳性36例,阳性表达率为54.5%,NF-κB阴性表达58例中GM-CSF阳性表达28例,阳性表达率为48.3%,Spearman相关分析两者无明显相关性(P=0.490)。
2.2 NF-κB和GM-CSF表达与乳腺癌分子病理分型的关系

表1 两组中NF-κB和GM-CSF表达情况(例,%)

表2 NF-κB和GM-CSF与乳腺癌分子病理分型的关系(例,%)
由表2 可见,NF-κB与乳腺癌分子病理分型有明显相关性,P=0.000;而GM-CSF与乳腺癌分子病理分型无明显相关性,P=0.991。
2.3 NF-κB和GM-CSF表达与乳腺癌临床病理特征的关系
由表3可见,NF-κB表达与肿块大小有关,3组间有显著性差异(P<0.05); NF-κB表达也与肿瘤临床分期有关,临床分期越高NF-κB阳性表达率越高,两者间有显著性差异(P<0.05);NF-κB表达也与淋巴结转移个数有关,4组间差异有统计学意义(P<0.05);NF-κB表达也与ER状态有关,ER阴性组其阳性表达率明显高于ER阳性组,且差异有统计学意义(P<0.05);NF-κB表达也与HER-2有关,HER-2阳性者NF-κB表达阳性率高于HER-2阴性者,两者间差异有统计学意义(P<0.05)。NF-κB表达与p53有关,p53阳性者NF-κB表达阳性率高于p53阴性者,两者间差异有显著性意义(P<0.05),NF-κB表达与患者年龄、组织学分级、PR状态、KI-67等无明显相关性(P>0.05),然而,GM-CSF表达与乳腺癌临床病理指标均无明显相关性 (P>0.05) 。
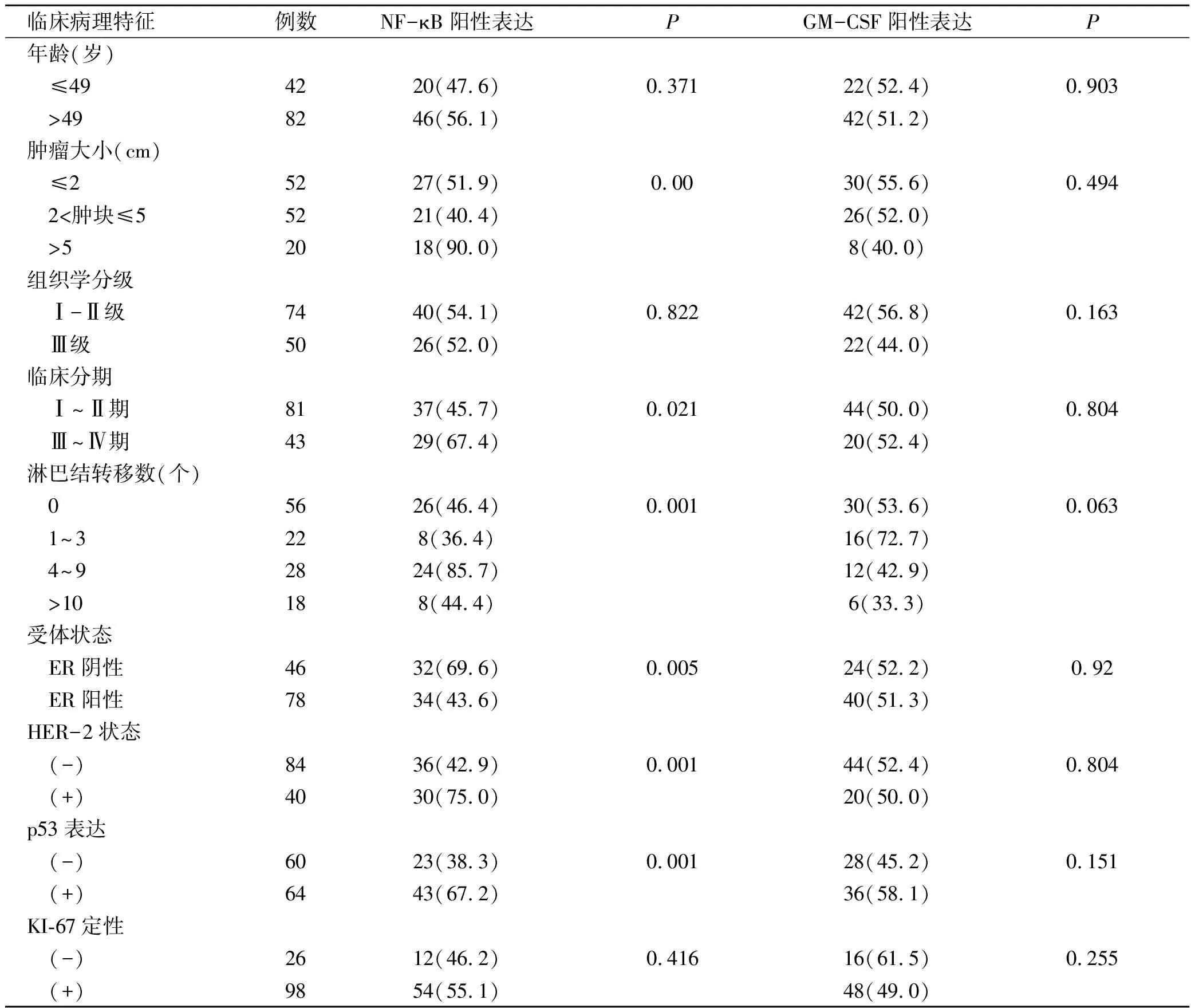
表3 NF-κB和GM-CSF表达与乳腺癌临床病理特征的关系(例,%)
3 讨论
乳腺癌骨转移以溶骨性骨转移最为常见,其中破骨细胞起主要作用,破骨细胞(osteoclast,OC)分化受2个重要细胞因子的调节:单核/巨噬细胞集落刺激因子(monocyte/macrophage-clone stim ulating factor,M-CSF)和核转录因子NF-κB受体激动剂的配体(ligand of recep tor activator of nuclear factor kappaB,RANKL),M-CSF主要维持OC的生长,RANKL则促进OC的定向分化[5]。OC是1种终末分化的多核巨细胞,与单核细胞或巨噬细胞系同来源于骨髓生血前体细胞[6]。Park医生采用标准的乳腺癌骨转移动物模型,发现NF-KB通过GM-CSF促进乳腺癌骨转移的发生[4],这一报道引起很大反响,众所周知粒细胞单核细胞集落刺激因子(granulocyte-monocytecolonystimulatingfactor,GM-CSF)作为恶性肿瘤放化疗辅助药物,可刺激造血前体细胞的增殖和分化,升高白细胞数量。这一结果来自动物模型,而针对乳腺癌骨转移患者的类似研究报道很少。
本研究发现,骨转移组NF-κB阳性表达率高于对照组,且差异有统计学意义,提示NF-κB与乳腺癌骨转移有一定的相关性,与很多动物实验结果相一致。研究表明核转录因子NF-κB是一类重要的转录因子,由p50和p65 2个亚基组成,通常以同源或异源二聚体的非活性形式存在于几乎所有细胞的胞质中,只有被激活后,才从细胞质转位于细胞核发挥重要的作用,活化的NF-κB在肿瘤发生发展中的作用机制与它抗凋亡及促进细胞生长等有关[7],有研究表明NF-κB还可以提高乳腺癌细胞多药耐药基因的表达,使乳腺癌细胞内化疗药物浓度下降而产生抗药性,而有利于乳腺癌转移[8]。
GM-CSF实验组阳性表达率低于对照组,且两组差异有统计学意义,但NF-KB与GM-CSF表达间无明显相关性,也从另一方面提示临床用粒细胞单核细胞集落刺激因子升高白细胞数量作为恶性肿瘤放化疗辅助药物,有一定的安全性。可能与GM-CSF存在多态性和多种受体有关,研究证实GM-CSF至少以3种形式存在于体内,即可溶性(S-M-CSF)、膜结合型(m-M-CSF)和基质结合或糖蛋白型(PG-M-CSF),吴克复等[9]研究表明:①M-CSF 及其受体呈明显的多态性,但是都可被同一单抗识别;②不同部位,不同大小的GM-CSF 及其受体的功能不尽相同; ③病理状态下出现膜结合型的 M-CSF 和可溶性的受体以及与基质结合的蛋白糖,即 M-CSF 及其受体呈多样性,与国外同行报道的一致。也可能因为GM-CSF与骨转移存在剂量效应关系,Yao等[10]研究发现M-CSF能够诱导fos基因的转录,c-fos缺失小鼠不能形成成熟的破骨细胞。M-CSF还可调节骨保护素(OPG)mRNA表达和OPG蛋白分泌,从而影响破骨细胞的活性,这种调节方式具有剂量依赖性,并且在一定条件下是可逆的[11]。相似的研究还有Angela等[12]用小鼠模型研究GM-CSF增强破骨细胞的形成存在剂量效应现象,当GM-CSF的剂量范围从10~15 ng/ml会导致酸性磷酸酶的增加,而且当GM-CSF 50 ng/ml和骨髓巨细胞加入到破骨细胞介导的骨破坏模型中,可发现钙磷酸盐吸收比基础水平明显增加。然而与此相反的是许多临床随机临床试验用GM-CSF支持化疗,并没有发现副作用及促进骨转移的发生,事实上乳腺癌患者用GM-CSF支持剂量密集化疗相对于标准化疗不加用GM-CSF增高了患者的无病生存率[13,14]。
Kadri Altundag研究表明,GM-CSF可诱导血管的形成增加绝经前淋巴结阳性的乳腺癌患者术后对化疗的敏感性,而并没有增加骨转移的风险[15]。Udagawa研究表明,GM-CSF可抑制小鼠破骨细胞的形成从而抑制骨转移的发生[16]。骨转移还存在其他的相关机制,本研究并不能证明GM-CSF与骨转移的直接相关性,NF-κB、GM-CSF与乳腺癌骨转移的相关机制尚需要大量的研究证实。
本实验也发现NF-κB与很多临床病理指标有相关性(临床分期、淋巴结状态、HER-2状态、ER状态等),Sovak等[17]在乳腺癌的研究中发现NF-κB在乳腺癌中高表达,并且随临床分期增高、转移发生愈早,其表达越显著,这与我们的实验结果相一致。本研究还发现ER阴性、HER-2阳性的乳腺癌患者中NF-κB阳性表达率越高,且差异有统计学意义,这与很多研究结果相一致,Harikrishna等[18]研究ER阴性乳腺癌转移生长的分子学机制过程中,证实并提出了NF-κB在ER阴性乳腺癌细胞中的高水平表达,且这种表达是由于部分功能性ER缺乏的结果,并证实了这种高表达尤其是在组织分化差且伴有淋巴结转移的浸润性导管癌中表达更为显著。有很多的研究结果支持NF-κB在乳腺癌中的抗凋亡作用,而且这种作用与乳腺癌ER和原癌基因HER-2的表达状态相关[19,20]阴性、HER -2阳性的人乳腺癌细胞系中,免疫荧光法显示p65的核表达率为86%,HER-2过表达时的抗凋亡通过调节NF-κB的活性并诱导Bcl-2的表达[21],但Patricia等[22]提出了不同见解,ER状态与NF-κB的活化水平在乳腺癌中并无明显相关性。体外实验已证实人类表皮生长因子受体家族的2个重要成员EGFR和HER-2可以活化PI3K-AKT激酶途径使转录加快,且活化的Akt/NF-KB抗凋亡级联效应使癌细胞能抵抗凋亡,降低机体抗肿瘤的能力[23,24]。
本研究结果提示,NF-κB蛋白质阳性表达,且有高转移风险如临床分期晚、腋窝淋巴结已发生转移、ER阴性表达、HER-2阳性表达的乳腺癌患者,应加强术后随访,密切追踪,一般宜在6个月左右行骨显像,对有骨局部症状和(或)骨显像见可疑病灶者应在更短时间内复查。对骨转移风险相对较小的乳腺癌患者术后亦应常规定期行骨显像。
针对乳腺癌患者肿块内NF-κB、GM-CSF 2个指标与乳腺癌骨转移的相关性的回顾性研究很少,本实验应用免疫组织化学方法(尤其半定量分析),主观因素,界值标准、样本量大小、随访时间长短、腋窝淋巴结隐匿转移灶的存在、以及部分生物学标记因子在癌组织中表达不均一性等均在一定程度上影响结果分析,骨放射性核素扫描仍将在乳腺癌骨转移中发挥重要作用[25],随着分子生物学技术的进步,对乳腺癌骨转移的细胞分子水平的机制会有更进一步的了解,从而可以进一步找到新的药物标靶,开发出相应的治疗药物,给乳腺癌及其骨转移的治疗带来更广阔的前景。也许在不久的将来这些基因能精准预测乳腺癌骨转移的发生,甚至成为乳腺癌骨转移治疗的靶点。
[1] Coleman RE.Skeletal complications of malignancy〔J〕.Ca-ncer,1997,80:1588.
[2] Kominsky SL,Davidson NE.A "bone" fide predictor of metastasis? Predicting bre-ast cancer metastasis to bone〔J〕.Clin Oncol,2006,24:2227.
[3] Smid M,Wang Y,Klijn JG,et al.Genes associated with b-reast cancer metastatic to bone〔J〕.Clin Oncol,2006,24:2261.
[4] Park B K,Zhang H,Zeng Q,et al.NF kappaB in breast ca-ncer ceils promotes osteol- ytic bonem etastasis by inducing osteoclastogenesis via GM-CSF〔J〕.Nat Med,2007,13(1):62.
[5] Yasuda H,Shima N,Nakagawa N,et al.O steoclast differentiation factor is a ligand for osteoprotegerin/osteoclastogenesis-inhibitory factor and is identical to TRAN- CE/RANKL〔J〕.Proc Natl Acad Sci USA,1998,95(7):3597.
[6] Roodman G D.Cell biology of t he osteoclast〔J〕.J Exp Hematol,1999,27:1229.
[7] Chen F,Castranova V,Shi X.New insights into the role of nuclear factor-kappaB in Cell Growth Regulation〔J〕.Am J Pathol,2001,159(2):387.
[8] Zhou G,Kuo MT.NF-kB-mediated induction of expression by insulin in rat Hepato- ma cells〔J〕.J Biol Chem,1997,272(24):15174.
[9] 王 昕,吴克复.巨噬细胞集落刺激因子及其受体的研究进展〔J〕.国外医学·输血与血液学分册,1996,192:272.
[10] Yao GQ,Itokawa T,Paliwal I,et al.CSF-1 induces fos gene transcription and activates the transcription factor Elk- 1 in mature osteoclasts〔J〕.Calcif Tissue Int,2005,76 (5) :371.
[11] Yamada N,Tsujimura T,Ueda H,et al.Down-regulation of osteoprotegerin production in bonemarrow macrophages bymacrophage colony stimulating factor 〔J〕.Cytokine,2005,31 4 :288.
[12] Hirbe AC,Uluckan O,Morgan EA,et al.Granulocyte colony-stimulating factor enhances bone tumor growth in mice in an osteoclast-dependent manner〔J〕.Blood,2007,109(8):3424.
[13] Orzano JA,Swain SM.Concepts and clinical trials of dose-dense chemotherapy for breast cancer〔J〕.Clin Breast Cancer,2005,6:402.
[14] Citron ML,Berry DA,Cirrincione C,et al.Randomized trial of dose-dense versus conventionally scheduled and sequential versus concurrent combination chemotherapy as postoperative adjuvant treatment of node-positive primary breast cancer:first report of Intergroup Trial C9741/Cancer and Leukemia Group B Trial 9741〔J〕.Clin Oncol,2003,21:1431.
[15] Kadri Altundag email,Ozden Altundag.Addition of granulocyte-colony stimulating factor (G-CSF) may further increase chemosensitive state in premenopausal node-positive breast cancer patients with induced angiogenesis after surgery〔J〕.Breast Cancer Res,2004,6(4):E14.
[16] Udagawa,N,Horwood NJ,Elliott J,et al.Interleukin-18(interferon-gamma-inducing factor) is produced by osteoblasts and acts via granulocyte/macrophage colony-stimulating factor and not via interferon-gamma to inhibit osteoclast formation〔J〕.Exp Med,1997,185:1005.
[17] Sovak MA,Bellas RE,Kim DW,et al.Aberrant nuclear factor-KB/Relexpression and the pathogenesis of breast cancer〔J〕.Clin Invest,1997,100(12):2952.
[18] Nakshatri H,Bhat-Nakshatri P,Martin DA,et al.Constitutive activation 0f NF- kB during progression of breast cancer to hormone-independent growth〔J〕.Mol and Cell Bio,1997,17(7):3629.
[19] Biswas DK,Shi Q,Baily S,et al.NF-kappa B activation in human breast cancer speciments and its role in cell proliferation and apoptosis〔J〕.Proc Natl Acad Sci,2004,101(27):10137.
[20] Hou MF,Lin SB,Yuan SS,et al.The clinical significance between activation of nuclear factor kappa B transcription factor and overexpression of HER-2/neu oncoprotein in Taiwanese patients with breast cancer〔J〕.Clin Chim Acta,2003,334(1~2):137.
[21] Romieu-Mourez R,Landesman-Bollag E,David C,et al.Protein kinase CK2 promo-tes aberrant activation of nuclear factor-kB,transformed phenotype,and survuval of breast cancer cells〔J〕.Cancer Research,2002,62(8):6770.
[22] Cogswell PC,Guttridge DC,Funkhouser W K,et al.Selective activation of NF-kB subunits in human breast cancer:potential role for NF-kB/p52 and for Bcl-3〔J〕.Oncogene,2000,19(9):1123.
[23] Das R,Mahbaelshwra G H,Kundu G C.Osteopontin timulates cell motility and nuclera factor kappaB-mediated secretion of urokinase type plsaminogen activator through phosphatidylinositol 3-kinsae/Akt singaling pathways in bresat cancer cells〔J〕.Jbiol Chem,2003,278(31) :28593.
[24] Zhou BP,Hu MC,Miller SA,et al.HER-2/neublcoks umornecorsis factor- induced apoptosis via the Akt/NF-kappaB athway〔J〕.Jbiol Chem,2000,275(11) :8027.
[25] Bombardieri E,Marfinetti A,Miceli R,et al.Can bone metabolism markers be adopted as an alternative to scinfigraphic imaging in monitoring bone metastases from breast cancer? 〔J〕.Eur J Nucl Med,1997,24:1349.
