LiODFB-LiPF6基电解液与活性炭电极的相容性研究
2011-06-01李凡群张治安赖延清
刘 萍,李凡群,李 劼,卢 海,张治安,赖延清
(中南大学 冶金科学与工程学院,湖南 长沙,410083)
超级电容器[1-2]由于具有功率密度高、大电流充放电能力强、循环寿命长、污染少等优点,在信息产业、交通运输、消费电子、国防军工等众多领域得到广泛应用。目前,应用于超级电容器上最为成熟的电极材料为活性炭(AC)[3-4],电解质盐主要是季铵盐(如TEABF4等)[5-6],而锂盐电解质较少在超级电容器上与活性炭电极匹配应用[7-8]。这主要是由于使用单一锂盐总存在一些不可避免的缺点,因此,人们考虑将不同性质、不同结构的锂盐进行复合,以实现不同锂盐之间的优势互补,使复合盐电解质体现出一些单纯电解质所不具备的优异性能。2005年起有研究者便对这种复合锂盐进行研究,并取得一定成果[9-10]。在此,本文作者采用二氟草酸硼酸锂(LiODFB,分子式为LiBC2O4F2)[11-12]中引入六氟磷酸锂(LiPF6)的方式构造复合锂盐,以EC+PC+DMC(体积比为1: 1: 3)作溶剂,配置各种不同组分结构的 LiODFB-LiPF6复合盐电解液,在超级电容器体系中,系统研究 LiODFB-LiPF6复合盐电解液与AC电极材料的相容性规律。
1 实验
1.1 LiODFB-LiPF6复合盐电解液的配制及电导率的测试
实验共配制4种电解液,分别编号为1~4。电解质盐的浓度如表1所示。所用溶剂均为EC+PC+ DMC体系,体积比为1:1:3。
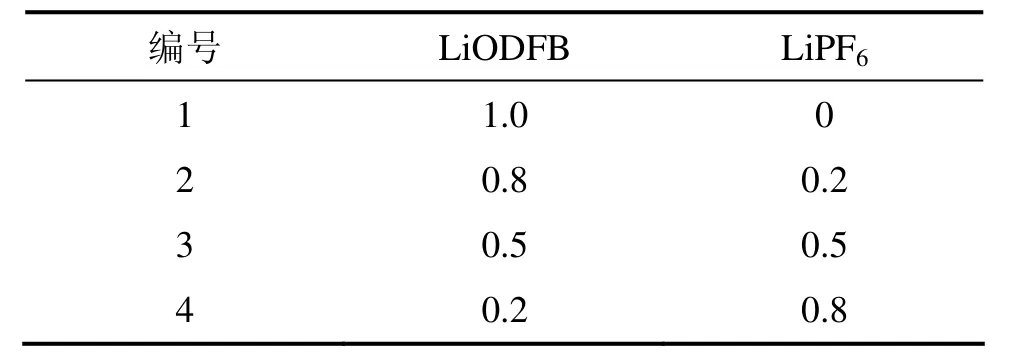
表1 实验配制电解液成分浓度Table1 Component concentration of electrolytes mol/L
采用 SG3电导率仪(瑞士梅特勒-托利多产)对所配制的各类电解液电导率进行测试,测试温度为0~40℃,每隔5 ℃记录1次数据。
1.2 AC超级电容器的组装与电化学性能测试
实验分别以AC材料做正负极,以电容器纸做隔膜,依据AC/隔膜/AC的顺序卷绕并封装成5F圆柱型铝壳超级电容器。电解液为采用上述实验配制的4种电解液。
采用LAND电池测试系统(武汉金诺产)对所制备的电容器进行充放电及内阻测试,充放电电位窗口为0~2.5 V。采用 IM6电化学综合测试系统(德国ZAHNER产)对电容器进行循环伏安和交流阻抗性能测试,循环伏安电压扫描范围为0~2.5V,交流阻抗扫描频率范围为20 mHz至100 kHz,正弦波波动信号电压为5 mV。
2 结果与讨论
2.1 复合盐组成对电解液电导率的影响
图 1所示为不同组分的LiODFB-LiPF6复合盐电解液电导率随温度的变化曲线,图2所示为常温下电解液电导率随LiPF6的浓度的变化曲线。
从图1可以看到:在0~40 ℃范围内,各类复合盐电解液电导率均随温度的升高而呈直线上升;此外,在保持电解液中Li+浓度恒定为1.0 mol/L的前提下,随着LiPF6浓度的增加,电解液电导率亦呈直线上升,两者关系符合阿伦尼乌斯方程(如图 2所示)。当LiODFB与LiPF6的浓度比为1:4时,电解液电导率达到最大,常温(25 ℃)下为11.2 mS·cm-1。这可能是由于ODFB-为有机基团离子,体积较大,在富含介电常数较高的溶剂(DMC)体系内与Li+不易分离,因此,纯LiODFB盐电解液体系电导率较低;而复合盐电解液电导率的提高主要受益于离解度大的 LiPF6的作用,LiPF6浓度越大,对电导率的贡献越大,电解液导电性越好。
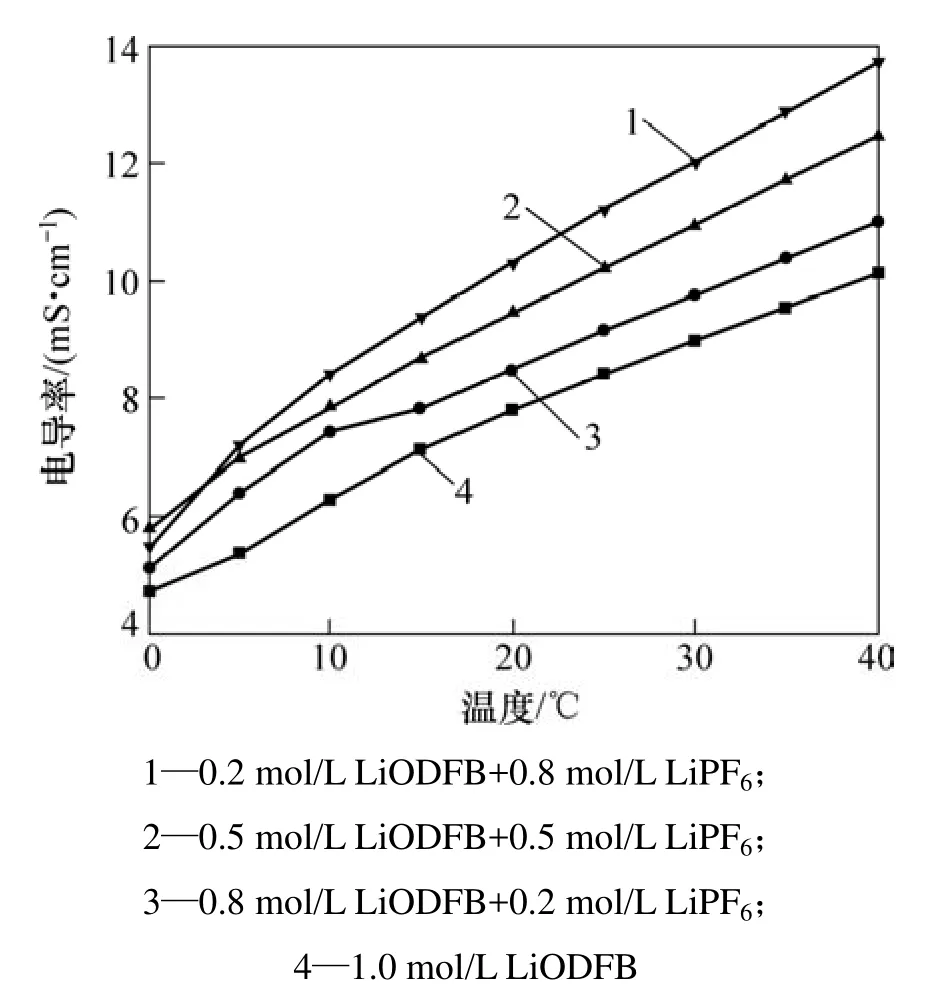
图1 LiODFB-LiPF6复合盐电解液电导率随温度的变化曲线Fig.1 Conductivity of different composite salts electrolyte at different temperatures
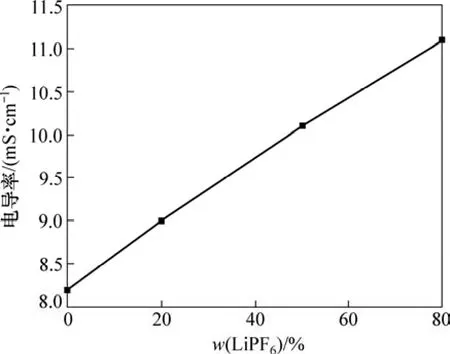
图2 常温(25 )℃下复合盐电解液电导率随LiPF6质量分数的变化曲线Fig.2 Conductivity of composite salts electrolyte at different LiPF6 mass fraction at 25 ℃
2.2 恒流充放电性能
将组装好的 AC超级电容器进行恒流充放电测试,结果如图3所示。由图3可以看到:4种复合盐电解液体系下的AC电容器的充放电曲线保持较为对称的三角形结构,即电压随时间变化接近线性关系,说明这4类复合盐电解液与AC材料有着良好的相容性,能够保证较好的双电层储能行为。然而,随着LiPF6浓度的增加,这种线性对称关系开始逐渐偏离,LiPF6浓度越高,线性偏离越大。这可能是由于 LiPF6的存在使电容器产生了电极极化。可见:在所采用的三元溶剂体系下,LiPF6虽可以增大电解液的电导率,但是,影响到电容器的双电层电容特性的发挥,所以,其浓度不宜过大。
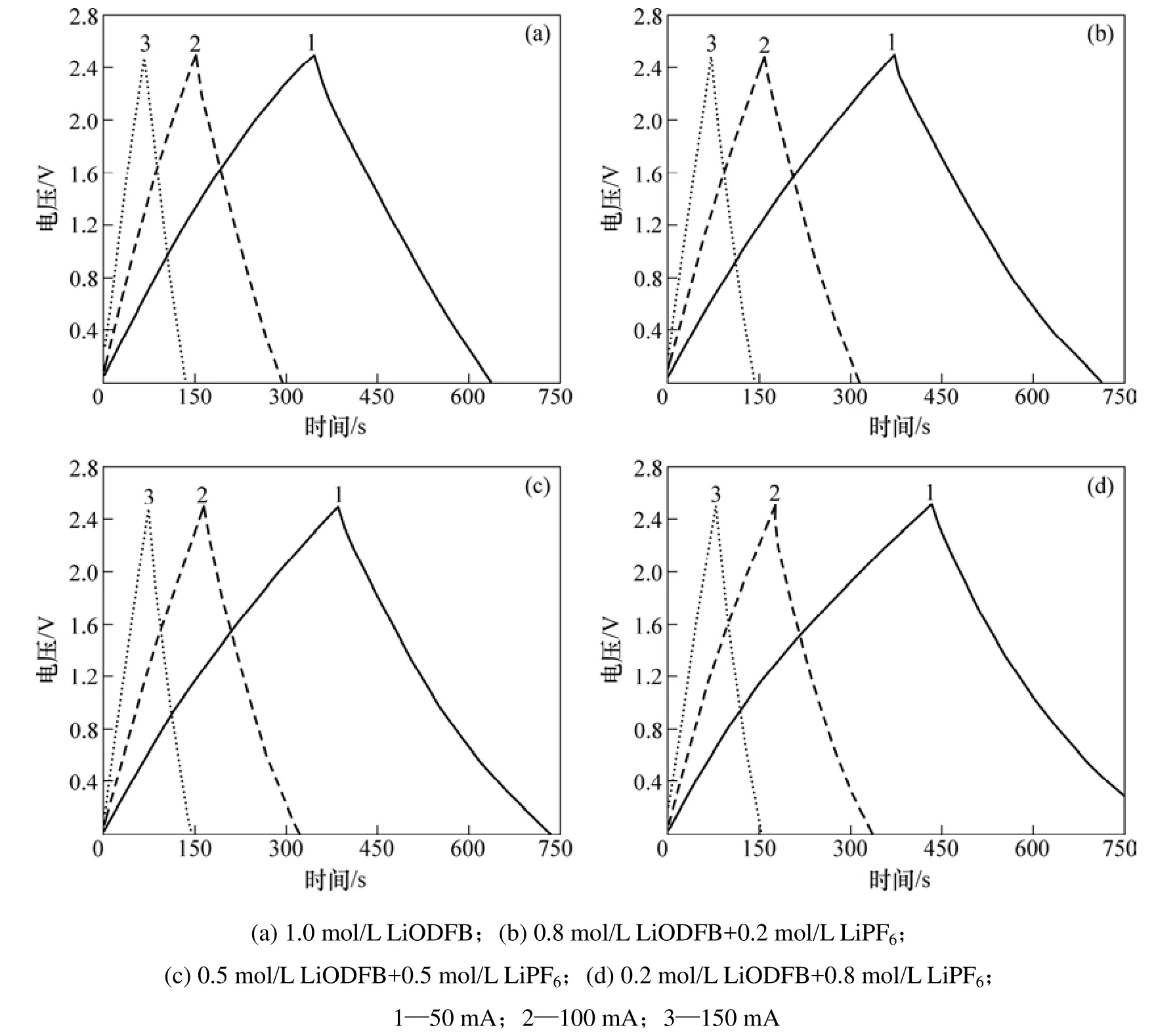
图3 AC超级电容器在不同LiODFB-LiPF6复合盐电解液中的充放电曲线Fig.3 Charge-discharge profiles of AC based capacitor with different composite salts electrolyte
2.3 循环伏安性能
图4 所示为AC超级电容器在不同LiODFB- LiPF6复合盐电解液中的循环伏安曲线。从图4可以看出:在0~2.5 V的扫描范围内,4种复合盐电解液体系下AC电容器的循环伏安曲线都出现了类矩形的特征;同时,随着扫描速度的倍增,对应的响应电流也成倍增大,这反映了电容器较好的功率特性和电化学可逆性。然而,随着 LiPF6浓度的增加,曲线的类矩形特征开始逐渐模糊,LiPF6浓度越大,曲线偏离矩形的程度也越大,特别是当LiPF6的浓度达到0.8 mol/L时,电容器在电压为1.5 V左右出现了明显极化现象,说明浓度过高的 LiPF6对电容器的电容特性发挥不利,这与恒流充放电性能测试结果一致。
2.4 循环性能
图 5所示为在不同LiODFB-LiPF6复合盐电解液体系下,AC超级电容器进行1 500次循环的容量衰减曲线图。从图5可以看到:在不同组分结构的LiODFBLiPF6复合盐电解液中,AC电容器容量都高于设计容量5 F,1 500次循环后的容量仍保持良好。这表明复合盐电解液都能够支持双电层电容有效、稳定形成。通过进一步对比发现:在电解液中加入少量的 LiPF6可有效增加电容量,当LiPF6浓度为0.2 mol/L时,电容器容量达到最大值,高于纯LiODFB盐电解液体系下的电容器容量,经1 500次循环后,容量保持率超过96%;而进一步增加LiPF6浓度(0.5和0.8 mol/L),虽然电解液电导率随之增大,但对应的电容器容量呈下降趋势。这表明在ODFB-和双离子体系中,形成双电层电容的过程不仅包括,ODFB-和 Li+的简单迁移,同时,也可能存在着溶剂化离子的解离与缔合、离子与离子以及多元溶剂之间的反应等复杂过程,从而使电解液中离子的迁移行为变得复杂,其难易程度不仅仅取决于电解液电导率本身。对于该现象产生的原因还有待进一步研究。
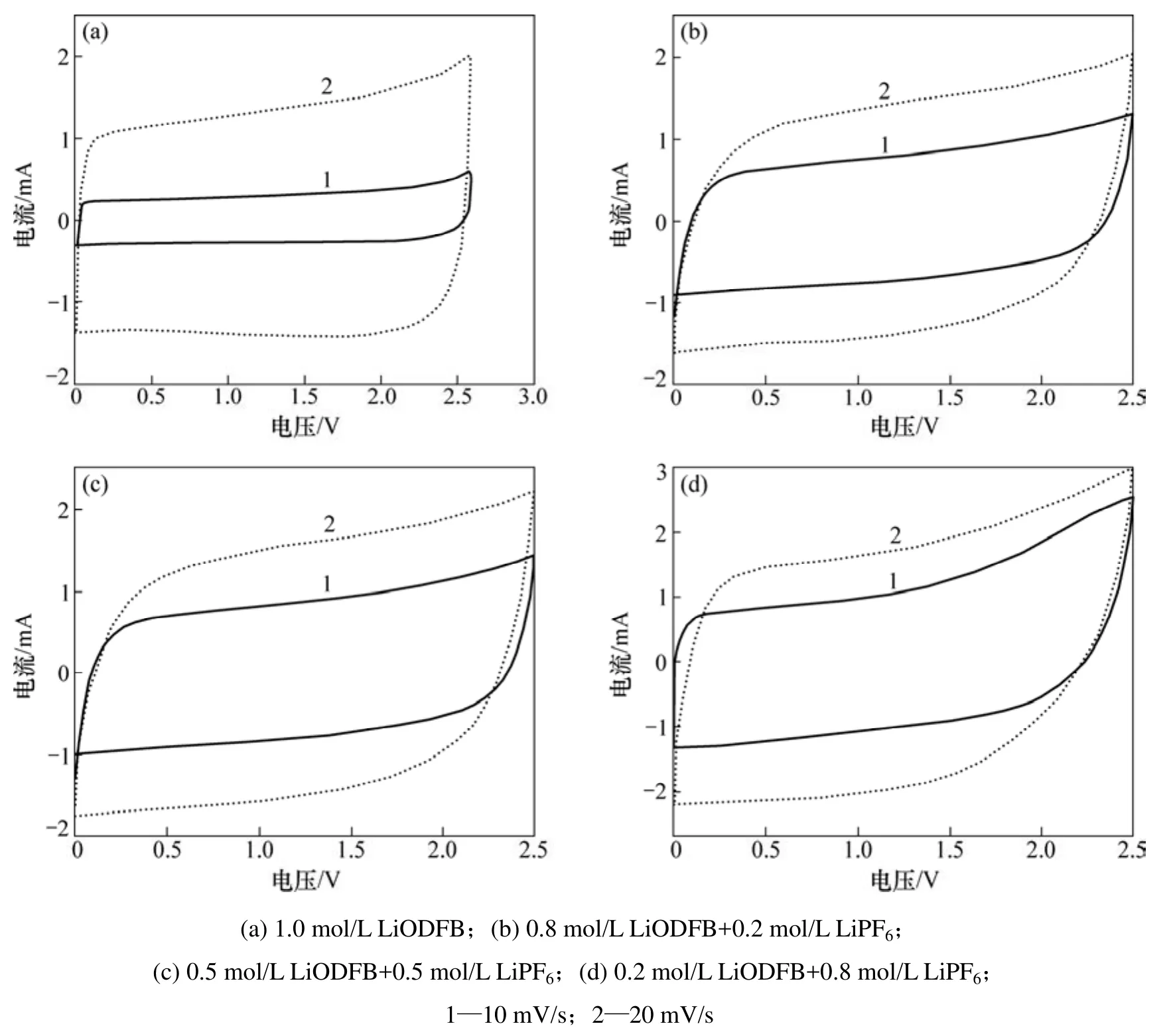
图4 AC超级电容器在不同LiODFB-LiPF6复合盐电解液中的循环伏安曲线Fig.4 Cyclic voltammograms of AC based capacitors with different composite salts electrolytes
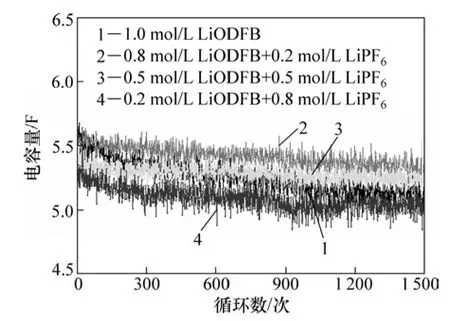
图5 AC超级电容器放电容量随循环次数的变化曲线Fig.5 Cycle life curves of AC based capacitors with different composite salts electrolytes
2.5 内阻变化分析
图6 所示为AC超级电容器的内阻随循环次数的变化曲线。从图4可以看到:在1 500次反复充放电循环中,各类电容器内阻都基本保持不变。这表明LiODFB-LiPF6复合盐电解液与AC电极材料之间具有良好的化学和电化学稳定性。
2.6 交流阻抗特性
图7所示为AC超级电容器在不同复合锂盐电解液中的交流阻抗图谱(其中:Z′和Z″分别为交流阻抗的实部和虚部)。从图7可以看出:在高频区,主要表征电解液电阻的不规则半圆随着LiODFB浓度的增加呈逐渐减小的趋势,这与电导率测试结果相一致;而在低频区,不同复合盐电解液体系下的AC电容器都近似出现了反映理想电容特征的阻抗垂线。
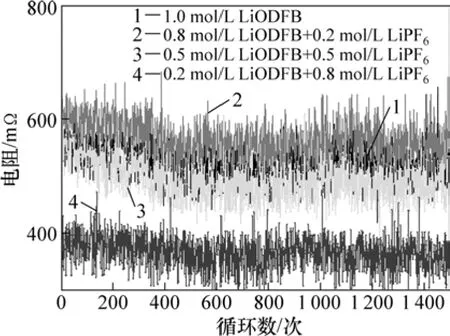
图6 AC超级电容器内阻随循环次数的变化曲线Fig.6 Internal resistance curves of AC based capacitors with different composite salts electrolytes
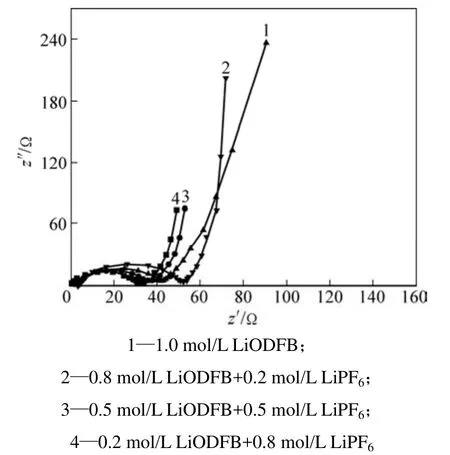
图7 AC超级电容器在不同LiODFB-LiPF6复合盐电解液中的交流阻抗图Fig.7 EIS curves of AC based capacitor with different composite salts electrolytes
3 结论
(1) 加入LiPF6能显著提高LiODFB基电解液的电导率,并且LiPF6浓度越大,电解液电导率越高。
(2) LiODFB-LiPF6复合盐电解液与AC电极材料有着较好的相容性,但 LiPF6浓度过大不利于电容器的双电层电容特性的发挥。
(3) 在电解液中加入少量的 LiPF6可有效增加电容量,当LiPF6浓度为0.2 mol/L时,电容器容量达到最大值,比不添加LiPF6的纯LiODFB盐电解液容量高;1 500次循环的容量保持率超过96%。
[1] LI Jun, WANG Xian-you, HUANG Qing-hua, et al. Studies on preparation and performances of carbon aerogel electrodes for the application of supercapacitor[J]. Journal of Power Sources,2006, 158(1): 784-788.
[2] Portet C, Taberna P L, Simon P, et al. High power density electrodes for carbon supercapacitor applications[J].Electrochimica Acta, 2005, 50(20): 4174-4181.
[3] LI Qing-yu, LI Ze-sheng, LIN Lin, et al. Facile synthesis of activated carbon/carbon nanotubes compound for supercapacitor application[J]. Chemical Engineering Journal, 2010, 156(2):500-504.
[4] Centeno T A, Stoeckli F. The role of textural characteristics and oxygen-containing surface groups in the supercapacitor performances of activated carbons[J]. Electrochimica Acta, 2006,52(2): 560-566.
[5] Ruch P W, Kötz R, Wokaun A. Electrochemical characterization of single-walled carbon nanotubes for electrochemical double layer capacitors using non-aqueous electrolyte[J]. Electrochimica Acta, 2009, 54(19): 4451-4458.
[6] Ryu K S, Kim K M, Park N G, et al. Symmetric redox supercapacitor with conducting polyaniline electrodes[J]. Journal of Power Sources, 2002, 103(2): 305-309.
[7] ZHOU Shao-yun, LI Xin-hai, WANG Zhi-xing,et al. Effect of activated carbon and electrolyte on properties of supercapacitor[J]. Transactions of Nonferrous Metals Society of China, 2007, 17(6): 1328-1333.
[8] LIU Gui-yang, KANG Fei-yu, LI Bao-hua, et al.Characterization of the porous carbon prepared by using halloysite as template and its application to EDLC[J]. Journal of Physics and Chemistry of Solids, 2006, 67(5/6): 1186-1189.
[9] Shieh D T, Hsieh P H, Yang M H. Effect of mixed LiBOB and LiPF6salts on electrochemical and thermal properties in LiMn2O4batteries[J]. Journal of Power Sources, 2007, 174(2):663-667.
[10] Chen Z H, Lu W Q, Liu J, et al. LiPF6/LiBOB blend salt electrolyte for high-power lithium-ion batteries[J].Electrochimica Acta, 2006, 51(16): 3322-3326.
[11] Zhang S S. An unique lithium salt for the improved electrolyte of lithium-ion battery[J]. Electrochemistry Communications, 2006,8(9): 1423-1428.
[12] Zhang S S. Electrochemical study of the formation of a solid electrolyte interface on graphite in a LiBC2O4F2-based electrolyte[J]. Journal of Power Source, 2007, 163(2): 713-718.
