空肠弯曲菌peb1A基因的克隆表达及免疫原性分析*
2011-05-31祝长青唐泰山姚火春张常印
祝长青,唐泰山,王 婷,蒋 原,姚火春,张常印,薛 峰,栾 军
(1.江苏出入境检验检疫局,江苏南京 210001;2.南京农业大学动物医学院,江苏南京 210095;3.河南科技大学动物科技学院,河南洛阳 471003)
空肠弯曲菌peb1A基因的克隆表达及免疫原性分析*
祝长青1,2,唐泰山1,2,王 婷3,蒋 原1,姚火春2*,张常印1,薛 峰1,栾 军1
(1.江苏出入境检验检疫局,江苏南京 210001;2.南京农业大学动物医学院,江苏南京 210095;3.河南科技大学动物科技学院,河南洛阳 471003)
根据空肠弯曲菌基因序列设计引物,以菌株ATCC 29428为模板扩增出peb1A基因片段,定向克隆至pMD18-T载体中,并对克隆片段测序,比较所测序列与不同来源弯曲菌的同源性;用软件改造并合成peb1A基因78 bp~780 bp区间片段,PCR扩增后,构建出表达载体pET-28a(+)-peb1Ag,转化至E.coliBL21(DE3)后诱导表达,纯化后获得重组蛋白PEB1;将其进行Western blot分析、小鼠免疫试验。结果表明,克隆的peb1A基因序列与报道的NCTC 11168核苷酸同源性为98.1%,改造表达后的重组蛋白PEB1具有良好的抗原性和免疫原性,免疫小鼠后血清效价达1∶12 800,为空肠弯曲菌保护性抗原的研究和单克隆抗体的筛选奠定了基础。
空肠弯曲菌;peb1A;原核表达;免疫原性
*通讯作者
空肠弯曲菌(Campylobacter jej uni)是一种在世界范围广泛流行的常见人畜共患病原菌,不但大量存在于各种野生或家养动物的肠道内引起多种畜禽疾病,还能导致人类食源性疾病和格林-巴利综合症。在世界各国细菌性食物中毒中,由于空肠弯曲菌所导致的食物中毒常居前列,世界卫生组织(WHO)已将该病列为最常见、最重要的食源性疾病。在英国、美国等发达国家由空肠弯曲菌所导致的腹泻病例超过了沙门菌而列为首位[1]。空肠弯曲菌的抗原结构比较复杂,具有广泛的抗原多样性或差异性,目前已知有近60个血清型,且还有增加的趋势。空肠弯曲菌的菌体外膜上的抗原成分主要为蛋白质和脂多糖(O抗原)及鞭毛(H抗原)[2]。黏附蛋白PEB1是营养素ABC转运系统的一个主要接合成分,存在于所有空肠弯曲菌的表面,由peb1A基因编码,在各个菌株中具有相对的保守性。大量研究表明PEB1直接参与空肠弯曲菌的黏附入侵过程,在致病过程中起着至关重要的作用,是该菌侵袭肠道的重要致病因子。PEB1在空肠弯曲菌感染时可产生一定程度的免疫力,在大约80%的空肠弯曲菌感染病人恢复期可检测到抗PEB1抗体。在动物模型中,PEB1的A位点加强空肠弯曲菌对肠上皮细胞大肠埃希菌的黏附和侵袭,并促进了定植;而灭活PEB1的A位点则能够显著地削弱空肠弯曲菌的黏附力[3]。从空肠弯曲菌菌体中直接提取蛋白纯品较为困难和繁杂,在实际工作中难以被应用,而基因工程技术则为此提供了有利途径。本试验根据已经发表的NCTC 11168(Pen2血清型)[4]的基因序列,对peb1A基因进行了克隆、改造、表达,并分析了表达蛋白的免疫原性。
1材料与方法
1.1 材料
空肠弯曲菌 ATCC 29428、大肠埃希菌BL21(DE3)、pET-28a(+),由本课题组保存;CR系小鼠购自南京军区总医院实验动物中心,约10周龄,体重25 g~30 g;pMD18-T载体为宝生物工程(大连)有限公司产品,异丙基-β-D-硫代吡喃半乳糖苷(isopropyl β-D-1-thiogalactopyranoside,IPTG)和弗氏完全佐剂为Sigma公司产品;His Bind纯化试剂盒为Novagen公司产品;引物由宝生物工程(大连)有限公司合成。
1.2 方法
1.2.1 peb1A基因的PCR扩增、克隆和分析 根据GenBank公布的空肠弯曲菌NCTC 11168(Pen2血清型)中peb1A基因序列,设计上游引物:5'-AT-GGTT TT TAGAAAATCT TTG-3',下 游 引 物:5'-TTATA AACCCCAT-TT TT TCG-3',扩增片段长度为780 bp。
扩增参数为:94℃预变性5 min;94℃30s,55℃60 s,72℃60s,共40个循环;72℃最终延伸7 min。PCR产物用10 g/L琼脂糖凝胶电泳后,回收目的条带,连接到pMD18-T载体。参照文献[5]的方法进行制备DH 5α感受态细胞,连接物转化后筛选到阳性质粒pMD18-T-peb1A,用PCR和EcoRⅠ和BamHⅠ双酶切方法鉴定后送宝生物工程(大连)有限公司测序。用 DNA Star软件将测序结果与 NCTC 11168及其他已知弯曲菌的peb1A基因序列进行同源性比较分析。
1.2.2 peb1A基因的改造和扩增 由于空肠弯曲菌peb1A的(G+C)%含量低(31.5%),且与原核表达体系E.coli密码子兼并性较差,根据 NCTC 11168的基因序列和测序结果,利用Vector NTI软件对peb1A基因78 bp~780 bp区间片段进行改造,改造后peb1Ag基因组与原基因组的基因同源性为76.5%,(G+C)%含量为48.7%,氨基酸序列不变,委托宝生物工程(大连)公司合成。根据改造的peb1Ag基因序列,设计出上游引物:5'-GGATCCATGGT TT TTAGAAA-3', 下 游 引 物 :5'-CGCCAT TATAAACCCCAT T-3',扩增片段大小为708 bp。采用50 μL反应体系:10×反应缓冲液5μL,25 mmol/L MgCl21μL,20 μ mol/L 的引物各 1 μL,2.5 mmol/L dNTPs 1 μL,Taq酶 0.3 μL,DNA 模板 2 μL,用ddH2O 补足至50 μL。PCR 循环参数为:94℃预变性5 min,94℃60 s,58℃60 s,72℃60 s,40个循环;72℃延伸7 min。
1.2.3 peb1A重组表达质粒的构建与鉴定 PCR产物用琼脂糖凝胶电泳后,目的条带回收后EcoR I和BamH I双酶切,与重组载体pET-28a(+)连接。转化至E.coliBL21(DE3)中,筛选到阳性表达质粒pET28a(+)-peb1Ag,用PCR 和EcoR I和BamH I双酶切方法鉴定,并送宝生物工程(大连)有限公司测序。
1.2.4 重组蛋白的表达和纯化 含pET28a(+)-peb1Ag的E.coliBL21(DE3)于LB培养基中培养至对数生长期(A600 nm为0.6~0.8),加入IPTG至1 mmol/L,诱导4 h后离心,菌体沉淀用PBS溶液重悬,超声裂解后离心,沉淀用6 mol/L尿素溶液溶解,离心,上清用 0.45 μ m 微孔滤膜过滤后,用 His Bind纯化试剂盒纯化重组蛋白。分别收集诱导前后菌液、超声裂解离心后的上清和沉淀以及His柱纯化的蛋白,用120 g/L聚丙烯酰胺凝胶电泳(SDSPAGE)电泳分析。
1.2.5 Western blot His柱纯化的重组蛋白经120 g/L SDS-PAGE电泳后,凝胶用伯乐半干转印仪电转印至PVNF膜。将转印后的PVNF膜用10 mL/L牛血清白蛋白封闭,加入1∶100稀释的鼠抗空肠弯曲菌阳性血清,37℃作用1.5 h后洗膜;加入1∶10 000稀释的辣根过氧化物酶(H RP)标记的兔抗鼠IgG,37℃作用1 h后洗膜;用3,3-二氨基联苯胺(DAB)显色 5 min。
1.2.6 小鼠免疫试验 纯化的重组蛋白PEB1用PBS溶液稀释至400 μg/mL,加入等量的弗氏完全佐剂乳化,背部皮下皮下注射ICR系小鼠,0.2 mL/只,共10只,每2周加强免疫 1次,共加强免疫2次,设立E.coliBL21(DE3)-pET28a(+)-peb1 Ag未诱导灭活全菌免疫作为对照。二次免疫后,每周采血分离血清,间接ELASA检测外周血中相应抗体的效价。
2 结果
2.1 peb1A基因的克隆和分析
构建的重组质粒pMD18-T-peb 1A经EcoRⅠ、BamHⅠ进行双酶切,以及PCR扩增出现780 bp大小的片段(图1),得到的ATCC 29428的peb1A基因序列并登录于GenBank上,登录号为EU753356。
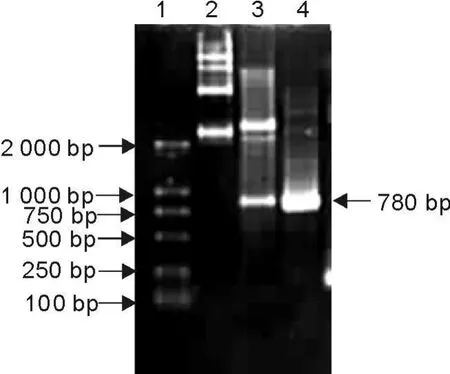
图1 pMD18-T-peb1A重组质粒的鉴定Fig.1 Identification of recombinant plasmid pM D18-T-peb1A
应用DNA Star软件,将空肠弯曲菌 ATCC 29428与GenBank中其他空肠弯曲菌株的peb1A基因进行比较,推导出peb1A基因编码的蛋白质有260个氨基酸,与NCTC 11168菌株基因同源性为98.1%,氨基酸同源性为99.7%,与其他空肠弯曲菌的基因同源性为98.1%~ 99.9%(图2),说明peb1A基因在空肠弯曲菌中比较保守。

图2 空肠弯曲菌株ATCC 29428与其他空肠弯曲菌株的peb1A基因进化关系Fig.2 The peb1A gene relationship of C jejuniA TCC 29428 and other strains
2.2 重组表达质粒的鉴定
将重组表达质粒pET-28a(+)-peb1Ag分别进行酶切和PCR扩增后,电泳可见708bp特异性条带(图3),测序结果表明克隆片段与预期结果完全一致。
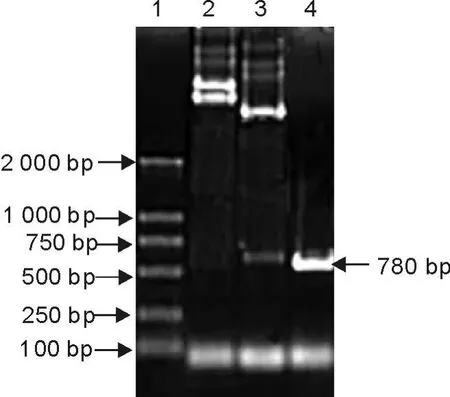
图3 pET28a(+)-peb1Ag重组表达质粒的鉴定Fig.3 Identification of recombinant plasmid pM D18-T-peb1Ag
2.3 重组蛋白的表达和纯化
经SDS-PAGE电泳,IPTG诱导的重组菌经超声裂解后离心的的沉淀在约29 ku处观察到明显的目标蛋白条带,上清液电泳后可见明显的特异性蛋白表达带,上清液重组蛋白经His柱纯化后,观察到明显的单一蛋白条带(图4),说明重组蛋白以可溶性形式存在于细胞质中,用His柱纯化的效果良好。
2.4 Western blot和小鼠免疫试验
纯化的重组蛋白进行Western blot分析,结果显示单一的特异性条带,大小与重组蛋白相似(图4),说明重组蛋白具有良好的反应原性。纯化的重组蛋白免疫小鼠获得的血清,与重组蛋白包被的ELISA板进行反应,第6周血清效价为1∶6 400,第7周的血清效价为1∶12 800,第8周的血清效价大于1∶12 800,说明重组蛋白具有良好的免疫原性。
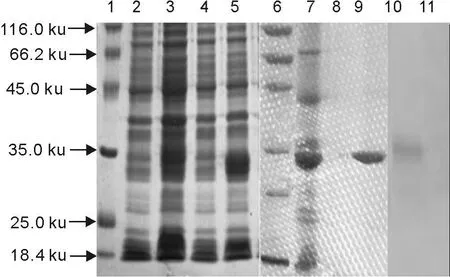
图4 重组蛋白的SDS-PAGE与Western blot分析Fig.4 Analysis of expressed recombinant protein by SDS-PAGE and Western blot
3 讨论
空肠弯曲菌的抗原成分较为复杂,除鞭毛和PEB1蛋白外,还有外膜蛋白(MOMP)、趋化蛋白(CHEY)、脂多糖(LPS)、细胞致死性毒素(CDT)等[6-7],在激活机体的免疫机制的过程中也具有重要的作用。目前对于这些蛋白的作用尚不明确,通过克隆表达方式可对各个基因功能进行充分研究,筛选出其具有免疫保护作用的表面抗原成分,并通过基因工程构建相应的疫苗[5,8],必将对空肠弯曲菌所致的食源性肠炎及继发的GBS等自身免疫性疾病的防治有极重要的意义。
从细菌菌体中纯化大量完整的目的蛋白十分困难,这势必影响细菌蛋白的研究与利用。因此本研究用E.coli原核表达系统对空肠弯曲菌可能的毒力因子PEB1的基因片段进行克隆表达。由于空肠弯曲菌peb1A基因(G+C)%含量低(31.5%),且与E.coli原核表达系统表达载体密码兼并性较差,不易于表达,试验中曾使用过pET32a(+)、pET30、pGEX-6p-1多种载体及宿主菌直接表达空肠弯曲菌peb1A基因和flaAg基因,结果都不能表达或表达量极低(<10%)。根据测序结果利用Vector NTI软件进行基因组改造,合成序列peb1Ag,构建了pET28a(+)-peb1Ag重组质粒,用其转化E.coliBL21(DE3)后,在IPTG诱导下能高效表达分子质量为29 ku的PEB1目的蛋白,蛋白表达量最大可达细菌总蛋白的70%左右,并有良好的免疫原性和反应原性,为空肠弯曲菌表面蛋白研究以及建立相应的检测方法奠定了基础。
[1]Munroe D L,Prescott J F,Penner J L.Campylobacter jejuniandCampylobacter coliserotypes isolated from chickens,cattle,and pigs[J].Clin Microbiol,1983,18:877-881.
[2]Nachamkin I,Ung H,Patton C M.Analysis of HL and O serotypes ofCampy lobacterstrains by the flagellin gene typing system[J].J Clin Microbiol,1996,34(2):277-281.
[3]Pei Z,Burucoa C,Grignon B,et al.Mutation in the peblA locus ofCampy lobacter jejunireduces interactionswith epithelial cells and intestinal colonization of mice[J].Infect and Immun,1998,66(3):938-943.
[4]Carrillo C D,Taboada E,Nash J H,et al.Genome-wide expressionanaly ses ofCampy lobacter jejuniNCTC11168 reveals coordinate regulation of motility and virulence by flhA[J].Biol Chem,2004,279(19):20327-20338.
[5]冯永嘉,蔡方成,刘 杞,等.空肠弯曲菌粘附蛋白 PEB1的克隆表达及免疫保护性初步探索[J].中华微生物学和免疫学杂志,2003,23(8):640-641.
[6]Stucki U,Frey J,Nicolet J,etal.Identification ofCampy lobacter jejunion the basis of aspecies-specific gene that encodes a membrane protein[J].Clin Microbiol,1995,33:855-859.
[7]Taylor D E,Chang N.Immunoblot and enzyme-linked immunosorbant assays ofCampy lobactermajor outer membrane protein and application to the differentiation ofCampy lobacterspecies[J].Mol Cell Probes,1987,1:261-274.
[8]Lee LH,Edwarg B,Baqar S,et al.Elvaluation of a truncated recombinant flagellin subunit vaccine againstCampy lobacter jejuni[J].Infect and Immun,1999,67(11):5799-5805.
Cloning,Expression and Immunogenicity Analysis ofCampylobacter jejunipeb1A Gene
ZHU Chang-qing1,2,TANG Tai-shan1,2,WANG Ting3,JIANG Yuan1,YAO Huo-chun2,ZHANG Chang-yin1,XUE Feng1,LUAN Jun1
(1.J iangsu Entry-Exit Inspection and Quarantine Bureau,Nanjing,J iangsu,210001,China;2.College of Veterinary Medicine,N anjing Agricultural University,Nanjing,Jiangsu,210095,China;3.College of Animal Science and Technology,Luoyang,Henan,471003,China)
Based on theC.jej unigenes in GenBank,the peb1A genes was amplified by PCR fromC.jejunigenomic DNA.The PCR fragments were cloned into the pMD18-T vector and sequenced.The sequences were compared with the peb1A genes of different kinds ofC.jejunistrains to analyze their homology and diversity degree.The DNA fragment of peb1Ag gene ofC.jej uniwas optimized and synthesized in accordance with theE.coli's codon preference,it was inserted to the expression vector pET-28a(+).The recombinant expression plasmid pET-28a(+)-peb1Ag was transformed intoE.coliBL21(DE3),and the recombinant protein PEB1 was expressed,purified,and detected by Western blot and the mouse immunologic test.The results showed the recombinant protein PEB1 possessed the good immunogenicity.
Campylobacter jej uni;peb1A gene;cloning;expression;immunogenicity
S852.613
A
1007-5038(2011)09-0001-04
2011-03-01
国家质检总局科研项目(2008IK145)
祝长青(1973-),男,山东潍坊人,高级工程师,硕士,主要从事食品生物安全研究与检验研究。
