密蒙花方对缺氧状态下脐静脉内皮细胞增殖及HIF-1α表达的影响
2011-05-30栾兆倩高健生接传红宋剑涛吴正正郭欣璐陈子燕
栾兆倩 高健生 接传红 宋剑涛 严 京 吴正正 郭欣璐 陈子燕
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病严重的并发症。新生血管形成是其重要病理变化之一。DR新生血管形成实质上是细胞增殖失控的过程。其中起主要作用的细胞是内皮细胞(endothelial cell,EC)。 血管内皮生长因子 (vascular en dothelial growth factor,VEGF)是最直接的血管内皮细胞促分裂素。它除了能促进内皮细胞的增殖、迁移和血管形成外,还具有提高血管通透性、改变细胞外基质、上调细胞间粘附分子1(intercellular cell adhesion molecule-1,ICAM-1)表达〔1-4〕等功能。 在缺氧状态下,VEGF的表达升高是由缺氧诱导因子1α(hypoxia-inducible factor 1,HIF-1α)调控的〔5,6〕。 随着对HIF-1α及糖尿病视网膜病变的深入研究,认为它可能是糖尿病视网膜病变中最为关键的因子之一。密蒙花方是导师高健生研究员多年临证总结的有效治疗DR的经验方。本实验拟从细胞分子水平探讨该方对缺氧状态人脐静脉内皮细胞(human umbilical vein endothelial,HUVEC)增殖及 HIF-1α 表达的影响,为寻求有效防治糖尿病视网膜新生血管的药物提供实验依据。
1 材料和方法
1.1 材料
1.1.1 试剂:RPMI1640培养基购自美国Gibco公司,胎牛血清(fetal bovine serum,FBS)购自杭州四季青生物工程有限公司,胰蛋白酶、CoCl2购自美国Sigma公司,PBS购自北京中杉金桥科技有限公司,兔抗人HIF-1α多克隆抗体、即用型SABC免疫细胞化学染色试剂盒均购自北京博奥森生物工程有限公司。二氨基联苯胺显色剂(DAB)、苏木素染色液均购自福州迈新生物工程有限公司。四甲基偶氮唑盐(MTT)购自美国Amresco公司。
1.1.2 细胞来源:人脐静脉内皮细胞株为中国中医科学院医学实验中心形态学实验室馈赠。
1.1.3 中药来源:中药材购自北京燕北药材公司,经我院药房鉴定为道地药材。生黄芪(产于内蒙古),女贞子、益母草(均产于河北),黄连(产于四川),肉桂(产于广东),密蒙花(产于湖北),乌梅(产于浙江)。1.1.4 实验仪器:倒置相差显微镜、图像分析系统(奥林巴斯),二氧化碳细胞培养箱(Thermo),超净工作台(苏州净化),离心机(上海安亭科学仪器厂),全自动酶标仪(上海热电仪器有限公司)。
1.2 方法
1.2.1 制备密蒙花方水提液:密蒙花方所含中药材沸水浴煎半小时,过滤并收集滤液,取滤渣重复提取1次,合并二次滤液,加入2倍体积的90%乙醇溶液(V/V),4℃过夜,离心去除乙醇不溶成分,配成浓度为1 g/ml水提液。0.22 μm微孔滤膜滤过灭菌。4℃保存备用。
1.2.2 HUVEC的培养:取HUVEC细胞株,复苏后采用胰蛋白酶(0.25%)消化法,在37℃下5%CO2培养箱中进行细胞培养,待细胞长满融合后按1∶3分瓶传代。
1.2.3 实验分组:每组设6个平行样本:(1)正常组:RPMI1640维持液。(2)缺氧组:正常组+终浓度100 μmol/L CoCl2。 (3)密蒙花方低浓度组:缺氧组+10 mg/ml密蒙花方水提液。(4)密蒙花方中浓度组:缺氧组+20 mg/ml密蒙花方水提液。(5)密蒙花方高浓度组:缺氧组+40 mg/ml密蒙花方水提液。
1.2.4 MTT法检测密蒙花方对缺氧状态人脐静脉内皮细胞增殖的影响:取生长良好的HUVEC,制成浓度为1.0×105/ml的HUVEC悬液,接种于96孔培养板中,每孔 100 μl,37℃下 5%CO2培养箱中培养24小时,弃培养液,根据实验分组,分别加入不同的药物,每组设6个平行孔,每孔100 μl液体,37℃下5%CO2培养箱中继续培养24小时,弃培养液,每孔加入终浓度为 0.5 mg/ml的 MTT溶液 100 μl,37℃下5%CO2培养箱中放置4小时,弃MTT溶液,每孔加200μl二甲亚砜(DMSO)溶液,振荡10分钟,于全自动酶标仪上选490nm为测定波长,参考波长为630nm,比色测定各孔吸光度值(OD值)。
1.2.5 免疫细胞化学法检测密蒙花方对缺氧状态人脐静脉血管内皮细胞HIF-1α表达的影响:将细胞接种于放有盖玻片的24孔板中。置于37℃、5%CO2培养箱中培养24小时,按实验分组,分别加入不同药物,继续培养24小时后从24孔板中分别取出各组盖玻片,室温下在多聚甲醛中固定。0.1%triton X-100破膜。30%H2O21份+纯甲醇50份混合,室温浸泡盖玻片以灭活内源性过氧化物酶。5%牛血清白蛋白(bovine serum albumin,BSA)封闭。滴加一抗(兔抗人HIF-1α多克隆抗体,稀释度为 1∶100)室温过夜。滴加生物素化山羊抗兔IgG,37℃60分钟。滴加辣根过氧化物酶工作液,37℃30分钟(以上各步间均用PBS漂洗3次)。DAB显色,蒸馏水洗涤。苏木素复染。梯度酒精脱水。二甲苯透明。中性树胶封片。用PBS代替一抗作为阴性对照。用积分光密度表示HIF-1α的表达,通过图象分析系统进行半定量分析。
1.3 统计学分析
2 结果
2.1 密蒙花方对缺氧状态下HUVEC细胞增殖的影响
不同浓度的密蒙花方(10 mg/ml,20 mg/ml,40 mg/ml)分别与 CoCl2共同作用于 HUVEC 24小时后,显示出明显的抑制HUVEC增殖的作用,并且呈浓度依赖关系(表1,图1)。与正常组比较,缺氧组光度值(OD 值)升高(P<0.01),显示出明显的促增殖作用;与缺氧组比较,各密蒙花方组OD值显著降低(P<0.01),均表现出较强的抑制增殖的作用,并且OD值随着密蒙花方浓度的增高而逐渐降低(P<0.01)。
表1 MTT法检测密蒙花方对HUVEC增殖的影响(±s,n=6)
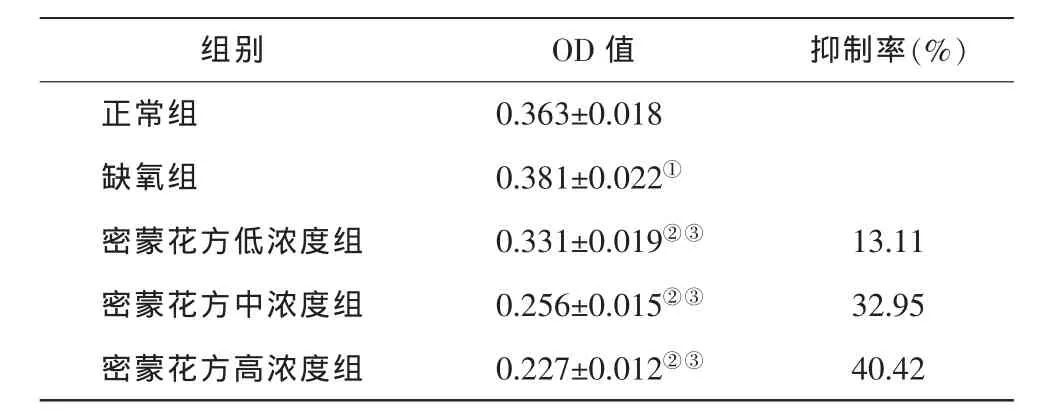
表1 MTT法检测密蒙花方对HUVEC增殖的影响(±s,n=6)
注:①缺氧组与正常组相比P<0.01;②密蒙花方低浓度组与缺氧组相比P<0.05;密蒙花方中、高浓度组与缺氧组相比 P<0.01;③密蒙花方各浓度组之间相比 P<0.01。
组别 OD值 抑制率(%)正常组 0.363±0.018缺氧组 0.381±0.022①密蒙花方低浓度组 0.331±0.019②③ 13.11密蒙花方中浓度组 0.256±0.015②③ 32.95密蒙花方高浓度组 0.227±0.012②③ 40.42

图1 MTT法检测密蒙花方对HUVEC增殖的影响
2.2 密蒙花方对缺氧状态下HUVEC细胞内HIF-1α蛋白表达的影响
与正常组相比,缺氧组HIF-1α蛋白表达升高,差异具有统计学意义(P<0.01);与缺氧组相比,各密蒙花方组HIF-1α蛋白表达降低,差异具有统计学意义(低、中浓度组 P<0.05,高浓度组 P<0.01);各密蒙花方组组间比较,HIF-1α蛋白表达随密蒙花方浓度升高而降低,密蒙花方高浓度组较中、低浓度组HIF-1α蛋白表达降低,差异具有统计学意义(P<0.01),中、低浓度组HIF-1α蛋白表达差异无统计意义(P>0.05)(表 2,图 2)。
表2 免疫细胞化学法检测密蒙花方对HUVEC细胞内HIF-1α 的影响(±s,n=6)

表2 免疫细胞化学法检测密蒙花方对HUVEC细胞内HIF-1α 的影响(±s,n=6)
注:①缺氧组与正常组相比 P<0.01;②密蒙花方低、中浓度组与缺氧组相比P<0.05;密蒙花方高浓度组与缺氧组相比P<0.01;③密蒙花方高浓度组与中、低浓度组相比 P<0.01。
组别 HIF-1α光密度值正常组 153696.942±64716.946缺氧组 546058.857±134355.000①密蒙花方低浓度组 446238.838±46492.153②③密蒙花方中浓度组 414345.585±69003.986②③密蒙花方高浓度组 308837.105±74998.959②③
3 讨论
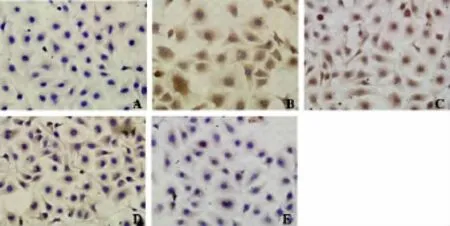
图2 免疫细胞化学法显示密蒙花方对缺氧状态下HUVEC内HIF-1α的影响(×40)。A正常组:胞浆内HIF-1α仅呈微量表达。B缺氧组:胞浆内HIF-1α强阳性表达,显色呈深黄褐色。C密蒙花方低浓度组:胞浆内HIF-1α表达较B组减弱,显色呈浅黄褐色。D密蒙花方中浓度组:胞浆内HIF-1α表达较B组减弱,显色呈浅黄褐色,较C组变浅。E密蒙花方高浓度组:胞浆内HIF-1α表达较B组减弱,显色呈淡黄棕色。
血管生成是以微血管出芽的方式,从已存在的血管床长出,并形成新的血管分支及毛细血管丛,是已存在于血管内的成熟的经过充分分化了的内皮细胞增殖、迁移和重塑的结果〔7〕。DR的新生血管即是以微血管出芽的方式,在原有的血管床、小静脉和毛细血管的基础上发生和发展的,但其血管组织结构不完整,管壁通透性增加,容易发生渗漏和出血,产生各种并发症。它的形成过程包括:基底膜被降解,内皮细胞(EC)穿过基底膜迁移到血管周围基质,EC增殖、相互黏附并连接,内皮细胞和周细胞相互作用,形成管腔样结构。新生血管本质上是一种细胞增殖失控而导致的分子生物学过程。血管内皮细胞在新生血管形成过程中起到主要作用,通过内皮细胞的迁移、增殖、分化和结构重建构成了新的毛细血管网。
HIF-1是维持氧自稳平衡的核心调控因子,调控一系列缺氧相关基因的表达,而且在感受缺氧,传递缺氧信号的过程中发挥着重要作用。HIF-1由α亚基和β亚基组成。β亚基在细胞内呈构成性表达,不受细胞氧浓度的调节;α亚基在正常情况下经翻译后即迅速通过泛素-蛋白酶途径被水解。α亚基564位脯氨酸残基羟基化后,与VHL抑癌基因的产物相结合,HIF-1α亚基才能被降解,羟基化的完成依赖于环境中O2的浓度,及本身依赖氧的天冬酰氨羟化酶、脯氨酰羟化酶的调节和参与。所以HIF-1α蛋白的表达和转录主要受细胞内氧浓度的调节〔8-13〕。缺氧时脯氨酸残基羟基化无法完成,导致泛素E3连接酶复合体无法形成,HIF-1α不能被泛素化降解,α亚基得以和β亚基结合形成有活性的HIF-1,HIF-1大量分泌。HIF-1被缺氧信号激活后,与VEGF 5′端增强子相互作用,调节VEGF表达升高,VEGF通过作用于视网膜血管内皮细胞上大量高亲和力受体,促进血管内皮细胞分裂、增殖,导致视网膜新生血管形成,以增加供氧,维持细胞和机体的氧自稳平衡及能量代谢平衡。研究表明,通过siRNA抑制 HIF-1 表达后,VEGF mRNA 水平降低〔14〕。 HIF-1被激活后还能与其他转录因子协同作用,调控一系列缺氧相关基因的表达,如促红细胞生成素、糖酵解的酶类等,使缺氧诱导基因的转录增强,引发一系列适应缺氧的生理效应〔15,16〕。 所以,HIF-1α 是血管生长信号途径的关键上游转录因子。有可能通过操纵HIF-1α来控制HIF-1而调节全部的血管生成基因,从而控制新生血管的形成。
氯化钴诱导细胞缺氧模型是一种较成熟的制造缺氧模型方法。Co2+是铁螯合酶的底物,可替代氧感受器血红素蛋白的Fe2+,Co2+在氧高浓度时才能与氧结合,使血红素蛋白在正常氧浓度下不能与氧结合,故可将此分子锁定在脱氧合状态(根据血红素蛋白的铁离子是否与氧结合,分为氧合状态和脱氧合状态),模拟缺氧状态。CoC12的作用机理与低氧一致,相当于细胞氧感受器受到低氧刺激,考虑到CoCl2对细胞有损害作用,本实验采用适当剂量(100 μmol/L)CoCl2刺激,且作用24 h,成功模拟了内皮细胞缺氧环境。
密蒙花方是在密蒙花、交泰丸(黄连、肉桂)的基础上加黄芪、女贞子、乌梅、益母草而成。黄芪大补元气,女贞子补肝肾明目为君药,益母草和血利水明目,乌梅收敛生津止血为臣药,黄连、肉桂相配使水火即济,能安神宁血为佐药,密蒙花清肝火除翳膜,可入血络退赤脉,为使药,而密蒙花又兼轻清之性,引药上行,功用独特,故本方以此药命名。7味药相配伍,共奏益气滋阴,温阳化气,和血明目的功效。本课题组对该方进行了多中心临床研究(国家科技部2005年度社会公益研究专项:“糖尿病视网膜病变早期预防和干预的研究”,项目编号:2005DIBIJ170),大量临床病例证明,本方对DR具有一定的防治作用。
本实验表明,在缺氧状态下,HUVEC增殖明显,细胞中HIF-1α表达增高,密蒙花方能有效的抑制细胞增殖及HIF-1α表达,并呈浓度依赖关系。密蒙花方可能通过抑制HIF-1α的表达而抑制VEGF的表达,从而抑制血管内皮细胞的增殖,对新生血管的形成起到一定的抑制作用。本研究为临床上使用密蒙花方治疗DR提供了科学的实验依据,提示密蒙花方有可能成为抑制DR新生血管的有效药物,但其具体作用机制还有待于进一步深入研究。
[1] Joussin Am,Poulaki V,Qin W,et al.Retinal vascular endothelial growth factor induces intercellular adhesion molecule-1 and endothelial nitric oxide syntheses expression and initiates early diabetic retinal leukocyte adhesion in vivo[J].Am J Pathol,2002,160(2):501.
[2] Ozaki H,Seo MS,Ozaki K,et al.Blockaed of vascular endothelial cell growth factor receptor signaling is sufficient to completely prevent retinal neovascularization[J].Am J Pathol,2000,156(2):697.
[3] Tang S,Le-Ruppert KC,Gabel VP.Eepress of intercellular adhesion molecule (ICAM-1) and Vascular cell adhesion molecule-1(VCAM-1)on proliferating vascular endothelial cells in diabetic epiretinal membranes[J].Br J Ophthalmol,1994,78(5):370.
[4] 宋剑涛,吴 烈.糖尿病视网膜病变白细胞和粘附分子的研究进展[J].眼科,2004,13(1):54-57.
[5] Jin KL,Mao XO,Nagayama T,et al.Induction of vascular endothelial growth factor and hypoxia-inducible factor-1alpha by global ischemia in rat brain[J].Neuroscience,2000,99(3):577-585.
[6] Richard DE,Berra E,Pouyssegur J.Angiogenesis:how a tμmor adapts to hypoxia[J].Biochem Biophys Res Commun,1999,266(3):718-722.
[7] Bdolah Y,Sukhatme VP,Karumanchi SA.Angiogenic imbalance in the pathophysiology of preeclampsia:newer insights[J].Semin Nephrol,2004,24(6):548-556.
[8] Epstein AC,Gleadle JM,McNeill LA,et al.elegans EGL-9 and mammalian homologs define a family of dioxygenases that regulate HIF by prolyl hydroxylation[J].Cell,2001,107(1):43-54.
[9] Ivan M,Kondo K,Yang H,et al.HIFalpha targeted for VHL-mediated destruction by proline hydroxylation:implications for O2sensing[J].Science,2001,292(5516):464-468.
[10]Jaakkola P,Mole DR,Tian YM,et al.Targeting of HIF-alpha to the von Hippel-Lindau ubiquitylation complex by O2-regulated prolyl hydroxylation[J].Science,2001,292(5516):468-472.
[11]赵荣瑞.缺氧诱导因子-1(HIF-1)的基础研究与临床意义[J].山西医科大学学报,2006,37(3):225-230.
[12]朱 洁.钙离子在缺氧诱导的人视网膜色素上皮细胞HIF-1活化和VEGF表达中的作用[D].西安:第四军医大学,2005.
[13]Arjamaa O,Nikinmaa M.Oxygen-dependent diseases in the retina:role of hypoxia-inducible factors[J].Exp Eye Res,2006,83(3):473-483.
[14]许惠卓,刘双珍,夏晓波,等.低氧诱导因子-1α干扰RNA对血管内皮生长因子mRNA表达的抑制作用[J].眼视光学杂志,2007,9(4):228-231.
[15]Lando D,Peet DJ,Whelan DA,et al.Asparagine hydroxylation of the HIF transactivation domain a hypoxic switch[J].Science,2002,295(5556):858-861.
[16]赵 炜.HIF-1α在缺氧诱导的体外脉络膜新生血管生成中的调控作用[D].西安:第四军医大学,2008.
