毛竹大片段双元细菌人工染色体基因组文库的构建
2011-05-30张智俊罗淑萍汤定钦
管 雨,杨 洋,张智俊,罗淑萍,汤定钦
(1.浙江农林大学亚热带森林培育国家重点实验室培育基地,浙江 临安 311300;2.新疆农业大学 农学院,新疆 乌鲁木齐 830052)
毛竹Phyllostachys pubescens是中国竹类植物中分布范围最广的一个材用和笋用竹种[1],不但具有很高的经济价值,还能产生良好的生态效应。因此,开展毛竹功能基因组学研究对于促进毛竹遗传改良,实现毛竹良种化具有重要的现实意义。Hamilton等[2]结合细菌人工杂色体(BAC)载体和Ti质粒的特点,构建了双元细菌人工染色体(BIBAC)载体,能够在农杆菌Agrobacterium tumefaciens介导下直接将外源基因整合到植物基因组中进行功能验证,是研究基因功能、基因的表达调控以及作物遗传改良的快速可靠途径。BIBAC已应用于一些植物基因组文库的构建,如Hamiton等[3]构建了番茄Lycopersicon esculentum‘Mogeor’和 Lycopersiconpennellii‘LA716’的大片段 BIBAC 文库, Chang 等[4]构建了拟南芥Arabidopsisthaliana的BIBAC基因组文库,何瑞峰等[5]构建了药用野生稻Oryza officinalis的BIBAC文库,Wang等[6]构建了盐芥Thellungiella halophila的BIBAC文库,并在此基础上进行了基因的图位克隆[7],其中拟南芥BIBAC基因组文库的大规模转化已经完成,这对植物功能基因组学的研究具有极其深远的意义[8-9]。目前,彭正华等[10]首次对竹类植物功能基因组学进行了探讨,开发了包括10608个全长cDNA片段(FL-cDNAs)和约3万个表达序列标签(ESTs)的毛竹基因资源数据库;Gui等[11]在竹类基因组学的研究中发现水稻O-ryza sativa,高粱Sorghum bicolor与竹类植物有很高的同源性,并认为水稻、高粱对竹类基因组学的研究有很高的参考价值。由于竹类植物遗传背景的研究还比较薄弱,没有建立高密度的遗传图谱,缺乏有效的竹类功能基因组学研究手段,且大规模的毛竹功能基因组研究刚刚起步,其基因组测序须以高质量的基因组文库为基础。因此,构建一个高质量的基因组BIBAC文库是毛竹基因组研究必不可少的工作。本研究以双元细菌人工染色体(BIBAC)为载体,建立并完善了毛竹大片段基因组文库的构建体系,构建了高质量、高覆盖率的毛竹基因组BIBAC文库,以期为毛竹基因组及功能基因的克隆打下基础。
1 材料与方法
1.1 材料
提取大片段基因组DNA的植物材料为毛竹笋,采自浙江省临安市人工毛竹林。双元细菌染色体pCLD04541(由张宏斌老师馈赠)大小为23.2 kb,对四环素具有抗性,含有LacZ基因;大肠杆菌Eschrichia coli DH10B购自Invitrogen公司;限制性内切酶BamH I,DNA分子量标准λ/Hind III购自TaKaRa公司;Lambda Ladder PFG Marker购自NEB公司;蛋白酶K购自Merk公司,T4连接酶及碱性磷酸酯酶(CIAP)脱磷酸化酶购自Fermentas公司;其他常规化学试剂为国产分析纯。
1.2 方法
1.2.1 毛竹基因组高分子量核染色体DNA的制备 高分子量(high molecular weight,HMW)DNA的获得是构建大片段基因组文库的基础[12]。本研究根据Zhang等[13]的程序分离毛竹基因组高分子量核染色体DNA。其基本步骤包括细胞核的分离与包埋,细胞核的裂解与HMW DNA的脉冲场凝胶电泳,HMW DNA的大量酶切及脉冲电泳回收。
1.2.2 载体的制备 将含有pCLD04541质粒的保存菌株接种于含四环素的LB(Luria-Bertain)固体培养基上,过夜培养。挑单克隆接种于LB液体培养基上,按1∶100接种菌液,同条件扩繁到20 L。使用碱裂解法提取质粒[14],以氯化铯梯度密度离心纯化[15]。将纯化后的质粒用限制性内切酶BamH I和Sam I分别对质粒进行酶切1 h后,再用脱磷酸化酶于37℃保温1 h脱磷酸化。根据质粒质量浓度,按2×16.67 mkat·g-1的量用BamH I对pCLD04541进行限制性消化,其中酶切反应体系和对酶切后质粒进行脱磷酸化的操作参考张洪斌的方案[16]。酶切产物8.0 g·kg-1琼脂糖电泳检测,并调整质粒质量浓度为10.0 mg·L-1。
1.2.3 电转化感受态大肠杆菌的制备 将DH10B菌株划LB平板,37℃培养过夜;挑单克隆于5 mL液体LB培养基中,37℃220 r·min-1摇菌8 h;按1∶100扩繁,同条件继续培养2~3 h,期间及时检测菌液吸光度值;D[λ]600值达到0.6左右时,将三角瓶取出后迅速置于冰水浴中冷却20 min;将菌液转入无菌离心瓶,4000 r·min-1离心5 min;弃上清,加入等体积氯化钙缓慢重悬菌体,冰浴10 min,4000 r·min-1离心10 min,重复3次,尽可能弃上清。加入等体积的100.0 g·kg-1甘油,20 μL为单位分装,垂直插入液氮速冻后转入-80℃冰箱保存。
1.2.4 感受态与载体的检测 以T4连接酶分别对脱磷与未脱磷质粒载体进行自连,各取1 pg进行电击转化,通过计算转化所长出的克隆数确定感受态细菌的转化效率以及质粒载体脱磷是否合格。
1.2.5 连接与转化 外源片段与载体按照3∶1的比例进行混合,50℃下加热1 min,冷却至室温后加入适量T4连接酶于16℃连接过夜。连接液滴于高分子滤膜上脱盐和浓缩5~6 h后用于转化。感受态细胞与连接产物均匀混合后于电激仪上进行电激,然后加入1 mL super optimal broth with catabolite repression(SOC)液体培养基,混匀后转入另一离心管复苏1 h。取200 mL菌液涂于LB固体培养基上,37℃培养16~20 h进行蓝白斑筛选,并挑取白色克隆。
1.2.6 文库插入片段的检测 随机挑选36个单克隆接种于LB培养基中,37℃225 r·min-1培养过夜。十二烷基硫酸钠(SDS)碱裂解小量法抽提质粒,以脉冲场电泳检测重组质粒的大小。根据R=N×I/GS(R代表覆盖度,N代表重组克隆的数目,I代表平均插入片段大小,GS为物种基因大小,毛竹基因组大小约为2000 MB)计算文库的库容。
2 结果与分析
2.1 大片段基因组DNA的获得
2.1.1 高分子量DNA的质量检测 本研究以毛竹笋为材料制备高分子量DNA,通过脉冲场凝胶电泳检测所得DNA的分子量大小与浓度,结果如图1所示。凝胶栓中毛竹核DNA分子量从大到小呈连续分布,其中1.0 Mb级以上的高分子量DNA占有很高的比例,机械降解的非特异小片段很少,主要分布在0.8 Mb以下,残余的糖、酚类等杂质仍留在胶孔中。因此,制备的高分子量DNA可以用于文库构建。

图1 毛竹基因组高分子量DNA脉冲场电泳Figure1 Pulsed field gel electrophoresis of genomic HMW DNA of Phyllostachy pubescens
2.1.2 高分子量DNA的预酶切 高分子量DNA需经过部分酶切才能用于构建基因组文库,因此,敏感和重复性良好的部分酶切特性是考察高分子量DNA质量的一个重要依据。用限制性内切酶BamH I对毛竹高分子量DNA进行梯度酶切,随着酶用量的增加,所得到的基因组DNA限制性酶切片段逐渐减小(图2)。这与Zhang等[13]以梯度酶切番茄高分子量的效果一致。说明此毛竹高分子量DNA可以进行酶切操作,能够用于大片段文库构建。
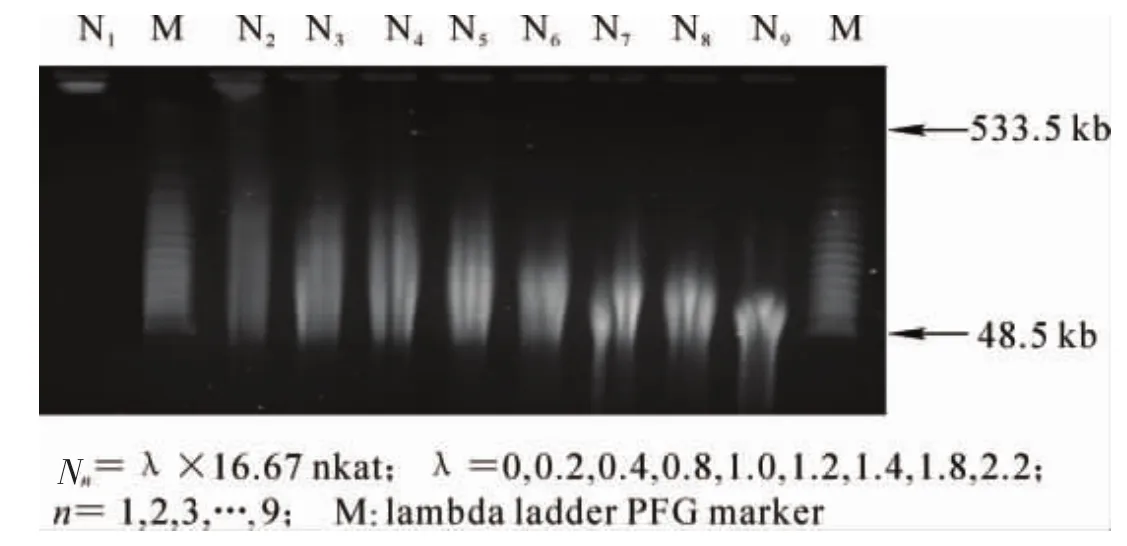
图2 毛竹基因组高分子量DNA的梯度预酶切Figure2 Gradient pre-enzyme digestion of genomic HMW DNA of Phyllostachy pubescens
2.1.3 大片段DNA的制备 ①第1次分离回收。按照预酶切所确定的酶量对毛竹基因组DNA进行大量的酶切。部分消化的DNA经脉冲电泳分离完毕后,将凝胶一侧含DNA标记及少量样品的部分切下进行溴化乙锭(EB)染色,在紫外透射仪上用直尺量取50~100 kb的位置。用同样规格的直尺量取未染色的凝胶,切取其上100~150 kb位置的凝胶条。如图3所示,缺失部分为切取的含100~150 kb毛竹基因组DNA片段的凝胶部分。②第2次分离回收。将第1次分离切下的胶块埋入凝胶中,脉冲电泳完毕后按第1次分离方法切取含有100~150 kb大小片段的凝胶块。如图4所示,缺失部分为切取了含目的片段胶块的部分。

图3 基因组大片段的第1次分离与回收Figure3 First separation and recycling of Large genomic DNA fragments

图4 基因组大片段的第2次分离与回收Figure4 Second separation and recycling of large genomic DNA fragments

图5 回收DNA片段的质量浓度Figure5 Concentration of recycling DNA fragments
2.1.4 大片段的浓缩、脱盐与质量浓度测定把经2次分离后切取的含目的片段的凝胶块放入半透膜中,在脉冲电泳仪中进行电洗脱。洗脱完毕后,对得到的大片段DNA进行去硼离子处理,因为硼离子会影响后续的连接反应[17]。本研究中的大片段DNA经过2次回收后质量浓度已低于10 mg·L-1,为了后续连接反应的成功,将回收液在0.025μm的Millipore膜上进行浓缩,并以已知浓度的λDNA作参照,通过电泳确定浓缩后DNA大片段的质量浓度(图5)。本研究回收大片段DNA的质量浓度为20 mg·L-1。
2.2 载体的制备与检测
按照SDS碱裂解法制备的pCLD04541质粒DNA以氯化铯梯度密度离心纯化之后,用限制性内切酶BamH I和Sam I分别对质粒进行酶切。正确的酶切图谱为:Sam I酶切为2条带;BamH I酶切为1条带。图6的结果显示:酶切结果与正确的pCLD04541物理图谱吻合。取10 μg纯化的质粒用BamH I进行酶切,再用CIAP将其脱磷酸化,从而得到能够用于和大片段DNA连接的载体DNA。为了验证载体的脱磷效果,用T4连接酶分别对脱磷与未脱磷的载体进行自连后,电击转化大肠杆菌 DH10B。结果表明:脱磷后载体自连转化与完整载体转化所产生的克隆数比例小于1∶50,符合Sambrook等[18]的评价标准。因此,载体脱磷效果较好,绝大部分载体无法自连。
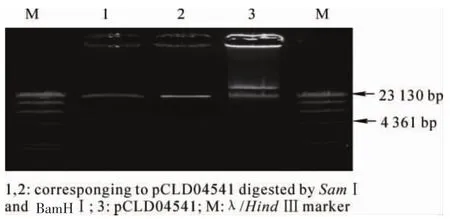
图6 pCLD04541电泳Figure6 Electrophoresis of pCLD04541
2.3 大肠杆菌电转化感受态细胞检测
取1 pg pCLD04541质粒转化20 μL自制的电击感受态细胞,转化结果如图7所示,自制的大肠杆菌DH10B电转化感受态的效率约在1×104菌落形成单位·g-1,不仅降低了研究成本,而且基本满足建库的要求。
图7 电击感受态细胞转化结果Figure7 Results of shock transformation of competent cells
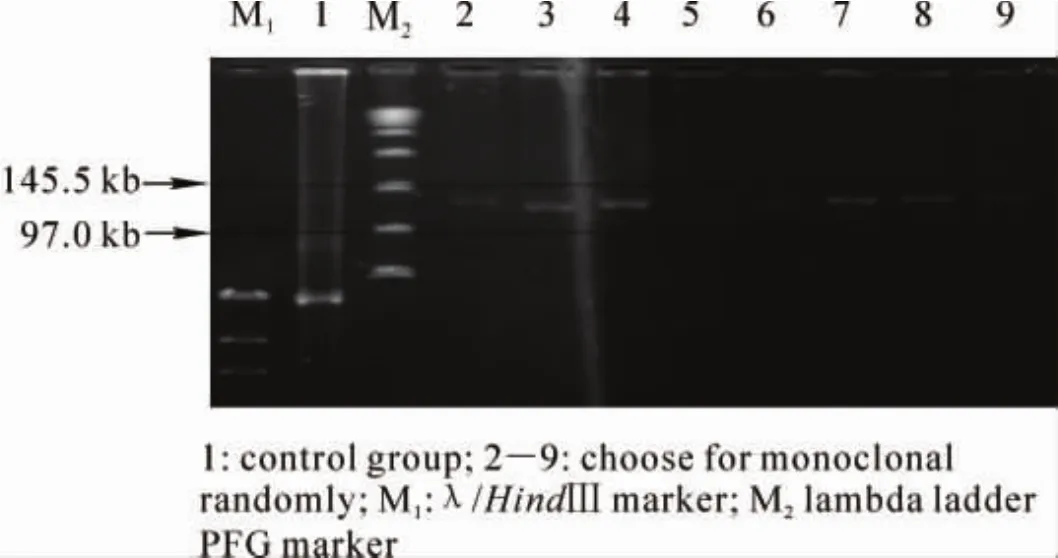
图8 重组质粒的脉冲场电泳Figure8 Pulsed field gel electrophoresis of recombinant plasmids
2.4 连接与转化
连接产物中盐离子浓度直接关系到电击成功率。将经去除硼离子的高分子量DNA与脱磷载体按质量比3:1连接后,以自备的DH10B感受态对其进行电击转化,37℃培养14 h后进行蓝白斑筛选挑取白斑,共104个克隆,保存于细胞培养板中,形成毛竹BIBAC基因组文库。
随机挑取36个白色克隆,SDS碱裂解法提取质粒后,以原始空质粒做参照对重组质粒的分子量大小进行脉冲电泳检测。结果表明:32个克隆含有插入子,且重组克隆的分子量大小介于100~150 kb(图8),而原始质粒的大小为27 kb。表明重组克隆的插入片段为90~120 kb,平均长度为105 kb。按毛竹基因组大小为2000 Mb,该文库相当于5倍毛竹基因组。
3 讨论
常规DNA提取方法由于在操作过程中不可避免的物理剪切及化学试剂和核酸酶对大分子的破坏作用,所获得的DNA分子量在20 kb左右,无法满足大片段(100~300 kb)文库构建的的要求。本研究利用目前较为通用和方便的制备植物基因组高分子量DNA方法提取细胞核,并将其包埋于琼脂糖凝胶栓中固化,之后选择相应试剂浸入栓内,进行细胞核的裂解和蛋白质的去除,从而得到分子量在1 Mb以上的核DNA,最终获得了毛竹基因组高分子量DNA,为本研究库的构建奠定了良好的基础。
限制性内切酶BamH I部分酶切染色体DNA成大小不等的DNA片段,一般通过脉冲电泳回收100 kb以上大小的片段。但是在回收的时候,许多小片段(如<100 kb)由于阻滞效应而混在>100 kb以上的片段里,在连接反应时影响大片段的克隆。因此,本研究对酶切得到的大片段DNA进行2次条件不同的脉冲电泳,第1次电泳使不同大小的限制性酶切片段初步得到分离,第2次电泳则使初步分离中混杂的小片段得到分离,而90 kb以上的大片段在一定区域集中,一方面去除了小片段,另一方面较为集中的大片段有利于提高其回收效率。
体外克隆大片段DNA需要高质量载体以增加连接效率和减少载体自连频率。首先适量限制性内切酶处理非常关键素,过大酶量会引起非特异性消化或星活性,少量非特异性酶切产物会使假阳性克隆大大增加。对线性质粒脱磷酸化处理要适度,脱磷酸化如果不充分,则载体容易自连,处理过度会导致载体受到损伤无法同外援片段连接,因此,在对载体进行脱磷酸化处理时,一方面要严格把握碱性磷酸酶(CIAP)的用量,另一方面要精确地控制脱磷酸化反应的时间。本研究使用的CIAP酶量为16.67 mkat·g-1,脱磷反应0.5 h后迅速以0.5 mol·L-1乙二胺四乙酸(EDTA)终止反应,加入蛋白酶K和SDS后在56℃水浴0.5 h,以使CIAP失活。
在挑取克隆前,将转化平板放在4℃下24 h后,使空载菌落充分变蓝,便于识别白色菌落降低空载率。本研究构建的毛竹BIBAC文库含有约1万个克隆,随机挑取36个克隆,通过脉冲场电泳检测分析后确定所构建的毛竹BIBAC文库平均插入片段105 kb,获得重组率较高的阳性克隆,并约覆盖5倍基因组。本研究为今后毛竹遗传图谱构建、基因数量性状基因座(QTL)定位与克隆、基因组学的研究打下了坚实基础。
[1]方伟.竹子分类学[M].北京:中国林业出版社,1995:56-59.
[2]HAMILTON C M, FRARY A, LEWIS C, et al.Stable transfer of intact high molecular weight DNA into plant chromosomes [J].Proc Nal Acad Sci USA, 1996, 93(18): 9975-9979.
[3]HAMILTON C M,FRARY A,XU Y,et al.Construction of tomato genomic DNA libraries in a binary-BAC(BIBAC) vector [J].Plant J, 1999, 18(2): 223-229.
[4]CHANG Y L, HENRIQUEZ X, PREUSS D, et al.A plant-transformation-competent BIBAC library from the Arabidopsis thaliana Landsberg ecotype for functional and comparative genomics [J].Theor Appl Gen, 2003, 106: 269-276.
[5]何瑞峰,王媛媛,杜波,等.水稻双元细菌人工染色体载体系统转化体系的建立[J].遗传学报,2006,33(3):269-276.HE Ruifeng, WANG Yuanyuan, DU Bo, et al.Development of transformation system of rice based on binarybacterial artificial chromosome (BIBAC) vector[J].Acta Gen Sin, 2006, 33(3): 269-276.
[6]WANG Weiquan, WU Yaorong, LI Yin, et al.A large insert Thellungiella halophila BIBAC library for genomics and identification of stress tolerance genes [J].Plant Mol Biol, 2010, 72: 91-99.
[7]SAWA S, WATANABE K, GOTO K, et al.FILAMENTOUS FLOWER, a meristem and organ identity gene of Arabidopsis, encodes a protein with a zinc finger and HMG-related domains [J].Genes&Dev, 1999, 13: 1079-1088.
[8]崔广荣,刘耀光.可转化人工染色体与植物基因克隆[J].生物学通报,2003,38(7):18-20.CUI Guangrong, LIU Yaoguang.Artificial chromosome and plant gene cloning [J].Bull Biol, 2003, 38 (7): 18-20.
[9]成志伟,曹孟良,陈良碧.植物大片段DNA的研究进展 [J].生命科学研究,2005,9(4);43-45.CHENG Zhiwei, CAO Mengliang, CHEN Liangbi.Progress in large DNA fragment of plant[J].Life Sci Res, 2005, 9(4): 43-45.
[10]PENG Zhenhua, LU Tingting, LI Lubin, et al.Genome-wide characterization of the biggest grass, bamboo,based on 10, 608 putative full-length cDNA sequences [J].BMC Plant Biol, 2010, 18(10): 116.
[11]GUI Yijie, ZHOU Yian, WANG Yu, et al.Insights into the bamboo genome:syntenic relationships to rice and sorghum [J].Inte Plant Biol, 2010, 52(11): 1008-1015.
[12]WOO S S, JIANG Jiming, GILL B S, et al.Construction and characterization of bacterial artificial chromosome library of Sorghum bicolor[J].Nucl Acids Res, 1994, 22(23): 4922-4931.
[13]ZHANG Honbin, ZHAO Xinping, DING Xiaoling, et al.Preparation of megabase-size DNA from plant nuclei [J].Plant J, 1995, 7(1): 175-184.
[14]都艳霞,沙伟,张梅娟.碱裂解法提取重组质粒DNA及PCR验证[J].生物技术,2009,19(2):35-37.DU Yanxia, SHA Wei, ZHANG Meijuan.Using alkaline lysis method for recombine plasmid DNA extraction and PCR vertification [J].Biotechnology, 2009, 19(2): 35-37.
[15]胡华萃,王进,沈桂芳,等.氯化铯密度梯度离心法纯化叶绿体DNA[J].杭州大学学报:自然科学版,1985,12(3): 370-373.HU Huacui, WANG Jin, SHEN Guifang.Purification of chloroplast DNA by CsCl gradient centifigation [J].J Hangzhou Univ Sci Ed, 1985, 12(2): 370-373.
[16]ZHANG Hongbin.Construction and Manipulation of Lare-Iginsert Bacterial Clone Libraries—Manual [R].Texas:Texas A&M University,2000.
[17]ANDERSON C.Genome shortcut leads to problems [J].Science, 1993, 259 (5102): 1684-1687.
[18]SAMBROOK J.Molecular Cloning: A Laboratory Manual[M].New York: CSHL Press, 2001.
