局部进展期乳腺癌趋化因子受体CXCR4的表达与新辅助化疗疗效的相关性及预后研究
2011-05-28杨永德印国兵曾晓华
杨永德 印国兵 曾晓华
重庆医科大学附属第二医院普外科,重庆 400010
局部进展期乳腺癌趋化因子受体CXCR4的表达与新辅助化疗疗效的相关性及预后研究
杨永德 印国兵 曾晓华
重庆医科大学附属第二医院普外科,重庆 400010
背景与目的:目前已经确立新辅助化疗在局部进展期乳腺癌(local advanced breast cancer,LABC)治疗中的地位,达到病理完全缓解者可提高生存率,但仍有大量患者复发、死亡,而无法从中受益。因此,我们迫切需要从分子水平找到可以预测新辅助化疗效果和预后的指标。目前已经证实趋化因子受体CXCR4与乳腺癌的侵袭和转移有关,然而关于CXCR4能否作为LABC患者新辅助化疗中的疗效指标和预后指标,目前却鲜有报道。本研究中,我们采用紫杉醇联合蒽环类的新辅助化疗方案治疗LABC,同时比较CXCR4低表达和高表达与疗效和远期生存的相关性。方法:对接受4个周期紫杉醇联合蒽环类的新辅助化疗方案进行治疗的86例ⅡB~ⅢB期(参照2002年AJCC乳腺癌TNM分期标准)LABC患者资料进行回顾性分析。用免疫组织化学法检测新辅助化疗前后乳腺癌组织CXCR4的表达,分析新辅助化疗对CXCR4低表达和CXCR4高表达患者的临床、病理疗效及其与远期生存的关系。结果:86例患者中58例(67.4%)为CXCR4高表达,28例(32.6%)为CXCR4低表达,新辅助化疗后,CXCR4高表达49例(57.0%),低表达37例(43.0%),化疗前后差异无统计学意义(P>0.05)。86例患者的肿瘤原发灶总有效率(ORR)为90.7%(78/86),其中临床完全缓解(cCR)占20.9%(18/86),部分缓解(PR)占69.8%(60/86),病情稳定(SD)占9.3%(8/86),病理完全缓解(pCR)占15.1%(13/86)。CXCR4低表达cCR为39.3%(11/28),pCR为28.6%(8/28),明显高于CXCR4高表达的cCR[12.07%(7/58)]和pCR[8.6%(5/58)](P<0.05)。新辅助化疗后,LABC患者CXCR4高表达的复发和死亡的相对风险分别是CXCR4低表达的2.923(95%CI:1.418~6.023,P=0.003 6)倍和3.364(95%CI:1.190~9.509,P=0.022 1)倍。CXCR4高表达5年无复发生存率(RFS)为34%,低于CXCR4低表达组(59%)(P=0.002 7),CXCR4高表达5年总体生存率(OS)为57%,低于CXCR4低表达组(68%)(P=0.013 9)。COX回归分析显示,高表达的CXCR4是LABC患者在新辅助化疗后一种新型的独立预后指标。结论:紫杉醇联合蒽环类的新辅助化疗方案在LABC的新辅助化疗中疗效显著,CXCR4低表达疗效更明显,更易获得cCR和pCR。新辅助化疗后,CXCR4高表达者远期生存明显低于CXCR4低表达者,复发和死亡的风险更大。CXCR4可作为预测新辅助化疗疗效和预后的一个重要参考指标。
乳腺癌; 趋化因子受体; CXCR4; 新辅助化疗
目前已经确立新辅助化疗(neo-adjuvant chemotherapy,NAC)在局部进展期乳腺癌(locally advanced breast cancer,LABC)治疗中的肯定地位[1],但仍有大量患者无法从中受益。趋化因子受体CXCR4是1种7次跨膜的G蛋白偶联受体,现已经被证实与包括乳腺癌在内的多种肿瘤侵袭和转移有关[2]。目前有学者对CXCR4的表达与乳腺癌新辅助化疗的疗效及预后相关因素之间的关系进行了研究,但是尚未形成一个统一的结论。本研究旨在比较乳腺癌新辅助化疗前后CXCR4的表达与新辅助化疗疗效之间的相互关系及预后研究,探讨CXCR4能否作为预测乳腺癌新辅助化疗疗效和预后有效指标,为临床治疗提供指导。
1 资料和方法
1.1 患者与肿瘤特征
选取2004年1月—2008年12月重庆医科大学附属第二医院乳腺外科收治的86例ⅡB~ⅢB期(参照2002年第六版AJCC乳腺癌TNM分期标准)LABC患者进行回顾性研究,患者均为女性,年龄30~75岁,中位年龄48岁,其中浸润性导管癌52例,浸润性小叶癌20例,单纯癌6例,硬癌4例,髓样癌4例。所有患者化疗前完成空芯针穿刺病理明确诊断,有可评价病灶,无炎性乳腺癌和远处转移。所有患者行新辅助化疗前均签署知情同意书,第1天接受蒽环类药物表柔比星60 mg/m2或吡柔比星45 mg/m2,静脉滴注;第二天紫杉醇175 mg/m2,静脉滴注3 h,每2周重复1次,共4个周期。化疗同时给予地塞米松、氯苯那敏及西咪替丁等辅助用药,以防胃肠道反应。4个周期化疗结束后14~21 d,接受乳腺癌改良根治术或根治术,其中改良根治术81例,根治术5例。所有患者的ER、PR和Her-2的免疫组织化学染色由本院病理科按照标准规程操作。术后给予规范化化疗、内分泌治疗及放疗。
1.2 CXCR4蛋白的检测方法及结果判定
全部病例新辅助化疗前穿刺活检取出的标本和乳腺癌术后的标本均用免疫组织化学法检测CXCR4的表达,CXCR4免疫组化染色试剂盒购自北京中杉金桥生物技术有限公司,按试剂盒热修复法操作。免疫组化结果判定:按肿瘤细胞阳性细胞率和着色强度分别进行记分。按阳性细胞百分率记分:≤5%为0分,>5%~25%为1分,>25%~50%为2分,>50%~75%为3分,>75%为4分。按着色强度记分并分为4个等级:无着色为0分,淡黄色为1分,黄色为2分,棕黄色为3分。两者积分乘积为0表示阴性(-),大于1为阳性,其中1~2表示弱阳性(+),3~4表示阳性(++),≥5为强阳性(+++)[3]。在本研究中,≤2分记为CXCR4低表达,>2分记为CXCR4高表达。
1.3 疗效评定标准
疗效按WHO制定的同一标准,肿瘤完全消失定义为临床完全缓解(complete clinical response,cCR),肿瘤体积缩小50%以上为部分缓解(partial response,PR),而肿瘤病灶体积缩小不超过50%或体积增大不足25%视为疾病稳定(stable disease,SD),肿瘤体积增大超过25%或出现新病灶则认为是疾病进展(progressive disease,PD),总有效率(overall response rate,ORR)为CR+PR患者所占百分比[4]。病理完全缓解(pathologic complete response,pCR)定义为原发肿瘤及区域淋巴结均无残留浸润性癌细胞,其中残留原位癌也包括在pCR组[5]。
1.4 随访
从治疗第1天开始计算,所有患者均随访至2010年12月。中位随访32(15~72)个月,40例出现复发或转移,其中21例因为肿瘤转移而死亡。复发指临床及组织学显示同侧乳腺区或区域淋巴结复发,远处转移指临床影像学检查显示有远处转移病灶。生存率指标采用5年无复发生存率(relapse-free survival,RFS)与总生存率(overall survival,OS),RFS指从手术后的第1天开始至第1次复发或末次随访为事件终点,在所随访观察的时间内未出现复发或转移为终检值;OS指从治疗第1天开始至死亡或末次随访为事件终点,生存、失访或死于其他疾病为终检值。
1.5 统计学处理
采用SPSS 13.0统计软件对数据资料进行统计分析,所有数据具体采用χ2检验、Fisher精确概率法、Spearman秩相关检验,Kaplan-Meier方法和COX比例风险回归模型分析患者生存情况,用Log-rank检验进行比较生存率比较,P<0.05为差异有统计学意义。
2 结 果
2.1 新辅助化疗前后乳腺癌组织中CXCR4表达的变化
新辅助化疗前,86例LABC患者乳腺癌组织中CXCR4蛋白高表达58例(图1);低表达28例(图2),高表达率为67.4%。按计划完成4个疗程的新辅助化疗后,乳腺癌组织中CXCR4蛋白高表达49例,低表达37例,高表达率为57.0% ,CXCR4由高表达转为低表达15例,CXCR4由低表达转为高表达6例,65例化疗前后CXCR4的表达无变化,表达率在化疗前后无明显变化(χ2=1.00,P>0.05)。
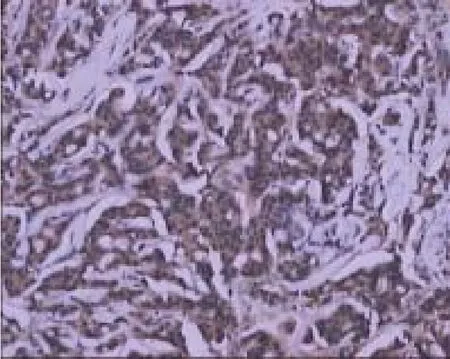
图 1 新辅助化疗前乳腺癌CXCR4高表达Fig. 1 CXCR4 high expression in breast cancer tissue of pre-NAC

图 2 新辅助化疗前乳腺癌CXCR4低表达Fig. 2 CXCR4 low expression in breast cancer tissue of pre-NAC
2.2 CXCR4的表达与化疗疗效
全部患者在新辅助化疗后均进行了疗效评估。ORR为90.7%(78/86),其中cCR占20.9%(18/86),临床部分缓解(PR)占69.77%(60/86),SD占9.3%(8/86),无进展病例。CXCR4低表达组的ORR与CXCR4高表达组的ORR差异无统计学意义(P>0.05)。CXCR4低表达组的cCR(39.3%)和pCR(28.6%)显著高于CXCR4高表达组的cCR(12.07%)和pCR(8.6%),两组间差异有统计学意义(P<0.05,表1)。

表 1 CXCR4的表达与新辅助化疗疗效Tab. 1 Response to neoadjuvant chemotherapy between patients with low CXCR4 and high CXCR4
2.3 新辅助化疗后CXCR4的表达与远期疗效及预后
用Kaplan-Meier生存分析发现:新辅助化疗后,CXCR4高表达的5年RFS为34%,远低于CXCR4低表达的5年RFS (59%)(P=0.002 7)。CXCR4高表达的5年OS为57%,也低于CXCR4低表达的5年OS(68%)(P=0.013 9)(图3、4)。
另外,我们通过Spearman秩相关检验发现,CXCR4的高表达与区域淋巴结状态两者之间无相关性(r=0.14,P=0.19)。同时,我们也比较了CXCR4的高表达是否与已知的临床病理因素有关,比如肿瘤大小、ER、PR、Her-2状态等,结果发现CXCR4高表达与肿瘤大小(P=0.278 1)、ER(P=0.643 7)、PR(P=0.532 6)及Her-2(P=0.337 4)也没有相关性,从而证明CXCR4的表达可能是一个独立的预测结果指标。
为了进一步证明在癌组织中高表达的CXCR4是一种LABC患者在新辅助化疗后新型的独立预后指标,我们对CXCR4高表达与已知的常见临床病理因素进行了COX比例风险模型比较癌症复发和死亡相对风险。新辅助化疗后,LABC患者CXCR4高表达的复发和死亡的相对风险分别是CXCR4低表达的2.923倍(95%CI:1.418~6.023,P=0.003 6)和3.364倍(95%CI:1.190~9.509,P=0.022 1);相比之下,淋巴结阳性的复发和死亡相对风险分别是淋巴结阴性的是2.346倍(95%CI:1.470~3.745,P=0.000 4)和3.055倍(95%CI:1.484~6.286,P=0.002 4)(表2、3)。


表 2 CXCR4与肿瘤的复发(COX比例风险模型)Tab. 2 CXCR4 and cancer recurrence (COX proportional hazard model)
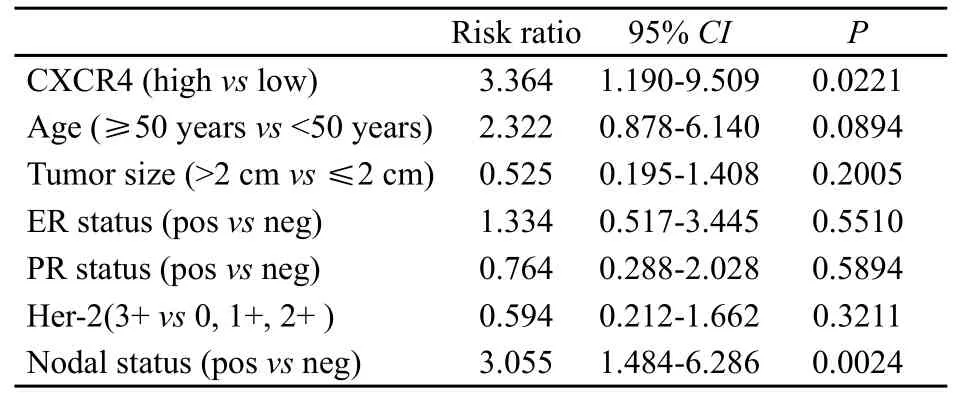
表 3 CXCR4与肿瘤相关的死亡(COX比例风险模型)Tab. 3 CXCR4 and cancer death (COX proportional hazard model)
3 讨 论
CXCR4属于GTP-蛋白偶联的7次跨膜受体,基质细胞衍生因子-1(stromal cell derived factor-1,SDF-1)是该受体的唯一配体。目前CXCR4已经被证实与多种癌症的侵袭和转移有关,包括乳腺癌[6-7]。Muller等[6]利用动物模型筛选了人类乳腺癌细胞中的17种趋化因子受体基因,发现CXCR4表达水平明显高于正常乳腺上皮细胞,并且通过研究发现在肝脏、骨骼及肺脏等器官中SDF-1有较高的表达,CXCR4通过与SDF-1的特异性结合形成复合物发挥作用,参与乳腺癌上述器官的转移。Schmid等[8]采用免疫组织化学方法的研究结果提示,CXCR4在非典型导管上皮增生、导管原位癌及导管原位癌伴浸润性癌均有表达,提示CXCR4可能是乳腺癌发生的早期分子事件。
新辅助化疗自上世纪70年代开始应用于LABC的临床治疗以来,迅速成为乳腺外科的研究热点[9]。近年来,新辅助化疗在LABC中的治疗作用得到了肯定,达到病理完全缓解者可提高生存率[10],因而,临床上能否找到可以预测新辅助化疗效果的指标显得日益重要。对于趋化因子受体CXCR4的表达与新辅助化疗疗效之间的相关性,蔡伟等[11]的研究认为,CXCR4在乳腺癌组织中表达的分布状态可作为新辅助化疗的疗效参考指标,CXCR4的表达呈簇状分布化疗疗效好于散在分布者。在我们的研究中发现,紫杉醇联合蒽环类的新辅助化疗方案在LABC的新辅助化疗中疗效显著,CXCR4低表达疗效更明显,更易获得cCR和pCR(P<0.05〉,证实紫杉醇联合蒽环类可能会使CXCR4低表达患者受益更多,CXCR4蛋白低表达的患者化疗有效率高。而化疗前后,CXCR4蛋白表达差异无统计学意义(P>0.05),说明新辅助化疗并不能显著降低CXCR4在乳腺癌组织中的表达水平。目前大量的研究发现,新辅助化疗后,LABC患者5年生存率仍然较低,在20%~55%不等[12-13]。区域淋巴结是否转移和能不能获得pCR是目前最重要的临床预后指标[14-15],除此之外,无论是临床或是生物学,目前几乎已经没有其他可用的预后指标。达到pCR者可提高生存率,但是研究发现只有8%~20%的LABC患者在新辅助化疗后能达到pCR,这就意味着对于大多数的LABC患者而言,预后的判断完全取决于患者的区域淋巴结状态。如果说能找到一个独立的预后判断因素,将会协助临床医师对高风险的识别,有针对性的更深入研究或新型的靶向治疗。然而关于在分子水平对LABC进行预测的研究很少,大部分都集中在传统的临床病理特征,如区域淋巴结,炎性乳腺癌,或是在新辅助化疗后较差的病理反应[16-17]。目前CXCR4与乳腺癌预后的关系上尚未有定论。Salvucci等[18]对1 808例浸润性乳腺癌和214例浸润前乳腺癌患者的分析表明,CXCR4的细胞质着色与肿瘤恶性度有关,并对疾病特异性生存有预后价值。Kang等[19]采用RT-PCR法对乳腺癌的研究发现CXCR4与乳腺癌预后不良有关。但是有些学者认为CXCR4与乳腺癌预后是没有关系的。很多学者对CXCR4的表达与乳腺癌新辅助化疗的疗效及预后相关因素之间的关系进行了研究,但是尚未形成统一的结论。Holm等[2]通过对54例LABC患者新辅助化疗后的研究认为,新辅助化疗后CXCR4的高表达预示着有更差的生存率。Hiller等[20]通过对17例LABC患者的研究认为,新辅助化疗后,CXCR4的表达可作为预测生存率的指标。在我们的研究中,对于接受新辅助化疗的LABC的患者来说,在新辅助化疗后,CXCX4高表达比低表达的患者有更差的生存率,除此之外,CXCR4高表达预示着复发相对危险度(RR=2.923,95%CI:1.418~6.023,P=0.0036)和癌症死亡相对危险度(RR=3.364,95%CI:1.190~9.509,P=0.0221)明显高,新辅助化疗后CXCR4的表达也似乎是一种比淋巴结状态更强的预测指标,这一结果与Holm等[2]的研究较为一致。这些发现具有极大的重要性,因为这是一个独立的预测结果指标,而且是一个比区域淋巴结状态更强的预测乳腺癌的结果指标。虽然我们的数据只有86例,但我们相信从这些数据产生的结果是可靠的,因为我们能够验证的结果是依赖于1个已经比较确定的预后指标:区域淋巴结状态。虽然本研究取得了一些进展,但是我们也不能夸大其重要性,CXCR4表达作为LABC患者在新辅助化疗预后指标还应通过未来的前瞻性临床试验。因此,本研究结果提示CXCR4的表达状态可能是预测新辅助化疗疗效和预后的1个重要的独立参考指标。
[1]FISHER B, MAMOUNAS E P. Preoperative chemotherapy: a model for studying the biology and therapy of primary breast cancer [J]. Clin Oncol, 1995, 13(3):537-540.
[2]HOLM N T, ABREO F, JOHNSON L W, et al. Elevated chemokine receptor CXCR4 expression in primary tumors following neoadjuvant chemotherapy predicts poor outcomes for patients with locally advanced breast cancer (LABC) [J].Breast Cancer Res Treat, 2009, 113(2): 293-299.
[3]许良中. 实用肿瘤病理方法学[M]. 上海: 上海人民出版社, 1997: 123-124.
[4]World Health Organization. World health organization handbook for reporting results of cancer treatment [S].(World Health Organization offset publication no.48.) Geneva:World Health Organization, 1979.
[5]SMITH I C, HEYS S D, HUTCHEON A W, et al. Neoadjuvant chemotherapy in breast cancer: significantly enhanced response with docetaxel[J]. J Clin Oncol, 2002, 20(6):1456-1466.
[6]MULLER A, HOMEY B, SOTO H, et al. Involvement of chemokine receptors in breast cancer metastasis [J].Nature, 2001, 410 (6824): 50-56.
[7]HOLM N, BYRNES K, LI B, et al. Elevated levels of chemokine receptor CXCR4 in Her-2 negative breast cancer specimens predict recurrence [J]. Surg Res, 2007, 141:53-59.
[8]SCHMID B C, RUDAS M, REZNICZEK G A, et al. CXCR4 is expressed in ductal carcinoma in situ of the breast and in atypicaI ductal hyperplasia [J]. Breast Cancer Res Treat,2004, 84: 247-250.
[9]DE-LENA M, ZUCALI R, VIGANOTTI G, et al. Combined hemotherapy-radiotherapy approach in locally advanced(T3b-T4) breast cancer [J]. Cancer Chemotherapy Pharmacol, 1978, 1(1): 53-59.
[10]BEAR H D, ANDERSON S, SMITH R E, et al. Sequential preoperative or postoperative docetaxel added to preoperative doxorubicin plus cyclophosphamide for operable breast cancer: National Surgical Adjuvant Breast and Bowel Project Protocol B-27 [J]. J Clin Oncol, 2006, 24(13): 2019-2027.
[11]蔡伟, 孙海晨. ET方案新辅助化疗对乳腺癌组织中CXCR4表达的影响及临床意义 [J]. 中国普外基础与临床杂志,2010, 17(8): 812-815.
[12]CANCE W G, CAREY L A, CALVO B F, et al. Long-term outcome of neoadjuvant therapy for locally advanced breast carcinoma: effective clinical downstaging allows breast preservation and predicts outstanding local control and survival [J]. Ann Surg, 2002, 236: 295-303.
[13]ALASSAS M, CHU Q, BURTON G, et al. Neoadjuvant chemotherapy in stage Ⅲ breast cancer [J]. Am Surgeon,2005, 71: 487-492.
[14]FISHER B, GUNDUZ N, SAFFER E A, et al. Influence of the interval between primary tumor removal and chemotherapy on kinetics and growth of metastases [J]. Cancer Res, 1983,43: 1488-1492.
[15]CAREY L A, METZGER R, DEES E C, et al. American Joint Committee on Cancer tumor-node-metastasis stage after neoadjuvant chemotherapy and breast cancer outcome [J].Natl Cancer Inst, 2005, 97: 1137-1142.
[16]PALANGIE T, MOSSERI V, MIHURA J, et al. Prognostic factors in inflammatory breast cancer and therapeutic implications [J]. Eur J Cancer, 1994, 30A: 921-927.
[17]HONKOOP A, VAN DIEST P, DE JONG J, et al. Prognostic role of clinical, pathological and biological characteristics in patients with locally advanced breast cancer [J]. Br J Cancer, 1998, 77: 621-626.
[18]SALVUCCI O, BOUCHARD A, BACCARELLI A, et al .The role of CXCR4 receptor expression in breast cancer: a large tissue microarray study [J]. Breast Cancer Res Treat, 2006,97(3): 275-283.
[19]KANG H, WATKINS G, PARR C, et al. Stromal cell derived factor-1: its influence on invasiveness and migration of breast cancer cellsin vitro, and its association with prognosis and survival in human breast cancer [J]. Breast Cancer Res,2005, 7(4): R402-R410.
[20]HILLER D J, LI B D, CHU Q D. CXCR4 as a predictive marker for locally advanced breast cancer post-neoadjuvant therapy [J]. J Surg Res, 2010, 166(1): 14-18.
Expression of chemokine receptor CXCR4 in locally advanced breast cancer patients with the efficacy and prognosis correlation of neoadjuvant chemotherapy
YANG Yong-de, YIN Guo-bing, ZENG Xiao-hua(Department General Surgery, the Second Hospital, Chongqing University of Medical Science, Chongqing 400010, China)
ZENG Xiao-hua E-mail:qq-zxh@126.com
Background and purpose:The effectiveness of neoadjuvant chemotherapy (NAC) in locally advanced breast cancer (LABC) has been proved and that pathologic complete response (pCR) after NAC could improve survival has been proved either. Regardless of treatment, the majority of patients with LABC continues to recur and die from this disease. A molecular predictor to predict the effect of NAC and identify at-risk patients is sorely needed.CXCR4 is a chemokine receptor that has been linked to breast cancer invasion and metastasis, but the mechanism of it's translating into clinical practice is still unclear. No study to date has examined the expression of CXCR4 as an indicator of the efficacy of NAC as a prognosticator for LABC patients who have undergone NAC. Therefore, we used taxanes and anthracyclines for LABC and compared the expression of CXCR4 before and after chemotherapy and the relationship of effectiveness and survival.Methods:Eighty-six patients with Ⅱb–Ⅲbstage LABC treated with 4 cycles of neoadjuvant taxanes and anthracyclines chemotherapy were included in this retrospective study. Expression of CXCR4 was analyzed by immunohistochemistry method. The clinical and pathologic response to neoadjuvant taxanes and anthracyclines chemotherapy, and the relationships of response and survival between high CXCR4 and low CXCR4 patients were analyzed.Results:Of the 86 patients, 28 (32.6%) with low the CXCR4 expression and 58 (67.4%) with high CXCR4 expression. After NAC, 37 (43.0%) had low CXCR4 expression, 49 (57.0%) had high CXCR4 expression,which showed no significant changes (P>0.05). The overall response rate (ORR) was 90.7% (78/86), including 20.9%clinical complete response (cCR) and 69.8% clinical partial response, and the pathologic complete response (pCR) was 15.1%. The cCR and pCR were 39.3% and 28.6% in patients with low CXCR4, significantly higher than that in patients with high CXCR4 respectively (12.07% and 8.6%) (P<0.05). After NAC, the relative risks for recurrence and death in the high CXCR4 group were 2.923-fold (95%CI: 1.418–6.023,P=0.0036) and 3.364-fold (95%CI: 1.190–9.509,P=0.0221) higher, respectively than those in the low CXCR4 group. High CXCR4 group had worse 5-year relapse-free survival (RFS) (34%) than that in low CXCR4 group (59%,P=0.0027). The 5-year overall survival (OS) was 57% for high CXCR4 and 68% for low CXCR4 (P=0.0139). COX proportional hazard model analysis further strengthened our hypothesis that high CXCR4 expression in cancer specimens following NAC is a novel independent prognostic indicator of poor cancer outcome in patients who had LABC.Conclusion:Patients with low CXCR4 are more sensitive to taxane and anthracycline neoadjuvant chemotherapy than those with high CXCR4. Patients with low CXCR4 have increased cCR and pCR rates compared with those with high CXCR4. After NAC, low CXCR4 patients have a good prognosis than those with high CXCR4. Detecting expression of CXCR4 in LABC tissue would be an important index for predicting the effects of NAC and as a prognosticator for LABC patients who have undergone NAC.
Breast cancer; Chemokine receptors; CXCR4; Neoadjuvant chemotherapy
10.3969/j.issn.1007-3969.2011.06.005
R737.9
A
1007-3639(2011)06-0446-06
曾晓华 E-mail:qq-zxh@126.com
2011-03-28
2011-05-15)
