齐墩果酸对阿霉素诱导的培养人皮肤角质形成细胞凋亡的影响
2011-05-28张兴洪刘彦群魏志平田美华
张兴洪,刘彦群,魏志平,田美华
(徐州医学院附属医院,徐州 221002)
化疗后脱发(chemotherapy-induced alopecia,CIA)是化疗药物常见的副作用之一,其机制在于化疗药物诱导生长期毛囊内细胞凋亡,导致生长期毛囊营养障碍,提前进入退行期[1]。生长期毛囊内角质形成细胞有较高的增殖率,故生长期毛囊极易受到许多化疗药物的强烈影响。由于毛囊内角质形成细胞的分离和纯化在技术上有一定难度,本研究以体外培养的人皮肤角质形成细胞为模型,探讨齐墩果酸(oleanolic acid,OA)对阿霉素诱导的人皮肤角质形成细胞凋亡的影响,为临床上防治化疗后脱发提供理论依据。
1 材料和方法
1.1 材料
1.1.1 标本来源 皮肤组织取自健康儿童包皮环切术切除的包皮。
1.1.2 主要试剂 Dispase酶(Sigma公司)、胰酶(Sigma公司)、K-FSM培养基(Gibco公司)、新生小牛血清(杭州四季青公司)、阿霉素(10mg/支,浙江海正制药股份有限公司)、四甲基偶氮唑(MTT)(Sigma公司)、二甲基亚砜(DMSO)(天津化学试剂厂)、OA(中国药品生物制品检验检定所)。
1.1.3 主要实验仪器 5%CO2细胞培养箱(美国Heraeus公司)、倒置显微镜 (Nikon公司)、酶标仪(奥地利CliniBio公司)、流式细胞仪(美国EPICS公司)、50mL细胞培养瓶和96孔培养板(Falcon公司)。
1.2 方法
1.2.1 人皮肤角质形成细胞制备和培养 参见文献[2]。
1.2.2 MTT法测定细胞增殖能力 实验分为4组。OA在临用前溶解于DMSO,配制成浓度为80mmol/L的原液,-20℃储存。使用时用KC-FSM培养液稀释成不同浓度的工作液。对数生长期的人皮肤角质形成细胞以4×103/孔接种于96孔培养板培养48h后,分别加入含 OA 0、20、40、80μmol/L 的 KC-FSM 培养液150μL,6h后每孔加入经预试验确定的3μmol/L阿霉素,6个复孔培养24 h后,每孔加四甲基偶氮唑蓝(MTT)溶液继续培养4 h终止培养,用MTT法测定细胞增殖能力,上述实验重复3次。
1.2.3 流式细胞仪测定细胞凋亡率 各组细胞经阿霉素处理24h后,用胰酶消化收集活细胞,PBS洗2遍,用70%乙醇固定过夜,用流式细胞仪测定1万个细胞,分析细胞凋亡率。
1.3 统计学处理 应用SPSS13.0统计软件进行统计学处理,统计变量以x±s表示,采用One-Way Anvoa的 Dunnett检验,α=0.05。
2 结果
2.1不同浓度的OA和3μmol/L阿霉素对细胞增殖的影响 见表1。
表1 不同浓度的OA和3μmol/L阿霉素对细胞增殖的影响(±s)

表1 不同浓度的OA和3μmol/L阿霉素对细胞增殖的影响(±s)
注:80μmol/L 组与 20μmol/L 组比较,*P<0.05。
A值0.331±0.007 0.372±0.006 0.423±0.006 0.483±0.006 OA浓度(μmol/L)0 20 40 80均差-0.04 0.092 0.152 0.112*P-<0.05<0.05<0.05<0.05*
2.2 流式细胞仪测定各组细胞凋亡率 细胞先经OA处理6h,然后再与3μmol/L阿霉素作用24h,各组细胞凋亡率,见表2和图1。
表2 不同浓度的OA和3μmol/L阿霉素对细胞凋亡的影响(±s)
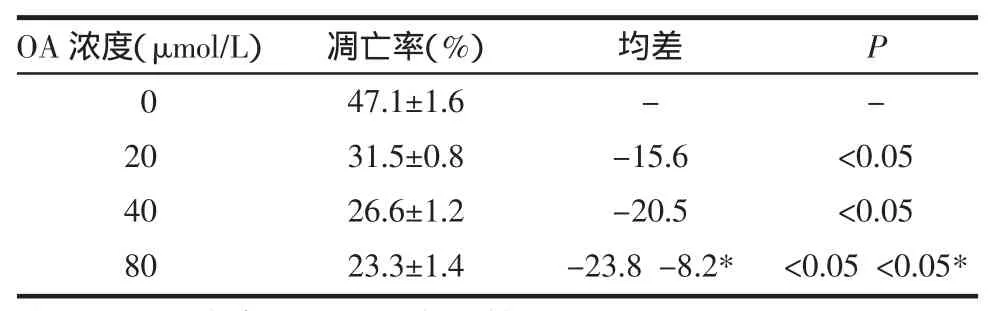
表2 不同浓度的OA和3μmol/L阿霉素对细胞凋亡的影响(±s)
注:80μmol/L 组与 20μmol/L 组比较,*P<0.05。
凋亡率(%)47.1±1.6 31.5±0.8 26.6±1.2 23.3±1.4 OA浓度(μmol/L)0 20 40 80均差--15.6-20.5-23.8-8.2*P-<0.05<0.05<0.05<0.05*

图1 不同浓度的OA和3μmol/L阿霉素对细胞凋亡的影响
3 讨论
阿霉素能抑制细胞DNA和RNA的生物合成,促使细胞有丝分裂停止而发生凋亡或死亡。阿霉素引起的脱发是一种典型的生长期脱发,是化疗过程中常见副作用之一,其机制在于其诱导生长期毛囊内细胞凋亡,导致生长期毛囊营养障碍,提前进入退行期。Schilli等[1]以C57BL/6小鼠为模型,研究环磷酰胺诱导的小鼠生长期毛囊内细胞凋亡,发现凋亡主要发生在毛球部的角质形成细胞。因此采取措施抑制或减轻化疗药物诱导的生长期毛囊内角质形成细胞凋亡,延缓生长期毛囊进入退行期,是防治此类脱发的一个策略。
齐墩果酸是一种五环三萜类化合物,研究表明其具有消炎、增强免疫、抑制血小板聚集、降糖等多方面的临床药理作用,是治疗急性黄胆型肝炎和慢性病毒性肝炎比较理想的药物。且毒性低,副作用少。此外,OA可作为抗癌辅助药物,该药可抑制恶性肿瘤化疗造成的免疫功能下降,还可抑制抗肿瘤药所致的的肝损害。宫新江等[3]研究齐墩果酸抗环磷酰胺所致大鼠肝细胞损伤作用时发现,OA能抑制酶的渗出,以谷草转氨酶和乳酸脱氢酶最为显著,升高受损伤肝细胞的活力。
我们以培养的人皮肤角质形成细胞为模型,研究OA对阿霉素诱导的培养人皮肤角质形成细胞凋亡的影响,与对照组比较,20、40和80μmol/L 3种剂量的OA均能有效减轻阿霉素对角质形成细胞增殖的抑制,细胞凋亡率明显下降(P<0.05),随着OA浓度的升高,抗凋亡作用增强,80μmol/L组的作用强于20μmol/L组(P<0.05),提示适当剂量的OA能一定程度减轻阿霉素对细胞的损伤,表现出对阿霉素致凋亡的保护作用。我们推测其机制可能与OA的解毒功能、稳定细胞膜[4]、抑制氧自由基的生成和释放[5]有关。其涉及的复杂分子调控机制有待于我们进一步研究。
[1] SchilliMB,PausR,Menrad A.Reduction of intrafollicularapoptosis in chemotherapy-induced alopecia by topical calcitriol-analogs[J].J InvestDermatol,1998,111:598-604.
[2] 陈勇,戴和平,龙志高,等.人皮肤角质形成细胞的分离与原代无血清培养[J].湖南医科大学学报,2003,28(5):481-484.
[3] 宫新江,丁虹,邱银生,等.齐墩果酸抗环磷酰胺所致大鼠肝细胞损伤作用[J].医药导报,2006,25(11):1114-1116.
[4] Lahouel M,Boulkour S,Segueni N,et al.The flavonoids effect against vinblastine,cyclophosphamide and paracetamol toxicity by inhibition of lipid-peroxydation and increasing liver glutathione concentration[J].PatholBiol,2004,52:314-322.
[5] 张杰,许仄平,孙宏斌,等.大鼠肝脏缺血-再灌注损伤时齐墩果酸对氧自由基的影响[J].临床麻醉学杂志,2009,25(5):428-430.
