低分子量肝素对博来霉素诱导的大鼠肺纤维化的干预作用
2011-05-28柴燕玲杜俊毅牛小群吴文娟
柴燕玲,杜俊毅,张 涛,牛小群,吴文娟,曹 宇
(昆明医学院第二附属医院 呼吸内科,云南 昆明 650101)
肺纤维化是一种发病隐匿、进展迅速、病死率高,且治疗效果欠佳的慢性肺部疾患。以肺泡间质炎症细胞浸润(中性粒细胞、单核/巨噬细胞、淋巴细胞)、纤维母细胞增生和细胞外基质(Extracellular Matrix,ECM)进行性沉积为主要特征。本研究利用博莱霉素诱导的大鼠肺纤维化模型,观察LMWH对大鼠肺组织中TGF-β1水平变化的影响,并与地塞米松作比较,探讨LMWH对肺纤维化的保护作用。
材料和方法
一、材料和试剂 健康SPF级雄性SD大鼠100只,体重220~260g,购自昆明医学院实验动物中心。注射用盐酸博来霉素粉剂(日本化药株式会社,15mg/支,批号191130),10%水合氯醛(昆明医学院动物中心提供),低分子量肝素钠(昆明积大制药有限公司,批号080501),地塞米松(山东新华制药股份有限公司,批号0907041),大鼠TGF-β1 ELISA试剂盒 (Santa Cruz),兔抗大鼠TGF-β1多克隆抗体(Santa Cruz),第2代通用型二步法检测系统(pv-9000)(北京中杉金桥),羟脯氨酸碱水法测试盒(南京建成生物工程研究所)。
二、方法 1.模型的建立和分组:将动物随机分配分成4组,每组25只。健康对照组,参照Szapiel等[1]的方法气管内注入生理盐水代替博来霉素。肺纤维化模型组,气管内注入博来霉素(按5 mg/kg比例溶于0.2~0.3ml生理盐水中)。地塞米松干预组,造模当日予以每日地塞米松腹腔注射(1 mg/kg)。LMWH干预组,造模当日起开始每天给予低分子肝素1000单位肌肉注射。各组随机分别于造模后第1,3,7,14及28d各处死大鼠5只。
2.肺组织标本制备:各组大鼠予以10%水合氯醛(3.8ml/kg)腹腔注射麻醉,剪开腹腔,腹主动脉采血,剪开胸腔,分离气管和肺脏,右侧肺脏用手术缝合线结扎,左肺行支气管肺泡灌洗术(参照史菲等[2]的方法)。BALF存于-80℃保存,供测TGF-β1用。取右肺下叶10%福尔马林溶液内固定后放入10%福尔马林溶液内固定,经脱水、石蜡包埋、切片,行TGF-β1免疫组化检查;右肺上叶保存于-70℃低温冰箱,用碱水解法检测羟脯氨酸含量。
3.TGF-β1的检测:ELISA法检测BALF中TGF-β1蛋白量,根据试剂盒提供的方法进行反应,终止反应后用酶联仪测492nm光密度(OD),结果与标准曲线比较确定TGF-β1含量。
4.免疫组化检测肺组织TGF-β1:常规脱蜡、水化、阻断内源性过氧化物酶;抗原修复;5%BSA封闭;一抗,兔抗大鼠TGF-β1多克隆抗体1∶300(抗体为胞浆表达);二抗,辣根酶标记羊抗兔IgG多聚体;DAB显色;常规苏木素复染、盐酸酒精分化、返蓝、脱水、透明、封片。免疫组化染色结果应用HP1000彩色图文病理分析系统(湖北千屏影像有限公司)进行分析,将肺组织各时点切片随机取染色区域5个高倍视野(×400),测量并记录每个视野阳性染色的平均积分光密度(IOD)值。
5.肺组织羟脯氨酸测定(碱水法):羟脯氨酸的测定采用南京建成生物技术公司的碱水解试剂盒,按照产品说明书进行操作。
6.统计学处理:应用SPSS11.5统计软件进行分析,计量数据资料以表示,采用单因素方差分析方法,组间差别采用SNK检验。P<0.05为差异有统计学意义。
结 果
一、大鼠肺组织大体观察 对照组大鼠肺组织呈粉红色,表面光滑有光泽,质地柔软,弹性良好。模型组大鼠肺组织颜色暗红,弹性降低,质地较硬,肺叶肿胀,早期双肺叶可见散在出血病灶,后期双肺组织出现灰白色的小结节。2个干预组肺组织肿胀程度较模型组为轻,早期亦可见肺叶出血病灶,但后期肺组织灰白色小结节较少。
二、肺组织TGF-β1的表达 TGF-β1主要表达在胞浆,主要表达的细胞有肺泡巨噬细胞、肺泡上皮细胞、肺成纤维细胞、支气管粘膜上皮细胞。TGF-β1在对照组肺组织均为弱表达。模型组和干预组的TGF-β1表达较对照组有明显增加(P<0.05)。干预组TGF-β1表达均较模型组降低(P<0.05),其中LMWH组第28d TGF-β1表达地塞米松组显著降低(P<0.05)。结果见表1。
三、血清及肺泡灌洗液TGF-β1含量变化 第7、14、28d模型组和干预组的血清TGF-β1含量较对照组有明显增加(P<0.05),干预组TGF-β1表达均较模型组降低(P<0.05),其中LMWH组第14d TGF-β1表达较地塞米松组显著降低(P<0.05)。BALF的TGF-β1含量变化与血清一致。结果见表2。
四、肺组织羟脯氨酸的变化 气管内滴入博来霉素后,模型组肺组织羟脯氨酸含量明显升高(P<0.05),采用地塞米松和LMWH治疗后明显降低(P<0.05),与模型组相比,地塞米松和LMWH均明显降低HYP的含量(P<0.05),且LMWH的作用较地塞米松更为显著(第28d,P<0.05)。如表3所示。
讨 论
肺纤维化是一种以间质纤维化及肺脏毁损为特征的疾病,是多种弥漫性肺间质疾病的最终转归。其发病机制仍不十分明确,目前尚无特效药物治疗,临床预后差。本研究采用肺纤维化的最经典博来霉素大鼠损伤模型[3,4],来研究LMWH对肺间质纤维化的干预作用及相关机制。
表1 肺组织 TGF-β1 的表达 (,n=5)
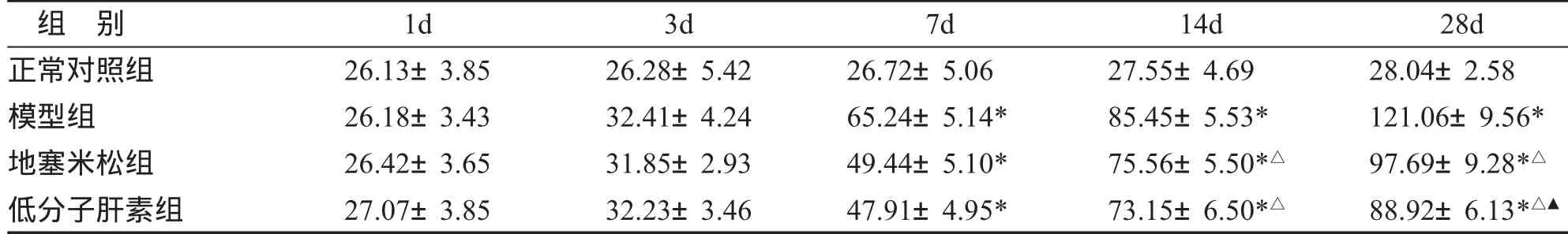
表1 肺组织 TGF-β1 的表达 (,n=5)
与正常对照组比较,*P<0.05;与模型组比较,△P<0.05;与地塞米松组比较,▲P<0.05。
组 别1d3d7d14d 28d正常对照组26.13±3.8526.28±5.4226.72±5.0627.55±4.69 28.04±2.58模型组26.18±3.4332.41±4.2465.24±5.14*85.45±5.53* 121.06±9.56*地塞米松组26.42±3.6531.85±2.9349.44±5.10*75.56±5.50*△ 97.69±9.28*△低分子肝素组27.07±3.8532.23±3.4647.91±4.95*73.15±6.50*△ 88.92±6.13*△▲
表2 各组血清及肺泡灌洗液TGF-β1含量的比较(,pg/ml,n=5)

表2 各组血清及肺泡灌洗液TGF-β1含量的比较(,pg/ml,n=5)
与正常对照组比较,*P<0.05;与模型组比较,△P<0.05;与地塞米松组比较,▲P<0.05。
组 别1d 3d 7d 14d 28d血清正常对照组169.52±12.98172.21±28.83176.72±29.10185.84±15.98 198.74±14.43模型组174.87±30.48201.61±29.11357.66±36.16*410.03±45.16* 510.65±60.99*地塞米松组 181.00±20.49 182.90±43.68 256.35±50.89*△ 359.51±53.97*△ 403.64±40.57*△低分子肝素组 179.18±23.29 199.41±32.86 265.08±45.19*△ 313.41±34.42*△▲ 368.76±39.60*△BALF正常对照组 18.81±2.16 19.56±2.27 20.82±1.79 20.79±2.67 23.44±3.69模型组 18.91±1.84 28.55±5.44 48.94±4.96* 69.53±6.46* 88.00±5.39*地塞米松组 19.29±2.23 25.72±3.52 39.22±4.87*△ 58.81±8.14*△ 77.96±9.54*△低分子肝素组19.31±2.2827.01±3.4640.45±3.97*△49.16±5.86*△▲ 69.79±8.47*△
表3 各组肺组织羟脯氨酸含量的影响(,μg/mg,n=5)
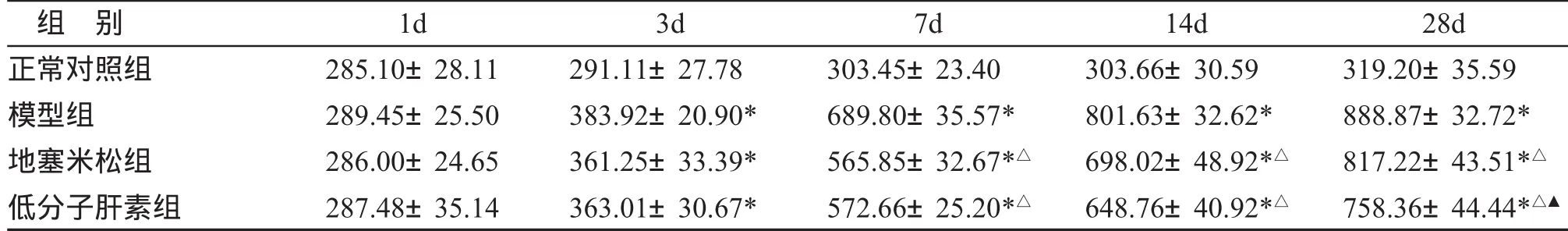
表3 各组肺组织羟脯氨酸含量的影响(,μg/mg,n=5)
与正常对照组比较,*P<0.05;与模型组比较,△P<0.05;与地塞米松组比较,▲P<0.05。
组 别1d3d7d14d 28d正常对照组285.10±28.11291.11±27.78303.45±23.40303.66±30.59 319.20±35.59模型组289.45±25.50383.92±20.90*689.80±35.57*801.63±32.62* 888.87±32.72*地塞米松组286.00±24.65361.25±33.39*565.85±32.67*△698.02±48.92*△ 817.22±43.51*△低分子肝素组287.48±35.14363.01±30.67*572.66±25.20*△648.76±40.92*△ 758.36±44.44*△▲
肺纤维化的确切发病机制目前尚不清楚。动物实验和临床研究表明,细胞因子在肺纤维化的发生发展中起着关键作用。此类细胞因子有转化生长因子(TGF-β),血小板源性生长因子(PDGF),肿瘤坏死因子(TNF-α,β,γ),白介素(IL-1、6、8),成纤维细胞生长因子(FGF),胰岛素样生长因子(IGF),结缔组织生长因子(CTGF)等[5-7]。TGF-β是致纤维化关键性的细胞因子,在其中起着重要的作用。TGF-β是研究最深入、作用最重要的细胞因子。TGF-β 3种异构型(TGF-β1,TGF-β2,TGF-β3)的生物学特征基本相同,其中TGF-β1与肺纤维化的关系最为密切,这在运用TGF-β1抗体减弱博来霉素诱导的肺纤维化试验和特异性纤维性肺疾病的病人检测到TGF-β1的合成增加的事实中得到证实[8]。TGF-β是一种生物学功能复杂的细胞因子,参与调控细胞增殖、分化、凋亡、黏附和运动及ECM的分泌,是组织生长、修复、增殖的重要因子,也是肺纤维化发生过程中最直接的细胞因子。TGF-β1是一个强大的细胞增殖调节剂,通过血小板衍生生长因子可促进肺成纤维细胞增殖。TGF-β1对于结构细胞如成纤维细胞有很重要的直接作用,是最重要的ECM蛋白刺激因子之一,被TGF-β1激活的成纤维细胞能促进PGs在肺内异常沉积[9]。
研究发现,肺纤维化急性加重时,患者血浆D-二聚体明显升高[10]。由于D-二聚体是血管内凝血的标志,因此认为肺纤维患者凝血机制激活。可见,肺组织微血管内外微环境促凝和抗纤溶活性升高是肺纤维化发病的重要环节之一。有研究表明,肺纤维化的发病机制与肺内微环境凝血机制异常有关。Kubo H等[10]对5家医院的56例患者进行了前瞻性抗凝治疗研究,该试验显示抗凝治疗可以延长肺纤维化患者中位生存天数,改善患者预后。但对于抗凝治疗改善预后的具体机制尚不清楚。
目前,对抗凝治疗肺纤维化取得疗效的确切机制尚不清楚,可能与其对血管内外微环境的抗凝作用有关。抗凝治疗可减少细胞外纤维素沉积,提高ECM降解,促进肺泡上皮细胞正常修复,凝血级联反应抑制可减少与纤维化发生有关的产物及因子生成。并且,低分子肝素可下调参与肺纤维维化的TGF-β1,内皮素1(ET-1),纤维母细胞生长因子1(FGF-1)的表达[11]。
通过本研究发现,LMWH对博来霉素诱发的大鼠肺间质纤维化具有保护作用。其可能是通过下调TGF-β1的表达而实现的,其具体作用机制有待于进一步深入研究。
[1]SZAPIELSV,ELSON NA,FULMER JD,et al.Bleomycin-induced interstitial pulmonary disease in the nude,athymic mouse[J].AmRevRespir Dis,1979,120:893-899.
[2]史菲,邱晨.大鼠支气管灌洗术标准化操作的探讨[J].中国现代医学杂志,2002,12(24):67-69.
[3]MOELLER A,RODRIGUEZ-LECOMPTE JC,WANGL,et al.Models of pulmonary fibtosis[J].Drug Discovery Today,2006,3(3):243-250.
[4]THRALL RS,MCCORMICK JR,JACK RM,et al.Bleomycininduced pulmonary fibrosis in the rat[J].Am J Pathol,1979,95(1):117-130.
[5]ASK K,BONNIAUD P,MAASS K,et al.Progressive pulmonary fibrosis is mediated by TGF-beta isoform 1 but not TGF-brta3[J].Int J Biochem Cell Biol,2008,40(3):484-495.
[6]CAO B,GUO Z,ZHU Y,et al.The potential role of PDGF,IGF-1,TGF-beta expression in idiopathic pul monary fibrosis[J].Chin Med J(Engl),2000,113(9):776-782.
[7]KANGHR,CHOSJ,LEE CG,et al.Transforminggrowth factor(TGF)-beta1 stimulates pulmonary fibrosis and inflammation via a Bax-dependent,bid-activated pathway that involves matrix metalloproteinase-12[J].J Biol Chem,2007,282(10):7723-7732.
[8]WALKER TR,MOORE SM,MARK F,et al.Platelet-gerived growth factor-BB and thrombin active phosphoinositide 3-kinase and protein kinase B:role in mediating airway smooth muscle proliferation[J].Mol Pharmacol,1998,54:1007-1015.
[9]VENKATESAN N,ROUGHLEY PJ,LUDWIG MS.Proteoglycan expression in bleomycin lung fibroblasts:role of transforming growth factor-β1 and interferon-γ[J].Am J Physiol LungCell Mol Physiol,2002,283(4):806-814.
[10]KUBO H,NAKAYAMA K,YANAI M,et al.Anticoagulant therapy for idiopathic pulmonary fibrosis[J].Chest,2005,128(3):1475-1482.
[11]LI CM,KHOSLA J,HOYLE P,et al.Transforming growth factor-β1 modifies fibroblast growth factor-2 production in type II cells[J].Chest,2001,120(1):60-61.
