柿叶总黄酮对高脂血症大鼠血脂和血液流变学的影响
2011-05-25梁宇红裴世成
陈 丽, 梁宇红, 裴世成, 韦 敏
(1.柳州医学高等专科学校药学教研室,广西 柳州 545006;2.柳州市工人医院临床药学科,广西 柳州 545005;3.柳州市人民医院药剂科,广西柳州 545005)
柿叶总黄酮对高脂血症大鼠血脂和血液流变学的影响
陈 丽1, 梁宇红2, 裴世成1, 韦 敏3
(1.柳州医学高等专科学校药学教研室,广西 柳州 545006;2.柳州市工人医院临床药学科,广西 柳州 545005;3.柳州市人民医院药剂科,广西柳州 545005)
目的 研究柿叶总黄酮对饮食性高脂血症大鼠血脂及血液流变学的影响。方法 建立饮食性高脂血症大鼠模型,将高脂血症大鼠按照血清TC水平随机分成高脂模型组、柿叶总黄酮高剂量组、柿叶总黄酮中剂量组、柿叶总黄酮低剂量组和洛伐他汀组5组(10只/组),每组雌雄各半,连续给药4周后检测各组大鼠血脂水平和血液流变学各项指标。结果与高脂模型组比较,各用药组TC、TG、LDL-C、apoB、AI水平降低,apoA I、HDL-C、apoA I/apoB水平升高均具有显著性差异(P<0.01或P<0.05);各给药组全血黏度(高、中、低切)、血浆黏度、红细胞压积(HCT)显著降低(P<0.01或P<0.05)。结论 柿叶总黄酮对高脂血症大鼠的脂质代谢紊乱有显著的调节作用,对防治高脂血症和改善血液流变学有积极的意义。
柿叶;总黄酮;高脂血症大鼠;血脂;血液流变学
柿叶为柿科植物柿(Diospyros kakiL.)的干燥叶,主要的有效成分是黄酮类化合物。近年来大量药理学实验研究表明,黄酮类化合物有降脂、抗血栓、抗氧化[1]、抗衰老、清除自由基[2]等作用,因而广泛用于医药、食品等行业,具有极广的开发应用前景。本实验建立饮食性高脂血症大鼠模型,研究柿叶总黄酮对其血脂和血液流变学的影响,为其进一步开发应用提供实验依据和理论基础。
1 材料
1.1 动物 健康SD大鼠60只,雌雄各半,体质量180~200 g,清洁级动物,由广西医科大学实验动物中心提供(实验动物生产许可证:SCXK(桂)2008-0003,实验动物使用许可证:SYXK(桂)2008-0005)。
1.2 药品与试剂 柿叶总黄酮由实验室自行提取:柿叶粗粉加70%乙醇回流提取,提取液减压浓缩,用20%NaOH调pH至9到10左右后用石油醚萃取除去叶绿素,弃醚相,水相用15%HCl调pH至5到6后再用乙酸乙酯反复萃取,弃水相,乙酸乙酯相浓缩干燥后得总黄酮,以芦丁为标准品,测得含黄酮量为65.84%,得率为1.08%;胆固醇(国药集团化学试剂有限公司,规格:25 g/瓶,分析纯,批号:F20081110);猪胆盐(国药集团化学试剂有限公司,规格:25 g/瓶,生化试剂,批号:F20090517);洛伐他汀(扬子江药业集团有限公司,规格:20 mg/片,批号:09122401);丙基硫氧嘧啶片(上海复星朝晖药业有限公司,批号:20090202)。
1.3 仪器设备 RE-52旋转式蒸发器(上海安亭实验仪器有限公司);722S可见分光光度计(上海精密科学仪器有限责任公司);全自动生化分析仪(日本OLYMPUS AU600型);血液流变学分析仪(LBY-N6A型,北京普利生仪器中心)。
1.4 高脂饲料的配制 基础饲料83.6%,胆固醇1%,猪胆盐0.2%,丙基硫氧嘧啶 0.2%,猪油 12%,蛋黄粉 3%[3-4]。按比例先将胆固醇、猪胆盐、丙基硫氧嘧啶、蛋黄粉研碎混合,然后加入温热的猪油中,再与基础饲料拌匀即得。
2 方法与结果
2.1 高脂血症模型建立及分组 选取60只健康SD大鼠,体质量180~200 g,雌雄各半。适应性饲养7 d后,禁食不禁水12 h,于次日晨眼内眦采血1 mL左右,制备血清,测定各大鼠的 TC、TG、HDL-C、LDL-C、apoAI及 apoB 以观察其血脂基础值,然后按TC水平从低到高排列,查随机数字表,随机抽取10只作为空白组,雌雄各半,实验全程喂饲基础饲料。其余50只大鼠喂饲高脂饲料6周,诱导建立饮食性高脂血症大鼠模型。6周后禁食不禁水12 h,于次日晨眼内眦采血1 mL左右,制备血清,测定各大鼠的 TC、TG、HDL-C、LDL-C、apoAI及apoB水平,与造模前的血脂水平进行比较,造模成功后将高脂血症大鼠按TC水平从低到高排列,查随机数字表,随机分成高脂模型、柿叶总黄酮高剂量、柿叶总黄酮中剂量、柿叶总黄酮低剂量和洛伐他汀5个组,每组10只,雌雄各半。给药期间,空白组喂饲基础饲料,其余各组仍喂饲高脂饲料。空白组和高脂模型组每天灌服空白溶剂15 mL/kg,柿叶总黄酮给药组每天灌服柿叶总黄酮100、50、25 mg/kg,阳性对照组每天灌服洛伐他汀3.0 mg/kg,连续4周。
2.2 造模期间大鼠摄食量及体质量变化 整个实验期间每天定时、定量喂饲,次日称取剩余量,计算大鼠每日摄食量,每周同一时间称取大鼠体质量,以便调整给药剂量,并观察药物是否影响大鼠的生长。结果显示,空白组与高脂造模型组大鼠第1~5周时体质量增长无显著性差异,但造模第6周时两组之间体质量有显著性差异(P<0.05)。说明高脂造模型组体质量增长较快。造模期间各组大鼠生长状况良好,活动正常。
表1 造模期间大鼠摄食量和体质量变化(±s)
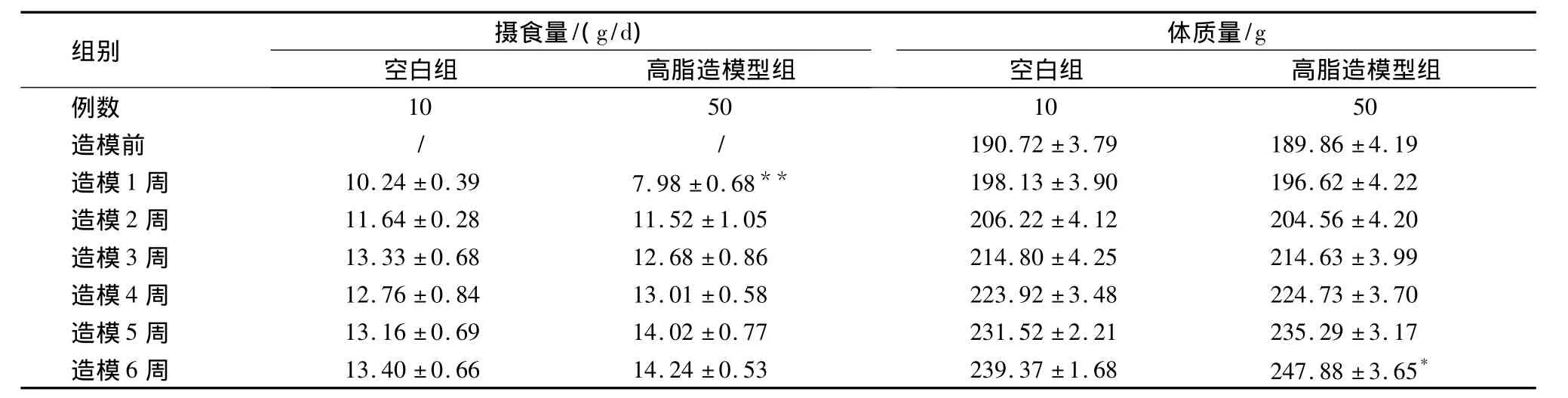
表1 造模期间大鼠摄食量和体质量变化(±s)
注:与空白组比较*P <0.05,**P <0.01。
组别 摄食量/(g/d)体质量/g空白组 高脂造模型组例数空白组 高脂造模型组10 50 10 50造模前 / / 190.72 ±3.79 189.86 ±4.19造模1 周 10.24±0.39 7.98±0.68** 198.13±3.90 196.62±4.22造模2 周 11.64 ±0.28 11.52 ±1.05 206.22 ±4.12 204.56 ±4.20造模3 周 13.33 ±0.68 12.68 ±0.86 214.80 ±4.25 214.63 ±3.99造模4 周 12.76 ±0.84 13.01 ±0.58 223.92 ±3.48 224.73 ±3.70造模5 周 13.16 ±0.69 14.02 ±0.77 231.52 ±2.21 235.29 ±3.17造模6 周 13.40 ±0.66 14.24 ±0.53 239.37 ±1.68 247.88 ±3.65*
2.3 柿叶总黄酮对高脂血症大鼠摄食量和体质量的影响表2、表3可见给药后各组大鼠摄食量和体质量无显著性差异。说明空白组、高脂模型组和各给药组大鼠并没有因为食物不同而产生不适应性,从而导致食欲下降,给药组的降脂作用途径并不是通过抑制大鼠的食欲来实现的。所以,本实验评价柿叶总黄酮改善血脂、血流变学的结果是可靠的。
表2 给药期间大鼠摄食量变化(±s,n=10)
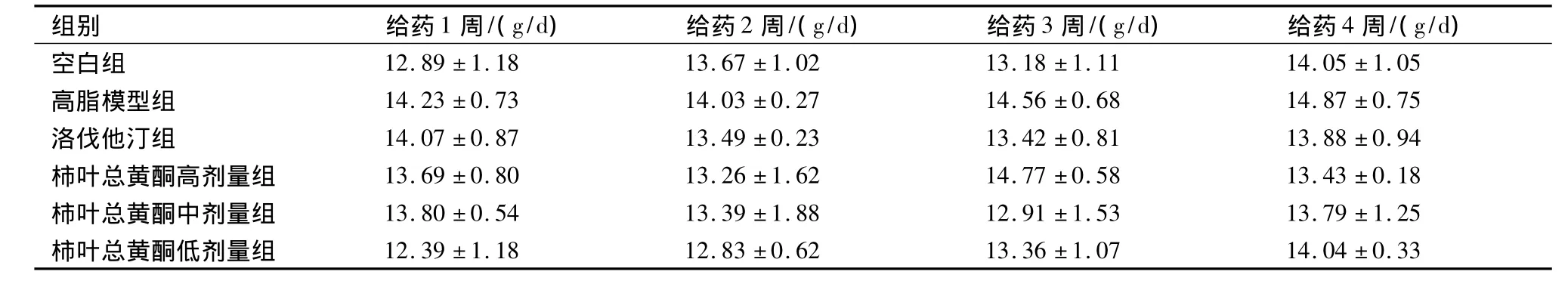
表2 给药期间大鼠摄食量变化(±s,n=10)
组别 给药1周/(g/d) 给药2周/(g/d) 给药3周/(g/d) 给药4周/(g/d)空白组 12.89 ±1.18 13.67 ±1.02 13.18 ±1.11 14.05 ±1.05高脂模型组 14.23 ±0.73 14.03 ±0.27 14.56 ±0.68 14.87 ±0.75洛伐他汀组 14.07 ±0.87 13.49 ±0.23 13.42 ±0.81 13.88 ±0.94柿叶总黄酮高剂量组 13.69 ±0.80 13.26 ±1.62 14.77 ±0.58 13.43 ±0.18柿叶总黄酮中剂量组 13.80 ±0.54 13.39 ±1.88 12.91 ±1.53 13.79 ±1.25柿叶总黄酮低剂量组 12.39 ±1.18 12.83 ±0.62 13.36 ±1.07 14.04 ±0.33
表3 给药期间大鼠体质量变化(±s,n=10)
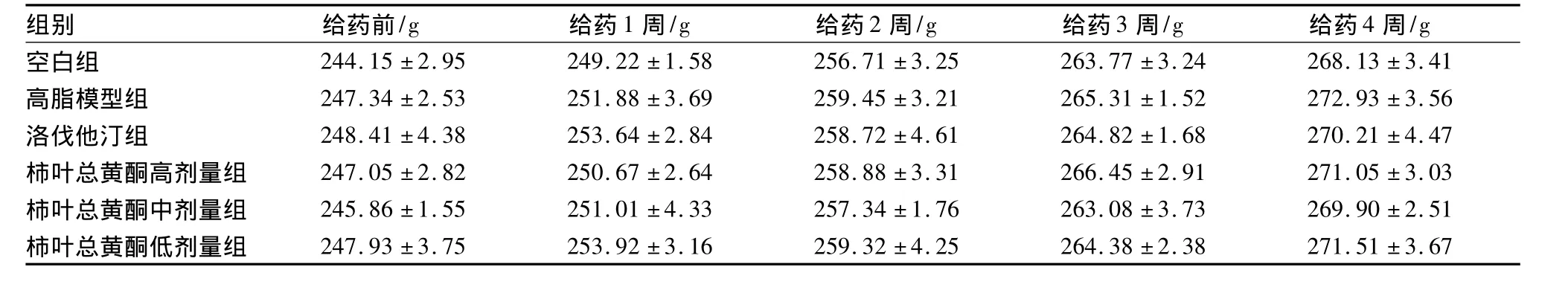
表3 给药期间大鼠体质量变化(±s,n=10)
组别 给药前/g 给药1周/g 给药2周/g 给药3周/g 给药4周/g空白组 244.15 ±2.95 249.22 ±1.58 256.71 ±3.25 263.77±3.24 268.13 ±3.41高脂模型组 247.34 ±2.53 251.88 ±3.69 259.45 ±3.21 265.31 ±1.52 272.93 ±3.56洛伐他汀组 248.41 ±4.38 253.64 ±2.84 258.72 ±4.61 264.82 ±1.68 270.21 ±4.47柿叶总黄酮高剂量组 247.05 ±2.82 250.67 ±2.64 258.88 ±3.31 266.45 ±2.91 271.05 ±3.03柿叶总黄酮中剂量组 245.86 ±1.55 251.01 ±4.33 257.34 ±1.76 263.08 ±3.73 269.90 ±2.51柿叶总黄酮低剂量组 247.93 ±3.75 253.92 ±3.16 259.32 ±4.25 264.38±2.38 271.51 ±3.67
2.4 柿叶总黄酮对高脂血症大鼠血脂水平和血液流变学的影响 灌胃4周后,禁食不禁水12 h,次日晨称体质量,用20%乌拉坦溶液腹腔麻醉后腹主动脉取血5 mL。其中1 mL装入不加抗凝剂的离心管中,4℃静置10 min,3 000 r/min离心15 min,分离血清,用全自动生化仪检测TC、TG、HDLC、LDL-C水平(见表4),以及载脂蛋白apoA I和apoB水平(见表5);其余4 mL血装入已加抗凝剂肝素的试管中,用血液流变学分析仪检测全血黏度(高、中、低切)、血浆黏度和HCT等血液流变学指标(见表6、7)。
2.5 柿叶总黄酮对高脂血症大鼠动脉硬化指数(AI)的影响 根据单项的血清TC和HDL-C含量,计算AI,AI=(TC-HDL-C)/HDL-C,结果见表8。
2.6 统计学处理 采用统计学软件SPSS 13.0对所有数据进行分析,结果以均数±标准差(±s)表示。组间分析采用One-Way ANOVA两两比较得到相应的P值,同组样本前后比较采用Pared-Sample T Test。P<0.05或P<0.01差异显著,有统计学意义。
表4 给药4周后各组大鼠TC、TG、HDL-C和LDL-C的变化(±s,n=10)
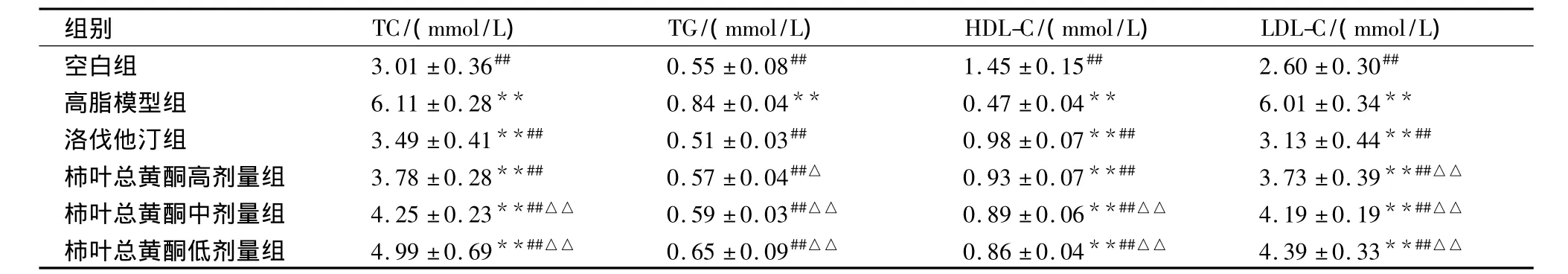
表4 给药4周后各组大鼠TC、TG、HDL-C和LDL-C的变化(±s,n=10)
注:与空白组比较,*P <0.05,**P <0. 01;与高脂模型组比较,#P <0.05,##P <0. 01;与洛伐他汀组比较,△P <0.05,△△P <0.01。
组别 TC/(mmol/L) TG/(mmol/L) HDL-C/(mmol/L) LDL-C/(mmol/L)空白组 3.01 ±0.36## 0.55 ±0.08## 1.45 ±0.15## 2.60 ±0.30##高脂模型组 6.11±0.28** 0.84±0.04** 0.47±0.04** 6.01±0.34**洛伐他汀组 3.49 ±0.41**## 0.51 ±0.03## 0.98 ±0.07**## 3.13 ±0.44**##柿叶总黄酮高剂量组 3.78±0.28**## 0.57±0.04##△ 0.93±0.07**## 3.73±0.39**##△△柿叶总黄酮中剂量组 4.25±0.23**##△△ 0.59±0.03##△△ 0.89±0.06**##△△ 4.19±0.19**##△△柿叶总黄酮低剂量组 4.99±0.69**##△△ 0.65±0.09##△△ 0.86±0.04**##△△ 4.39±0.33**##△△
表5 给药4周后各组大鼠载脂蛋白的变化(±s,n=10)
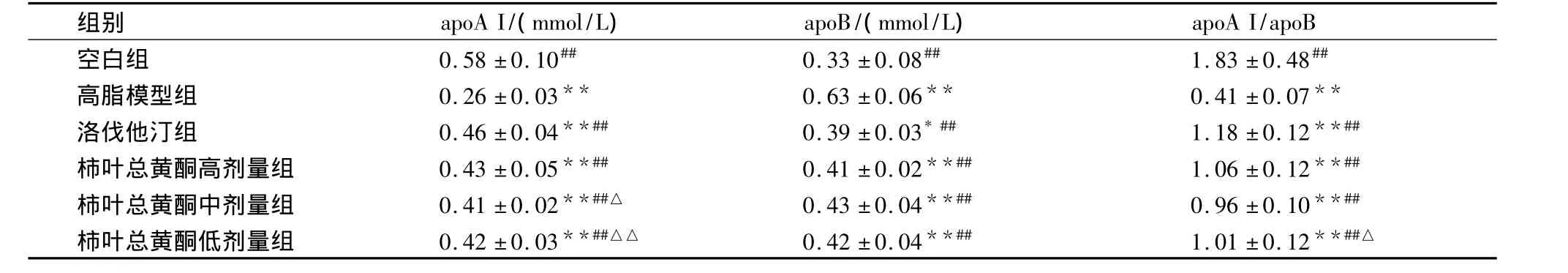
表5 给药4周后各组大鼠载脂蛋白的变化(±s,n=10)
注:与空白组比较,*P <0.05,**P <0. 01;与高脂模型组比较,##P <0. 01;与洛伐他汀组比较,△P <0.05,△△P <0.01。
组别 apoA I/(mmol/L) apoB/(mmol/L)apoA I/apoB空白组 0.58 ±0.10## 0.33 ±0.08## 1.83 ±0.48##高脂模型组 0.26±0.03** 0.63±0.06** 0.41±0.07**洛伐他汀组 0.46 ±0.04**## 0.39 ±0.03*## 1.18 ±0.12**##柿叶总黄酮高剂量组 0.43 ±0.05**## 0.41 ±0.02**## 1.06 ±0.12**##柿叶总黄酮中剂量组 0.41±0.02**##△ 0.43±0.04**## 0.96±0.10**##柿叶总黄酮低剂量组 0.42±0.03**##△△ 0.42±0.04**## 1.01±0.12**##△
表6 给药4周后各组大鼠全血黏度的比较(±s,n=10)

表6 给药4周后各组大鼠全血黏度的比较(±s,n=10)
注:与空白组比较,**P <0. 01;与高脂模型组比较,##P <0. 01;与洛伐他汀组比较,△△P <0.01。
组别 高切/(mPa.s) 中切/(mPa.s) 低切/(mPa.s)空白组 3.22 ±0.13## 4.76 ±0.14## 7.35 ±0.24##高脂模型组 6.95±0.18** 9.15±0.19** 14.22±0.13**洛伐他汀组 4.54 ±0.20**## 6.70 ±0.27**## 10.00 ±0.33**##柿叶总黄酮高剂量组 4.48±0.24**##△△ 6.30±0.13**##△△ 9.90±0.53**##柿叶总黄酮中剂量组 4.91±0.16**##△△ 7.02±0.11**##△△ 10.18±0.11**##柿叶总黄酮低剂量组 5.14±0.18**##△△ 7.28±0.17**##△△ 10.33±0.14**##△△
表7 给药4周后各组大鼠HCT、血浆黏度的比较(±s,n=10)
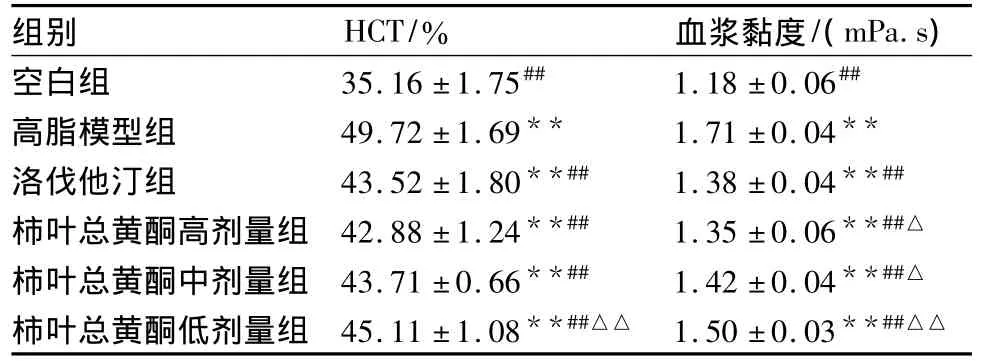
表7 给药4周后各组大鼠HCT、血浆黏度的比较(±s,n=10)
注:与空白组比较,**P <0. 01;与高脂模型组比较,##P <0. 01;与洛伐他汀组比较,△P <0.05,△△P <0.01。
组别 HCT/% 血浆黏度/(mPa.s)空白组 35.16 ±1.75## 1.18 ±0.06##高脂模型组 49.72±1.69** 1.71±0.04**洛伐他汀组 43.52 ±1.80**## 1.38 ±0.04**##柿叶总黄酮高剂量组 42.88 ±1.24**## 1.35 ±0.06**##△柿叶总黄酮中剂量组 43.71 ±0.66**## 1.42 ±0.04**##△柿叶总黄酮低剂量组 45.11 ±1.08**##△△ 1.50 ±0.03**##△△
表8 给药4周后各组大鼠AI的变化(±s,n=10)

表8 给药4周后各组大鼠AI的变化(±s,n=10)
注:与空白组比较,**P <0. 01;与高脂模型组比较,##P <0. 01;与洛伐他汀组比较,△△P <0.01。
组别AI空白组 1.10 ±0.38##高脂模型组 12.13 ±1.72**洛伐他汀组 2.55 ±0.34**##柿叶总黄酮高剂量组 3.09 ±0.27**##柿叶总黄酮中剂量组 3.81 ±0.54**##△△柿叶总黄酮低剂量组 3.87 ±0.27**##△△
3 讨论
高脂血症是动脉粥样硬化(AS)的病理、生化基础[5-7]。AS脂肪斑块主要由TC和胆固醇酯构成,所以TC和AS之间有紧密的关系。TG是除TC之外导致冠心病(CHD)的又一独立危险因子,高TG血症可导致小而密的LDL-C增多,HDL-C降低,并有促使AS斑块破裂的作用[8]。HDL-C具有将外周组织中的TC清除入血,并逆向转运到肝脏进行转化排泌的功能,阻碍TC在细胞内堆积,抑制细胞摄取LDL和抑制平滑肌细胞的增生,对AS的形成起拮抗作用[9]。apoA I和apoB分别为HDL-C和LDL-C的主要载脂蛋白,血清apoA I和apoB水平可反应HDL-C和LDL-C水平,apoA I/apoB比值与判断CHD及病变程度有较好的线性关系[10]。AI也是与AS独立相关的危险因素,有研究资料表明[11],AI能够准确反映血脂水平与AS、CHD之间的关系,是预测AS、CHD危险性的重要指标。本实验结果表明,柿叶总黄酮能改善高脂血症大鼠的脂质代谢紊乱状况,能有效升高HDLC、apoA I、apoA I/apoB 的比值;不同程度降低 TC、TG、LDLC、apoB、AI的水平。柿叶总黄酮高剂量组降低高脂血症大鼠TC、TG、AI水平,升高apoA I和apoA I/apoB比值水平与阳性对照药洛伐他汀相当。柿叶总黄酮改善高脂血症大鼠血脂紊乱的作用可能与其对载脂蛋白的调节有关。
高血脂又是造成血液高黏、高滞、高聚状态的因素之一。当TC量增加时,血浆LDL可将游离TC带入红细胞膜中,使膜中的TC量增加,引起膜中胆固醇和磷脂的比值增加,使膜的流动性降低,使全血黏度增高[12],加速形成AS,发生栓塞,发生心脑血管疾病。因此,治疗高脂血症及其相关疾病一个重要方面就是改善血液流变学,降低全血黏度、HCT、血浆黏度和红细胞刚性指数等,提高红细胞的变形能力。本实验对高脂血症大鼠的全血黏度(高切、中切、低切)、血浆黏度、HCT进行了测定,结果高脂模型组以上指标均显著性升高(P<0.01);PLF高剂量组与洛伐他汀组比较升高无显著性差异(P>0.05);其余各组全血黏度(高切、中切、低切)、血浆黏度、HCT都有不同程度的降低,说明PLF对高脂血症大鼠的血液流变学有显著的改善作用,这可能是其治疗高脂血症取得较好疗效的作用途径之一。
[1]Chen O G,Lu H,Wang C,et al.Effect of triterpenoid compounds isolated from leaves of Diospyros kaki on stimulus induced superoxide generation and tyrosyl phosphorylation in human polymorphonuclear leukocytes[J].Clin Chim Acta,2002,320(1-2):11-16.
[2]Han J,Kang S,Choue R,et al.Free radical scavengling effect of Diospyros kaki Laminaria japonica and Undaria pinnatifida[J].Fitoterapia,2002,73(7-8):710-712.
[3]徐叔云,卞如濂,陈 休,等.药理实验方法学[M].3版,北京:人民卫生出版社,2005:1201-1206.
[4]韩志涛.碱性电解水对大鼠抗氧化及抗纤维蛋白原作用的实验研究[J].中国老年学杂志,2003,23(10):683-684.
[5]Knouff C,Briand O,Lestavel S,et al.Defective VLDL metabolism and severe atherosclerosis in mice expressing huanapolipoprotein E isoforms but lacking the LDL receptor[J].Biochim Biophys Acta,2004,1684(1-3):8-17.
[6]Engler MB.Familial hypercholesterolemia:genetic predisposition to atherosclerosis[J].Medsurg Nurs,2004,13(4):253-257.
[7]Kullo IJ,Bailey KR,Mc Connell JP,et al.Low-density lipoprotein particle size and coronary atherosclerosis in subjects belonging to hypertensive sibships[J].Am J Hypertens,2004,17(9):845-851.
[8]Kosuge K,Miida T,Takahashi A,et al.Estimating the fasting triglyceride concentration from the postprandial HDL-cholesterol and apolipoprotein CIII concentrations[J].Atherosclerosis,2006,184(2):413-419.
[9]王开发,陆 明.花粉的植物甾醇研究[J].蜜蜂杂志,2006,(9):5-6.
[10]Edelstein D,Brownlee M.Mechaistic studies of advanced glycosylation end product inhibition by aminoguanidine[J].Diabetes,1992,41(1):26-29.
[11]胡 琳.血脂综合指数与冠心病的关系[J].青海医药杂志,2004,34(09):16-17.
[12]向 甄,杨继庆,刘永英.健康成人血液流变学与血脂相关性的实验研究[J].中国医学物理学杂志,2006,23(4):271-272.
R285.5
B
1001-1528(2011)08-1397-04
2011-01-12
陈 丽(1977—),女,讲师,硕士,主要从事药剂学、药理学教学工作。E-mail:chenlilzyz@163.com
