姜黄素固体脂质纳米粒单用或与顺铂联用对人卵巢癌SKOV3细胞增殖的抑制作用研究
2011-05-22邓舒婷甘霖周琦徐建业李少林重庆市肿瘤研究所妇瘤科重庆市40000重庆医科大学放射医学教研室重庆市40006重庆市肿瘤研究所临床检验中心重庆市40000
邓舒婷,甘霖,周琦,#,徐建业,李少林(.重庆市肿瘤研究所妇瘤科,重庆市40000;.重庆医科大学放射医学教研室,重庆市 40006;.重庆市肿瘤研究所临床检验中心,重庆市 40000)
卵巢癌是女性生殖器官常见的肿瘤之一,病死率居妇科恶性肿瘤首位,对妇女生命造成严重威胁。以顺铂(Cisplatin,DDP)为基础的联合化疗,能有效提高患者生存率。但因顺铂等化疗毒副作用大,且长期使用会产生耐药性,可能导致肿瘤进展或复发。故寻找能增强疗效并减轻化疗毒副作用的药物或化疗组合,日益成为研究热点。姜黄素(Curcumin,Cur)是从中药姜黄中提炼出的有效成分。有研究[1~3]证实,Cur对体外培养的多种肿瘤细胞系均有生长抑制作用。固体脂质纳米粒(Solid lipid nanoparticles,SLN)是近年来正在发展的新型纳米载药体系,可延长药物在血液中的半衰期,有效提高药物的生物利用度。目前,国内、外尚未见关于姜黄素固体脂质纳米粒(Curcumin-loaded solid lipid nanoparticles,Cur-SLN)抗妇科肿瘤的研究报道。本试验采用溶液扩散法制备Cur-SLN,并研究其单用或与DDP联用对人卵巢癌SKOV3细胞增殖的抑制作用,为今后Cur-SLN治疗卵巢癌的化疗临床应用提供理论依据。
1 仪器与材料
1.1 仪器
ELX800酶标仪(美国伯腾仪器有限公司);倒置显微镜(日本Olympus公司);透射电镜(日本日立公司);流式细胞仪(上海邦逞医疗器械有限公司)。
1.2 试药
小牛血清(兰州民海生物工程有限公司,批号:20091015);Cur(美国Sigma公司,批号:100K3447,规格:每瓶250 mg,纯度:99%);DDP冻干灭菌粉末(山东罗欣药业股份有限公司,批号:09061001-2,规格:每瓶10 mg);青霉素、链霉素冻干灭菌粉末(华北制药集团有限责任公司,批号:B0501013、B050310,规格均为每瓶800 万u);Cur-SLN(重庆市肿瘤研究所临床检验中心分子生物学实验室自制,包封率:85.3%,载药量:73.2%);其余试剂均为分析纯。
1.3 细胞
人卵巢癌SKOV3细胞株(来源于重庆医科大学肿瘤学教研室)。
2 方法
2.1 Cur-SLN混悬液的制备
采用溶液扩散法,根据前期单因素考察及参考文献[4],确定较优制备工艺。精密称取Cur 8 mg(27 μmol)和硬脂酸80 mg溶于无水乙醇3 mL中,加热至50℃,滴入聚乙烯醇溶液中,搅拌2 h。将所得混悬液3000 r·min-1离心3 min,蒸馏水清洗2次,再加入适量蒸馏水,超声10 min,即得浓度为20 μmol·L-1的Cur-SLN混悬液,置于4 ℃保存备用。
2.2 细胞培养
将SKOV3细胞培养在RPIM-1640培养液中(含10%小牛血清、100 u·mL-1青霉素及链霉素),置于37 ℃、5%CO2孵箱中备用。
2.3 细胞生长抑制率的检测
采用MTT法,取SKOV3细胞常规消化并制成浓度为5×105个/mL悬液,接种于96孔板,每孔200 μL,加入不同浓度药物,每个药物浓度设4个复孔。分别培养24、48、72 h后,加入浓度为5 mg·mL-1的MTT 20 μL继续培养,4 h后离心去上清,加二甲基亚砜(DMSO)200 μL,充分吹打震荡10 min,于酶标仪上540 nm波长下测定吸光度(A)值,试验重复3次取平均值。按下式计算细胞生长抑制率(%)=(1-实验药物组A/空白对照组A)×100%。
单用试验,分组为空白对照组、Cur组及Cur-SLN组。其中空白对照组加入培养液20 μL;Cur组分别加入10、20、40、60、80 μmol·L-1的Cur(用蒸馏水稀释)20 μL;Cur-SLN组分别加入10、20、40、60、80 μmol·L-1(以Cur计)的Cur-SLN 20 μL。
联用试验,分组为空白对照组、DDP组、DDP+Cur组及DDP+Cur-SLN组。其中空白对照组加入培养液20 μL;后3组中DDP终浓度均为1、2、3、4、5 μmol·L-1,加入量均为20 μL,Cur终浓度均为10 μmol·L-1(Cur-SLN浓度经预试验得出,约为半数抑制浓度(IC50)的1/3,为方便比较,Cur终浓度同Cur-SLN),加入量为20 μL。
2.4 细胞凋亡率与细胞周期分布的检测
取细胞悬液20 mL,其中细胞数为1×106个,接种于200 mL培养瓶内培养24 h,分组为空白对照组、DDP组、Cur组、Cur-SLN组、DDP+Cur组及DDP+Cur-SLN组(DDP终浓度均为2.5 μmol·L-1,Cur终浓度均为10 μmol·L-1),加入量均为20 μL,培养24 h,用磷酸盐缓冲液(PBS)清洗2次,转至1.5 mL离心管中,3000 r·min-1离心3 min,加1 mL含2%小牛血清的PBS液混匀;用预冷75%乙醇固定,吹打成单细胞悬液,4℃放置30 min,1000 r·min-1离心20 min;加PBS液后再离心,去固定液,采用流式细胞仪检测细胞凋亡率及细胞周期分布,用Modifit 1.0软件分析结果。
2.5 细胞周期调控因子Cyclin E、CDK2表达的检测
细胞浓度及用量、分组同“2.4”项,接种于200 mL培养瓶内,加PBS液清洗3次,投入冷丙酮(4℃)中,在各组培养瓶内放置无菌盖玻片培养24 h。待细胞生长至近融合状态时,取出盖玻片,用PBS液清洗3次,细胞面向上投入4℃冷丙酮中固定5 min,用PBS液(pH7.4)冲洗3次,每次1 min,之后以二氨基联苯胺显色法(DAB法)进行细胞周期调控因子Cyclin E、CDK2免疫组化染色,最后自来水充分冲洗,复染封片,显微镜下观察、鉴定,半定量分析,测定细胞周期标记指数(LI)。
2.6 统计学方法
所有资料应用SPSS13.0软件进行统计学分析,数据采用表示,MTT试验数据分析采用2×2×2析因设计的方差分析,流式技术和DAB数据分析采用2×2析因设计的方差分析,两两比较采用S-N-K法,以P<0.05表示差异具有统计学意义。
3 结果
3.1 细胞生长抑制率检测结果
3.1.1 单用试验结果。随着各组药物浓度的增加及作用时间延长,细胞生长抑制率呈上升趋势,并在一定范围内呈浓度、时间依赖性,且在同一浓度及作用时间下,Cur-SLN组较Cur组对SKOV3细胞的生长抑制作用更显著(P<0.05)。单用试验各组对SKOV3细胞作用不同时间后细胞生长抑制率比较见图1。

图1 单用试验各组对SKOV3细胞作用不同时间后细胞生长抑制率比较Fig 1 Comparison of inhibition rate of SKOV3 cell growth in single drug group after different treatment time
3.1.2 联用试验结果。(1)DDP对SKOV3细胞生长的作用。随着浓度增加及作用时间延长,DDP对SKOV3细胞的生长抑制率均升高,呈浓度、时间依赖性。(2)DDP+Cur及DDP+Cur-SLN对SKOV3细胞生长的作用。与DDP组比较,DDP+Cur组及DDP+Cur-SLN组对SKOV3细胞的生长抑制率随DDP浓度增加和作用时间延长均升高,其中DDP+Cur-SLN组较DDP组和DDP+Cur组升高有明显差异(P<0.05),呈浓度、时间依赖性。表明Cur-SLN与DDP联用有明显协同作用,可提高肿瘤对DDP的敏感性。联用试验各组对SKOV3细胞作用不同时间后细胞生长抑制率比较见图2。

图2 联用试验各组对SKOV3细胞作用不同时间后细胞生长抑制率比较Fig 2 Comparison of inhibition rate of SKOV3 cell growth in drug combination group after different treatment time
3.2 细胞凋亡率与细胞周期分布比较
与空白对照组比较,各组均出现S期细胞比例逐渐降低、G2期细胞比例逐渐增加的现象;Cur-SLN组较Cur组发生G2期阻滞、诱导细胞凋亡的作用更显著;当DDP与Cur-SLN联用时细胞凋亡率为17.94%,较DDP组(4.65%)及Cur-SLN组(7.69%)均明显升高(P<0.05)。细胞凋亡试验各组对SKOV3细胞周期及凋亡率影响见表1。
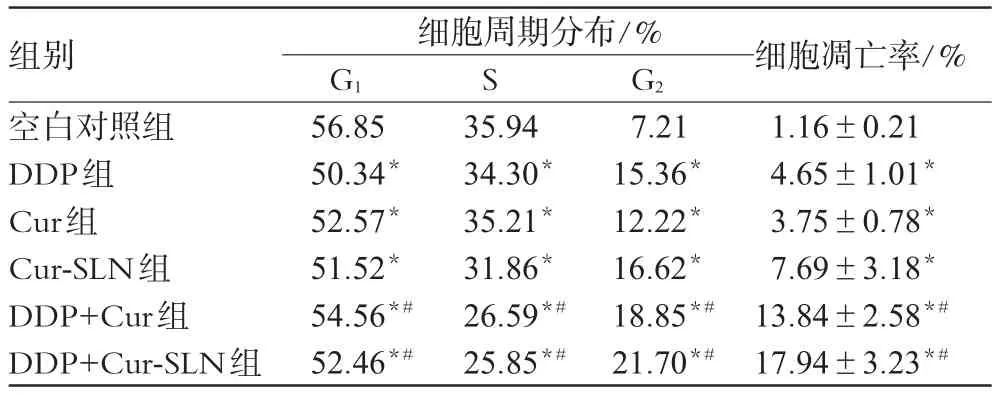
表1 细胞凋亡试验各组对SKOV3细胞周期及凋亡率影响Tab 1 Effect of cell apoptosis test on cell cycle and apoptosis rate of SKOV3 cells
3.3 Cyclin E、CDK2表达结果比较
空白对照组Cyclin E、CDK2阳性表达的LI值分别为(17±3.12)%、(20±4.41)%,而 DDP 组为(26±4.18)%、(32±5.61)%,Cur组为(21±4.03)%、(23±4.73)%,Cur-SLN组为(27±5.36)%、(34±3.82)%,DDP+Cur组为(23±5.15)%、(31±4.76)%,DDP+Cur-SLN 组为(35±5.93)%、(38±6.16)%,其中DDP+Cur-SLN组较其他组阳性表达明显增强(P<0.05)。与空白对照组比较,各组表达均有显著性差异(P<0.05)。
4 讨论
植物来源的抗肿瘤药近年来在新药开发上显示出了巨大潜力,成为新型抗肿瘤药物的重要来源,如Cur、紫杉醇、喜树碱、莪术醇[5]等。Cur提取自中药姜黄,其主要药理作用包括抗肿瘤、抗炎、降血脂等,且毒性作用较少,对正常组织细胞几乎不产生不良影响[6]。近年来Cur的抗肿瘤作用成为研究热点,机体内部实验证实Cur可有效抑制肿瘤侵袭以及转移,体外试验证实Cur具有抑制肿瘤细胞增殖、促进细胞凋亡等作用[7]。Cur的抗癌谱广且毒副作用小,美国国立癌症研究院已将其列为第3代抗癌化学预防药。但因Cur不溶于水,耐光性、耐热性较差,体外易被氧化,限制了其作为抗癌新药的研制及临床应用。
SLN是一种粒径在10~1000 nm之间的新型胶体给药系统。药物可包埋或溶解在纳米粒的内部,也可吸附或偶合在其表面,具有较好的生物相容性。目前SLN有多种制备方法,如高压乳匀法、乳化蒸发-低温固化法、薄膜超声法、微乳法等[8]。本文采用溶液扩散法制备方法简单,所制纳米粒粒径足够小,既适于实验室研制,也比较容易规模化生产。
本研究发现,Cur-SLN是通过诱导人卵巢癌SKOV3细胞凋亡、阻滞细胞周期而发挥抑制细胞增殖及促凋亡作用的。这也正是DDP等化疗药物抑制肿瘤细胞增殖的重要机制。研究结果显示,Cur-SLN单用或与DDP联用于SKOV3细胞均可起到诱导细胞凋亡的作用,且2药联用时细胞凋亡率显著增加。Cur-SLN及DDP均可使SKOV3细胞发生G2期阻滞,抑制肿瘤细胞生长,2药联用细胞生长抑制作用更显著,提示Cur-SLN可以增强DDP对肿瘤细胞诱导凋亡的作用。同时,加入Cur-SLN后的各组Cyclin E、CDK2表达较Cur组均有所升高,尤其是DDP+Cur-SLN组升高最明显。
综上所述,Cur-SLN对人卵巢癌SKOV3细胞有明显的生长抑制及促凋亡作用,且与DDP联用有协同效果。本试验为Cur抗肿瘤药的进一步开发应用、减少DDP临床用量、降低肾毒性并提高化疗效果提供新思路及试验依据。
[1]Jemal A,Siegel R,Ward E,et al.Cancer statistics[J].CA Cancer J Clin,2007,56(2):43.
[2]Xu J,Fu YM,Chen AP.Activation of peroxisome proliferator-activated receptor-gamma contributes to the inhibitory effects of curcumin on rat hepatic stellate cell growth[J].Am J Physiol Gastrointest Liver Physiol,2003,285(1):20.
[3]Chen AP,Xu J,Johnson AC.Curcumin inhibitis human colon cancer cell growth by suppressing gene expression of EGFR through reducing the activity of Egr-1[J].Oncogene,2006,25(6):278.
[4]许汉林,孙 芸,邵继征,等.不同方法制备姜黄素脂质体的研究[J].中国中医药信息杂志,2006,13(7):26.
[5]林 海,李晓辉.莪术醇诱导白血病L1210细胞凋亡作用研究[J].中国药房,2008,19(30):2328.
[6]Anand P,Sundaram C,Jhurani S,et al.Curcumin and cancer:an“old-age”disease with an“age-old”solution[J].Cancer Letters,2008,267(1):133.
[7]Jing Z,Yong Z,Yan Z,et al.Anti-tumor effect of curcumin on human cervical carcinoma hela cells in vitro and in vivo[J].Chinese J Cancer Res,2007,19(1):32.
[8]马 艳,蒋学华,杨安东,等.薄膜超声法制备姜黄素固体脂质纳米粒的工艺研究[J].中成药,2008,30(7):981.
