液体电谐振和血凝抑制试验检测禽流感的2种方法的对比
2011-05-18杨会娜蔡家利
杨会娜,蔡家利
(重庆理工大学 药学与生物工程学院,重庆 400054)
禽流感(avian influenza,AI)是由正黏病毒科流感病A型流感病毒引起的危及禽类、小型哺乳动物和人类的一种病毒性传染病。该病的毒型较多,变异性极强,低致病性的毒株能在短期内变成高致病性的毒株,从而给养禽业造成毁灭性灾难[1-7]。禽流感病毒能与鸡红细胞发生凝集现象,即血凝,但是这种血凝现象可被特异性免疫血清所抑制,即常说的血凝抑制实验(HI)。由于血凝反应可被特异性抗体所抑制,抗体与抗原(病毒)结合后,血凝素不能吸附于红细胞表面的受体上,因此血凝抑制试验可以用于鉴定病毒,以及作为适时免疫的辅助手段,能避免免疫失败、免疫空挡及重复免疫造成的损失。血凝与血凝抑制试验是当前最普及的监测禽流感抗体的一种方法,它对设备要求不高,但对操作者的熟练程度要求相当高,不似酶标仪等机器设备的判断性具有直观性和机械性[4]。液体电谐振检测装置是把抗原与抗体反应的特异性和石英谐振换能器对表面质量负载变化的高度敏感性相结合,通过测定发生生化反应的液体电谐振频率的变化的一种新型压电免疫传感仪。当待测抗原或抗体与待检测的识别分子相互作用而产生特异结合时,就会引起晶体表面质量产生微小变化,所结合抗原或抗体的量可以通过压电晶体质量效应所引起的频率变化进行表征,即通过测量抗体和抗原结合前后压电晶体的震荡频率变化值,可得到敏感膜上结合抗原或抗体的量[8-10]。本研究对液体电谐振试验和血凝抑制试验2种检测禽流感病毒的方法进行比较试验,并对试验结果进行了分析。
1 材料与方法
1.1 主要仪器和试剂
仪器:SP312等精度频率检测仪(中国南京盛普仪器科技有限公司);液体电谐振传感仪(重庆理工大学生物医电实验室);超声波清洁器(无锡泰迪超声波有限公司)。
试剂:禽流感H5亚型HI试验抗原(重庆理工大学生物制药实验室);禽流感H 5亚型阳性血清(重庆市动物疫病预防与控制中心);无水乙醇(重庆川东化工集团有限公司)。
1.2 实验方法
1.2.1 1%鸡红细胞的制备
取鸡翅静脉血若干,加1/5体积的抗凝剂(3.8%柠檬酸三钠),混匀后,加入等体积0.01 mol/L的pH值为7.2的磷酸盐缓冲液(PBS),1 500 r/min离心处理后,弃去上清液,再加PBS洗涤3次,最后用PBS稀释管内沉淀物,制成1%悬浮鸡红细胞,储于4℃冰箱,每周新配。
1.2.2 微量法血凝试验(HA)检测AIV抗原效价
按照常规操作方法,经血凝试验检测,AIV抗原的效价为1∶27,回归试验验证其正效价检测的正确性。
1.2.3 血凝抑制试验
试验原理:禽流感病毒对鸡红细胞具有凝集作用,这种血凝作用可被特异性抗体所抑制,抗体与病毒结合后,可使血凝素不能吸附于红细胞表面的受体上,而使红细胞沉淀。
采用微量法血凝抑制试验按常规操作进行,使用1%的鸡红细胞和4个HA单位的AIV病毒抗原,检测结果以HI效价大于或等于24判为阳性。
1.2.4 1%红细胞和禽流感病毒的液体电谐振试验
试验原理:在全液相条件下,液体的内在性质决定着液体的振荡频率。在一定环境下,当成分不变的液体不发生任何生物或者化学反应时,同时测量的传感器不变,则其电谐振频率是一定的。如果液体性质发生改变,那么其电谐振频率必定变化。本实验中检测的就是抗原和抗体特异结合和不结合发生的谐振频率的变化[9]。
本实验所用到的反应芯片是一种圆形的指叉形传感器,如图1所示,它是由一片直径为1.5 cm的圆状片体组成,上面镀有交叉、对称且留有缝隙的镀金极板,基频为10 MHz。
图1 指叉形传感器切面
反应芯片的清洗:将超声波清洁器中加适量去离子水,洗掉使用过的指叉形传感器极板上的反应残余物,再将其浸泡在盛有无水乙醇的小烧杯中,最后将小烧杯放在超声波清洁器中,清洗1 min,取出吹干,备用。
试验过程:
1)将洁净的反应芯片安装在电谐振仪上,温度设为37℃,预热5 min。
2)配置AIV抗原反应液。计算出含4个血凝单位的AIV抗原浓度,按如下公式进行计算:
抗原应稀释倍数=血凝滴度/4
即用190μL的PBS稀释6μL的AIV抗原,总体积为196μL。
3)打开SP312等精度频率检测仪,启动PC机上系统操作软件。
4)参照血凝抑制实验的步骤,在液体电谐振仪上进行检测,具体如下:吸取20μL已配好的AIV抗原反应液放入灭菌EP管中,再加20μL AIV阳性血清于EP管中混匀,等PC机上信号稳定后吸取20μL混液滴加在传感器正中央反应孔上,10 min后再加10μL前面已配好的1%鸡红细胞,继续跑曲线30 min,停止断开操作系统,保存试验曲线。
5)立即取出反应芯片清洗,步骤如本文1.2.4节。
6)重复以上步骤,分别检测不同体积比例的AIV抗原反应液和阳性血清的反应曲线。
7)用标准阴性血清做空白对照,重复上述步骤。
2 试验结果
2.1 微量法血凝和血凝抑制试验检测AIV的结果
经检测AIV抗原反应液抗原的效价为1∶27,AIV抗体阳性血清的效价为1∶26。
2.2 液体电谐振仪检测AIV的结果
经检测得到如下曲线:图2是AIV抗原反应液被阳性血清完全抑制,不再和1%鸡红细胞结合的反应曲线;图3是AIV抗原反应液部分被阳性血清抑制,部分和1%鸡红细胞结合的反应曲线;图4是阴性对照,即AIV抗原反应液被阴性血清抑制,而和1%鸡红细胞结合的反应曲线。

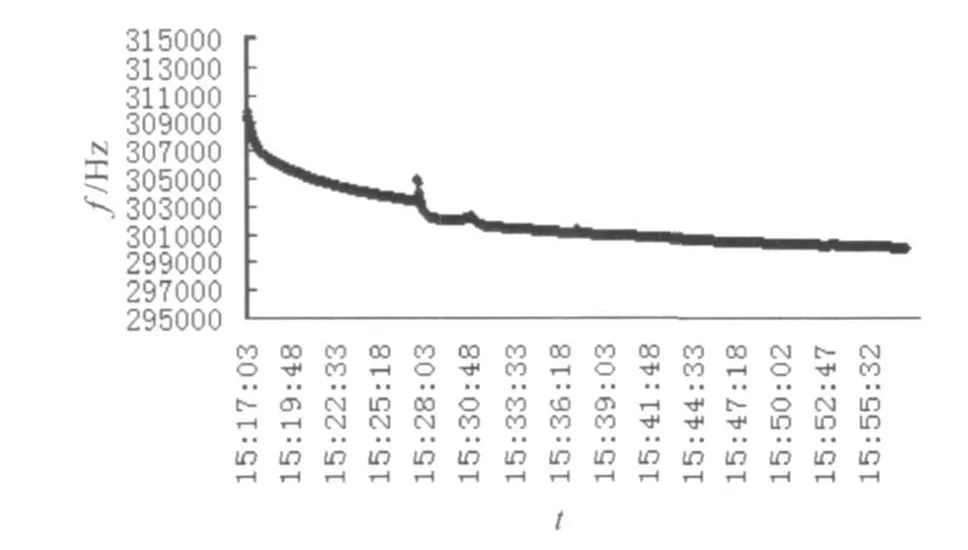
图4 AIV病毒与标准阴性血清的过程反应曲线
3 讨论
3.1 液体电谐振仪检测禽流感和HI试验方法的检测符合率
图2中AIV阳性血清和AIV抗原反应液的体积比为1∶1。反应的前阶段是AIV反应液抗原和阳性血清中的抗体相互作用,10 min后加入红细胞,不再有结合位点与其起作用,因此10 min后的曲线近乎平行线。
图3中AIV阳性血清和AIV抗原反应液的体积比为1∶63,即阳性血清效价的临界值。反应的前阶段AIV抗原和抗体部分结合,10 min后加入红细胞,未被抑制的那部分AIV抗原和红细胞结合。反应液性质不同,引起曲线发生波动。HI方法测得的AIV阳性血清的最高效价相一致。
图4用阴性血清做空白对照。此反应中AIV抗原没有与其结合的抗体,所以加入红细胞后,逐渐与红细胞结合,反应的曲线近似斜直线,最终趋向平行线。
3.2 两种试验方法的相关性
无论是用HI试验方法检测禽流感还是用液体电谐振仪检测禽流感,都需要事先确定禽流感抗原的效价。二者的试验方法是一致的,不同之处在于HI的实验结果在96孔V型微量血凝反应板上显示,而液体电谐振仪检测禽流感病毒可以通过PC机直观的显示。HI试验方法比较成熟,但是该方法在结果判定中人为因素较大,而液体电谐振仪的结果很直观地以曲线的形式显示出来,5μL左右的反应液就可以进行检测,仪器中的反应芯片清洁后可重复使用,另外可多个反应空同时检测多个样品可同时检测多个样品。
4 结束语
本实验针对新的检测禽流感方法做了进一步的研究,将其与目前常用的检测方法——血凝抑制法进行对比。研究结果发现,与传统的检测方法比较,液体电谐振仪具有检测速度快、灵敏、操作简便、结果直观等优点,未来可用于AIV的早期快速诊断和或者其他方面疾病的诊断,有一定的社会意义和经济价值。
[1] 李晓峰,秦鄂德.禽流感病毒的传播、致病机制及其防治[J].解放军医学杂志,2009(2):125-130.
[2] 王秀荣.高致病性禽流感防治技术问答[J].畜牧兽医科技信息,2010(3):107-108.
[3] 卡尔克BW.禽病学[M].高福,译北京:.北京农业大学出版社,l991.
[4] 朱燕秋.水禽禽流感H I抗体检测方法的探讨[J].中国兽医杂志,2009(2):42-43.
[5] 于博,章振华,姜北宇,等.4个H 9N 2亚型禽流感病毒毒株HA基因序列比较与分析[J].安徽农业科学,2009,37(31):15169-15171,15252.
[6] 于博,章振华,姜北宇,等.一株H 9N2亚型禽流感病毒全基因组序列的遗传变异分析[J].安徽农业科学,2010,38(1):507-509,526.
[7] 蔡家利,余华,胡仁建,等.禽流感病毒M2e基因与鸡IgG Fc基因在大肠杆菌中的融合表达和纯化[J].重庆理工大学学报:自然科学版,2010,24(1):38-41.
[8] 陈昕,周康源,顾宇,等.压电生物传感器研究进展[J].传感技术学报,2003(3):291-292.
[9] 张波,府伟灵.压电石英晶体生物传感器及其应用[J].生物技术通讯,2002,13(2):20-24.
[10]吴永强,王茜.压电生物传感器的研究进展[J].四川理工学院学报,2006,19(3):42-45.
