脑内注射纳米三氧化二铁对大鼠空间学习记忆功能的影响及对腹侧中脑的损伤作用
2011-05-14刘袁静曾水林王健华史婷婷朱建宝
刘袁静,李 涛,曾水林,王健华,史婷婷,朱建宝
(东南大学医学院人体解剖学与组织胚胎学系,江苏南京 210009)
近年来研究证实,纳米颗粒可以通过呼吸道吸入、胃肠道吸收、皮肤组织的渗透、注射等途径进入循环系统,通过循环系统进入各组织而产生影响[1]。由于纳米颗粒的特殊性质,直径较小的颗粒可通过血脑屏障,颗粒尺寸越小进入脑的量越多,越容易进入较深的脑区,产生的损伤越严重[2]。动物实验显示,纳米颗粒对心、肺、肝和脾等器官有不同程度的毒性损害作用[3]。纳米三氧化二铁(ferric oxide nanoparticles,nano-Fe2O3)拟作为影像学诊断标记物和药物治疗载体用于临床,药物释放后剩余的nano-Fe2O3颗粒载体不能被很快地代谢,在中枢神经系统(central nervous system,CNS)的积累对神经系统,尤其对脑有毒性作用值得研究。Ben-Shachar等[4]、陈先文等[5]及姜宏等[6]分别将FeCl3直接注射入大鼠黑质内,观察到高浓度FeCl3对黑质多巴胺(dopamine,DA)能神经元有损伤作用,并导致类似帕金森病(Parkinson's disease,PD)样自主运动功能障碍。据报道[4,7],部分PD患者和PD动物模型有学习记忆等认知功能障碍。本实验将nano-Fe2O3注入大鼠腹侧中脑,观察nano-Fe2O3对动物学习记忆功能的影响和腹侧中脑组织的形态学变化,为nano-Fe2O3应用于临床的安全性评价,提供一定的参考依据。
1 材料与方法
1.1 试剂和仪器
nano-Fe2O3由东南大学纳米技术研究中心实验室制备,直径10 nm,浓度20 g·L-1;小鼠抗大鼠酪氨酸羟化酶(TH)单克隆抗体(美国Sigma公司);兔抗大鼠胶质纤丝酸性蛋白质(GFAP)多克隆抗体(美国Sigma公司);小鼠抗大鼠OX-42单克隆抗体(英国AbD Serotec公司);通用型过氧化物酶标记的链酶卵白素(SP-9000)免疫组化试剂盒(北京中杉金桥生物技术有限公司),浓缩DAB显色试剂盒(ZLI-9032)(北京中杉金桥生物技术有限公司)。
江湾Ⅱ型立体定位仪(第二军医大学),大鼠Morris水迷宫(上海移数信息科技有限公司Morris水迷宫及视频系统RD1101-MM),CM-1900冰冻切片机(德国Leica公司)和Olympus光学显微镜(日本Olympus公司),Leica图像处理系统(德国Leica公司)。
1.2 动物及分组处理
健康成年SD大鼠42只,♂,体质量200~250 g,由东南大学实验动物中心提供〔实验动物使用许可证号:SYSK(苏)2010-0004〕。按照Morris水迷宫实验要求,筛选出符合标准的36只,随机分为6组,每组6只,分别为正常对照组,溶剂(生理盐水)组,nano-Fe2O3后1,2,3和4周取样组。除正常对照组大鼠外,其余大鼠ip 给予0.4%戊巴比妥钠(40 mg·kg-1)麻醉后,固定于立体定位仪上,常规消毒,开颅,暴露前囟,参照Paxinos-Watson大鼠图谱,注射靶点为中脑黒质(substantia nigra,SN)和腹侧被盖区(ventral tegmental area,VTA),SN 注射点坐标(mm)为AP:-4.8;ML:1.8;DV:9.2;VTA 注射点坐标(mm)为 AP:-4.8;ML:1.0;DV:9.2。nano-Fe2O3组与溶剂对照组在脑立体定位下各一次性注射1 μl nano-Fe2O320 g·L-1或生理盐水,注射速度 0.2 μl·min-1。注射完毕,留针 10 min,提针 0.5 mm 后,再留针1 min,然后按 2.0 mm·min-1速度缓慢拔针。术后大鼠包被保暖,清醒后置笼喂养。分别于药后1,2,3和4周行Morris水迷宫实验,灌流取脑行Perls反应和免疫组织化学染色。
1.3 Morris水迷宫实验测定大鼠学习记忆能力
Morris水迷宫直径160 cm、水深30 cm、站台直径11 cm、高28 cm。将Morris水迷宫以水池边缘相等分布的4个点作为入水点,将圆形水池等分为4个象限,平台位于第四象限内,在水面下2 cm。水中加入墨汁以使水不透明,保持水温在(25±1)℃,水迷宫外视觉线索相对固定。
随机选择入水点(即第一象限),按逆时针方向,将大鼠从各象限边缘中点位置面向池壁放入水中,允许大鼠用300 s找到隐藏在水下的逃避平台,找到平台后允许在平台上停留10 s,如果在规定时间内找不到平台,实验者帮助其找到平台并允许在平台上停留10 s,之后再进行下一次训练,每天连续训练4次,将4次的算术平均值记为当天的成绩,持续训练4 d。
在制作动物模型前测试,测试时任选一个入水点(即第二象限)将大鼠面向池壁放入水中,记录180 s内在目标象限(即第四象限)运动时间。药后1,2,3和4周用相同的方法进行Morris水迷宫检测。实时监控,并记录找到平台时间、游泳距离、游泳速度、潜伏期和搜索平台策略。
1.4 Perls反应法与免疫组织化学染色检测nano-Fe2O3对大鼠腹侧大脑的损伤
各组实验动物在行Morris水迷宫测试后,ip给予0.4%戊巴比妥钠,于深度麻醉下心脏灌注肝素化生理盐水250 ml,继续灌注4%多聚甲醛400 ml。取全脑置于4%多聚甲醛溶液后固定24 h,入30%蔗糖溶液至沉底。取中脑行冰冻连续冠状切片,片厚30 μm。分 3 份分别行 TH+/铁+、GFAP+/铁+、OX-42+/铁+免疫组化染色[8]。
1.4.1 Perls反应法(普鲁士蓝反应)
在Perls液(20%亚铁氰化钾水溶液25 ml,2%盐酸水溶液25 ml。两液分别配制贮存,临用前等量混合,过滤后使用)中反应20~30 min,蒸馏水充分漂洗终止反应。
1.4.2 免疫组化(SP法)
Perls反应后的切片用 PBS 0.01 mol·L-1(pH 7.4)冲洗5 min,加3%H2O2去离子水反应15 min,PBS洗5 min×3次,加10%山羊血清37℃反应30 min封闭(不洗),再加小鼠抗大鼠 TH抗体(1∶10 000)或兔抗大鼠 GFAP 抗体(1∶80)4℃ 过夜,或小鼠抗大鼠OX-42抗体(1∶200)4℃ 48 h。用PBS洗5 min×3次,加生物素化二抗 (1∶100)37℃60 min,PBS洗5 min×3次,加入过氧化物酶复合物(1∶100)37℃ 30 min,PBS洗5 min×3 次,后用DAB显色,蒸馏水终止反应,在PBS中贴片,干燥后脱水、透明、封片。另外任取一张切片作阴性对照,用正常羊血清代替一抗,结果为阴性。每个独立组收集数据的样本数为4,每个样本取腹侧中脑黒质区相同序列切片6张,在200倍光镜下随机计数10个非重叠视野分别计数 TH+/铁+、GFAP+/铁+、OX-42+/铁+细胞数,TH+、GFAP+和 OX-42+单标细胞数,采用DP Controller进行图像分析,计数阳性细胞,并照相。
1.5 统计学分析
采用SPSS 13.0分析软件进行统计分析,计量数据结果以±s表示,各组间结果比较采用配对t检验进行方差分析;搜索平台策略采用构成比进行比较。
2 结果
2.1 脑内注射纳米三氧化二铁对大鼠学习记忆的影响
表1结果显示,与正常对照组比较,溶剂对照组各项指标没有明显差异,说明生理盐水对大鼠的学习记忆功能无影响。nano-Fe2O3后1~4周游泳速度明显变慢(P<0.05);药后2和3周找到平台时间和潜伏期明显变长(P<0.05);nano-Fe2O3药后游泳距离随时间的增加呈下降趋势,但无统计学差异。
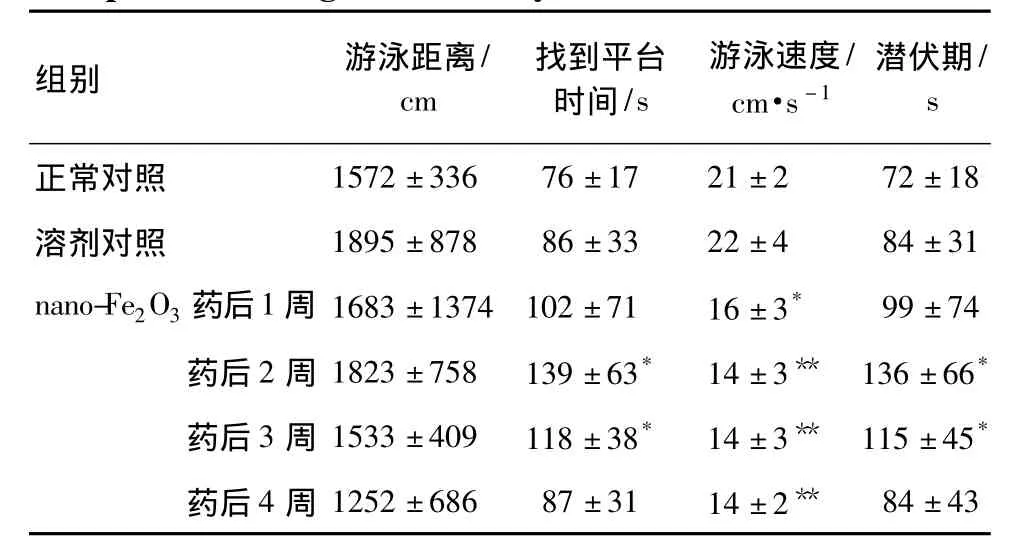
表1 脑内注射纳米三氧化二铁对大鼠空间学习记忆的影响Tab.1 Effect of intracerebral injection of nano-Fe2O3on the spatial learning and memory in rats
搜寻平台策略结果显示,正常对照组以趋向式为主(4/6),生理盐水组以趋向式(3/6)和随机式轨迹为主(3/6),药后1周以随机式(3/6)和边缘式(2/6),药后2周以随机式(2/6)和边缘式(4/6)为主,药后3周以随机式(3/6)和边缘式(3/6)为主,药后4周以随机式为主(5/6)。
2.2 脑内注射纳米三氧化二铁对大鼠腹侧中脑的损伤作用
Perls反应与免疫组化染色结果显示,注射生理盐水大鼠脑黑质可见大量TH+细胞,细胞形态饱满清晰,胞浆内未见有nano-Fe2O3颗粒,TH+纤维密集,交织成网(图1A);而nano-Fe2O3组TH+细胞明显减少,在残存的TH+细胞胞浆内可见nano-Fe2O3颗粒沉积,即TH+/铁+双标细胞(图1B中箭头指示),TH+纤维稀少,排列紊乱(图1D);正常对照组仅见GFAP+,OX-42+单标细胞,细胞形态规则,数量较少,OX-42+单标细胞呈散在分布(图1C,E),nano-Fe2O3组可见大量 GFAP+/铁+和 OX-42+/铁+双标细胞(图1D,F中箭头指示),细胞形态不规则,胞浆内有吞噬的nano-Fe2O3颗粒,突起粗而短,整个细胞呈反应性增大,细胞数量明显增加。
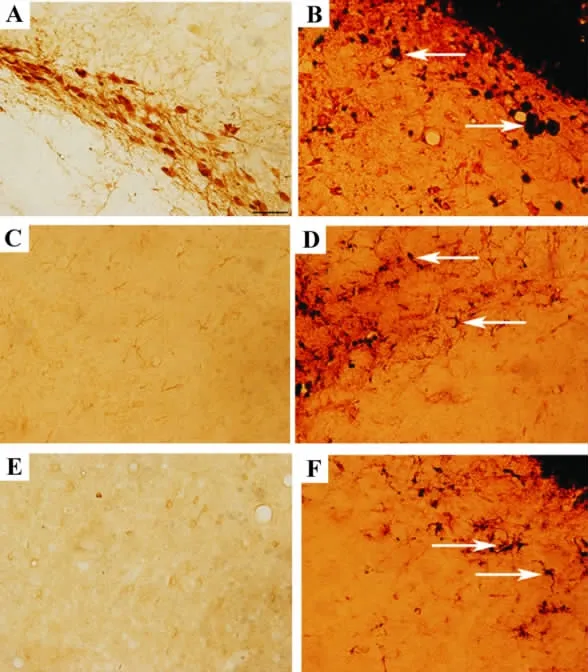
图1 Perls反应法与免疫组化 DAB显色检测脑内注射纳米三氧化二铁对大鼠腹侧中脑的损伤作用 (×400).A,C和E分别为正常对照组的 TH+/铁+、GFAP+/铁+和 OX-42+/铁+染色结果;B,D和F分别为 nano-Fe2O3组的 TH+/铁+、GFAP+/铁+和OX-42+/铁+染色.Fig.1 Effect of intracerebral injection of nano-Fe2O3on ventral midbrain injury by Perls reaction and immunohistochemical reaction(×400).
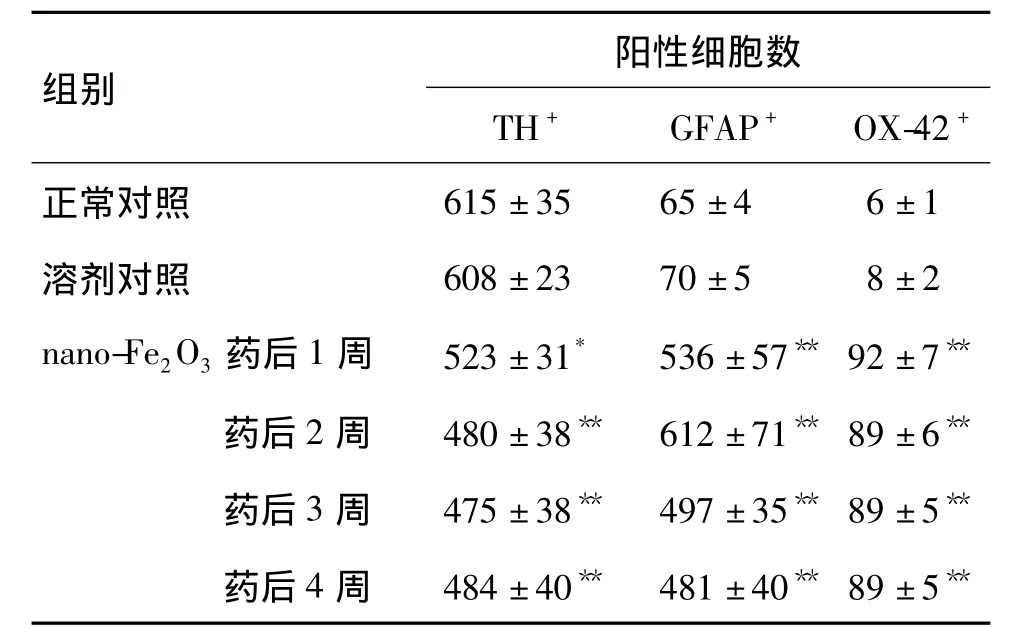
表2 大鼠腹侧中脑注射纳米三氧化二铁对TH+、GFAP+和OX-42+阳性细胞数的影响Tab.2 Effect of ventral midbrain injection of nano-Fe2O3 on positive cell numbers of TH+,GFAP+and OX-42+in rats
注射nano-Fe2O3药后1~4周,大鼠中脑黑质TH+/铁+、GFAP+/铁+、OX-42+/铁+双标细胞数量没有明显统计学差异(数据未提供)。表2结果显示,与正常对照组相比,注射生理盐水对TH+、GFAP+和OX-42+单标细胞数量无统计学差异,注射nano-Fe2O3药后1~4周TH+细胞数量显著降低(P<0.05),GFAP+和OX-42+单标细胞数量显著增加(P <0.01)。
3 讨论
Morris水迷宫研究结果发现:nano-Fe2O3组药后2和3周找到平台时间和潜伏期变长;搜索平台策略,正常对照和生理盐水组以趋向式和随机式为主,nano-Fe2O3组用药后以随机式和边缘式为主,说明nano-Fe2O3损伤中脑腹侧DA能神经元,影响到与认知功能密切相关的海马、大脑皮质额叶及其环路,引起认知功能障碍。已有证据显示[7,9],额前皮质在学习记忆中起关键作用,而大多数到达前额叶皮质的DA能传出神经发自VTA,部分发自SN,前额叶皮质通过发自于SN的DA能投射调节皮质-基底节环路处理记忆信息。本实验药后1周和4周与正常对照组无显著差异可能与药物浓度及时间和小胶质细胞对纳米铁的清除及星形胶质细胞对局部损伤的修复有关[10-11]。nano-Fe2O3组药后各组游泳速度均慢于正常对照组,可能与nano-Fe2O3对SN和VTA区DA能神经元的损伤作用有关,与临床上PD患者出现运动迟缓、肌肉僵直和震颤等症状有一定的相似性。
本实验结果显示,脑内注射nano-Fe2O3破坏黒质DA能神经元,刺激胶质细胞数目增加,胶质细胞通过吞噬nano-Fe2O3颗粒而限制其在组织中蓄积。据报道[11],在损伤前期,胶质细胞通过吞噬异物、分泌营养因子、通过自身的抗氧化应激作用、对神经毒物的清除等而发挥保护作用;在损伤后期,激活的胶质细胞可产生炎症和神经毒性因子,以不同途径启动细胞内某些信号转导通路,最终导致DA能神经元的损伤。姜宏等[6]实验结果已证实,黑质内的铁和尾状核DA含量之间有直接关系,即铁增加后,尾状核的DA含量显著减少。nano-Fe2O3组大鼠黑质区TH+细胞内有铁颗粒沉积及对DA能神经元的损伤作用,与陈先文等[5]的报道是一致的。本实验研究结果表明,胶质细胞在nano-Fe2O3注射后数量就大量增加,TH+细胞数量在药后1周减少不显著与胶质细胞在损伤前期的保护作用有一定的相关性,在药后2和3周减少非常显著与损伤后期产生的炎症和神经毒性因子促使DA能神经元损伤有关。星形胶质细胞在PD中起双重作用[12],一方面星形胶质细胞可能通过分泌神经元所需的神经营养因子和细胞因子以及合成单胺类氧化酶等发挥神经保护作用;另一方面在刺激因子作用下活化的星形胶质细胞可能通过释放炎症因子、氧自由基、影响谷氨酸和自由铁的代谢等促进PD的发生发展。因此,胶质细胞在大鼠DA能神经元损伤方面起着双重作用。
本实验结果显示,脑内注射nano-Fe2O3后损伤了SN和VTA,可导致动物的空间学习记忆功能障碍,引起DA能神经元的破坏及胶质细胞数目和形态的改变。Kircher等[13]用(280 ± 80)nm的Fe2O3通过鼻吸的方法证实,海马的神经元细胞发生脂肪变性,说明吸入小颗粒的nano-Fe2O3可以对CNS产生毒性作用。汪冰等[14]用(280 ±80)nm和21 nm的Fe2O3通过鼻腔滴注的方法证实纳米颗粒可以渗透到大脑的深部,并且观察到有破坏海马细胞形态的潜能,也可进入脑干和中脑等较深脑区。nano-Fe2O3拟作为药物诊疗常用载体或经常在nano-Fe2O3颗粒环境中工作,其对神经系统的影响不容忽视,长期大剂量接触或使用nano-Fe2O3应考虑安全性。关于不同粒径的nano-Fe2O3颗粒经不同途径进入人体对神经系统的毒性作用尤其是对中脑的损伤作用及其机制尚需做进一步的研究。
[1] Hu YL,Gao JQ.Potential neurotoxicity of nanoparticles[J].Int J Pharm,2010,394(1-2):115-121.
[2] 常雪灵,祖 艳,赵宇亮.纳米毒理学与安全性中的纳米对与纳米结构效应[J].科学通报,2011,56(2):108-118.
[3] Braydich-Stolle L, Hussain S, Schlager JJ,Hofmann MC.In vitro cytotoxicity of nanoparticles in mammalian germline stem cells[J].Toxicol Sci,2005,88(2):412-419.
[4] Ben-Shachar D, Youdim MB. Intranigraliron injection induces behavioral and biochemical"parkinsonism"in rats[J].J Neurochem,1991,57(6):2133-2135.
[5] 陈先文,陈生弟,刘振国,肖 勤,王 瑛,翁中芳.铁剂诱发黑质多巴胺能神经元变性[J].中华老年医学杂志,2002,21(1):44-47.
[6] 姜 宏,谢俊霞.脑内高铁在帕金森病病因中的作用[J].中国神经科学杂志,2001,17(2):201-204.
[7] Grahn JA,Parkinson JA,Owen AM.The role of the basal ganglia in learning and memory:neuropsychological studies[J].Behav Brain Res,2009,199(1):53-60.
[8] Yang J,Liu J,Niu G,Chan KC,Wang R,Liu Y,et al.In vivo MRI of endogenous stem/progenitor cell migration from subventricular zone in normal and injured developing brains[J].Neuroimage,2009,48(2):319-328.
[9] Faw B.Pre-frontal executive committee for perception,working memory,attention,long-term memory,motor control,and thinking:a tutorial review[J].Conscious Cogn,2003,12(1):83-139.
[10] Whitton PS. Inflammation as a causative factor in the aetiology of Parkinson's disease[J].Br J Pharmacol,2007,150(8):963-976.
[11] 白龙梅,李学忠.刘春风.星形胶质细胞在帕金森病中的作用研究现状[J].国际神经病学神经外科学杂志,2007,34(5):463-467.
[12] 东春阳,何德富,翁恩琪.铁元素与帕金森病[J].环境与健康杂志,2008,25(1):88-90.
[13] Kircher MF, Mahmood U, King RS, Weissleder R,Josephson L.A multimodal nanoparticle for preoperative magnetic resonance imaging and intraoperative optical brain tumor delineation[J].Cancer Res,2003,63(23):8122-8125.
[14] Wang B,Feng WY,Wang M,Shi JW,Zhang F,Ouyang H,et al.Transport of intranasally instilled fine Fe2O3particles into the brain:micro-distribution,chemical states,and histopathological observation[J].Biol Trace Elem Res,2007,118(3):233-243.
