拟南芥转录因子AGL47的原核表达与包涵体复性研究
2011-05-10王明凤杨文博郑文明
乔 帅,王明凤,杨文博,许 君,郑文明
(河南农业大学生命科学学院,河南郑州450002)
MADS是由4种蛋白质因子MCM1(酿酒酵母)、AGAMOUS(拟南芥)、DEFICIENS(金鱼草)和SRF(人类)的首写字母构成[1].MADS-box家族基因编码多种具有重要生物学功能的转录调节因子[2,3].在植物中 MADS-box 基因调节根、叶、花和果实的发育,特别是在植物的花分生组织和花器官发育中具有不同形式的时空表达模式[4~6].MADS-box基因广泛分布于拟南芥、金鱼草、矮牵牛、烟草、番茄和油菜等双子叶植物以及玉米、水稻、小麦和高粱等单子叶植物中[7,8];MADS-box 家族转录因子的功能涉及到植物生长发育的各个方面,决定着植物的产量、品质、抗逆等多种农艺性状,MADS-box转录因子的功能鉴定对寻找MADS-box转录因子上下游的关键调控因子,并通过调控它们的表达来达到提高作物产量、品质、抗逆性状具有重要意义[9].拟南芥基因组编码MADS-box家族转录因子107 个,包括 5 个基因亚家族[10,11].AGL47 是拟南芥第5条染色体上At5g55690基因编码的转录因子,属于 MADs-box 蛋白家族 Mβ 亚家族[12~15].ROSA等[16]的研究结果显示,拟南芥AGL47转录因子受到磷饥饿特异性正调控,极有可能在磷代谢中发挥关键性的作用.本研究利用表达载体pPET-28a在大肠杆菌中实现了AGL47融合蛋白的表达,但以包涵体的形式存在.通过对包涵体的纯化,变性和复性后,初步获得了可溶性目的蛋白,为进一步研究AGL47转录因子的功能奠定了重要基础.
1 材料与方法
1.1 材料
工程菌 E.coli DH5α 和 E.coli BL21(DE3)表达载体pET-28a由河南农业大学生命科学学院微生物实验室保存;At5g55690全长CDS克隆pENTR-At5g5569 为前期研究构建[14].
限制性内切酶BamHⅠ/XhoⅠ,T4 DNA连接酶、IPTG,蛋白质分子量标准(低)购自TaKaRa公司;尿素购自Amersco公司;谷胱甘肽/还原型谷胱甘肽,DTT,甘油购自博兴生物技术有限公司;pfu DNA聚合酶、DNA凝胶纯化试剂盒购自TIANGEN公司.质粒提取采用碱裂解法.
1.2 方法
1.2.1 PCR引物 根据 At5g55690的 CDS序列设计PCR引物,P1引物引入BamHⅠ酶切位点,P2引物引入XhoⅠ酶切位点,由北京捷瑞生物技术有限公司合成,引物序列为:P1:5’-TAGGATCCATGGGTCGAA AGATGGTA-3’,P2:5’-CGCTCGAGCATAGAA AGTTTACTTGAATC-3’.
1.2.2 AGL47融合蛋白表达载体构建 以pENTR-At5g55690质粒为模板扩增At5g55690的全长CDS,回收PCR产物,BamHⅠ和XhoⅠ双酶切后与pET-28a定向连接,连接产物转化大肠杆菌DH5α,卡那霉素(Kanamycin,kan)抗性筛选阳性菌株.阳性菌株进行菌落PCR、质粒PCR和双酶切鉴定,鉴定后的阳性克隆送上海博尚生物技术公司测序.重组质粒命名为pET-28a-At5g55690.
1.2.3 融合蛋白诱导表达 将pET-28a-At5g55690转入大肠杆菌BL21(DE3),挑选单菌落接种于5 ml LB液体培养基(含kan 50 mg·L-1)的离心管中,37 ℃,220 r·min-1,振荡培养过夜,次日按 1∶100(V/V)比例接种于含5 mL新鲜LB培养基(含kan 50 mg·L-1)的 15 mL离心管中,37 ℃,220 r·min-1振荡培养,当菌液 OD600值达 0.6 ~ 0.8时,取1 mL菌液做对照,其余4 mL菌液加入IPTG至培养基中,IPTG 浓度为1 mmol·L-1诱导4 h.取1 mL菌液于4℃,12 000 g离心5 min,收集菌体沉淀用5 μL PBS悬浮,加入50μL的2×SDS-PAGE上样缓冲液,充分混匀,100℃煮沸至样品不再呈黏稠状,10%SDS-PAGE电泳检测融合蛋白表达情况.另外3 mL菌液于4℃,12 000 g离心5 min,加入1 mL PBS(pH值为7.4),超声破碎菌体99×2 s间歇 5 s(冰浴).4 ℃,12 000 g离心20 min.取上清和沉淀,SDS-PAGE电泳鉴定蛋白的可溶性.
1.2.4 包涵体纯化 诱导表达150 mL细菌培养物,离心收集表达菌体.在20 mL裂解缓冲液(10 mmol·L-1Tris-Cl pH 值为 8.8,50 mmol·L-1NaCl,1 mmol· L-1EDTA,5% 甘油,0.1 mmol·L-1DTT,1 mmol·L-1PMSF,2%Triton X-100)中超声破碎后,离心收集沉淀.用洗脱缓冲液(2%Triton X -100,10 mmol·L-1Tris-Cl pH 值为 8.8,2.5mol· L-1NaCl,1mmol· L-1EDTA,0.1 mmol·L-1DTT)洗涤样品 3 次,每次 250 mL;然后用重悬缓冲液(10 mmol·L-1Tris-Cl pH值为8.8,50 mmol·L-1NaCl,1 mmol·L-1EDTA,0.1 mmol·L-1DTT,4 mol·L-1尿素,1 mmol·L-1PMSF,2%Triton X-100)洗涤1次,最后离心沉淀即为纯化后的包涵体[17~20].包涵体可以立即用于变性复性,也可以放置-70℃保存备用.
1.2.5 AGL47融合蛋白复性 蛋白质复性采用透析复性法:将洗涤纯化后的包涵体用20 mL增溶缓冲液(10 mmol·L-1Tris-C1 pH 值为 8.8,1 mmol·L-1EDTA,0.1 mmol·L-1DTT,6 mmol·L-1尿素,50 mmol·L-1NaCl,1 mmol·L-1PMSF,5%甘油,2%Triton X-100)融解,超声波助溶10×2 s间歇5 s至沉淀完全融解,冰浴2 h,中间不断晃动均匀样品确保包涵体融解完全.4℃,12 000 g离心30 min除去不融物和细胞碎片,变性液放置1 L复性缓冲液Ⅰ(10 mmol·L-1Tris-C1 pH值为8.8,0.1 mmol·L-1DTT,50 mmol·L-1NaCl,1 mmol·L-1PMSF,5%甘油)中,透析复性 6 h,更换成1 L复性缓冲液Ⅱ(10 mmol·L-1Tris-C1 pH值为8.8,50 mmol·L-1NaCl,1 mmol·L-1PMSF,5%甘油),透析复性6 h;更换成1 L复性缓冲液Ⅲ(10 mmol·L-1Tris-C1 pH 值为 8.8,50 mmol·L-1NaCl,1 mmol·L-1PMSF,5% 甘油,1 mmol·L-1GSH,0.2 mmol·L-1GSSH)6 h 后更换复性缓冲液Ⅲ1 次,继续透析至总透析时间为 24 h[18~20].4℃,12 000 g离心30 min除去沉淀物,SDS-PAGE检测复性蛋白纯度及复性效果.
2 结果与分析
2.1 AGL47融合蛋白表达载体构建
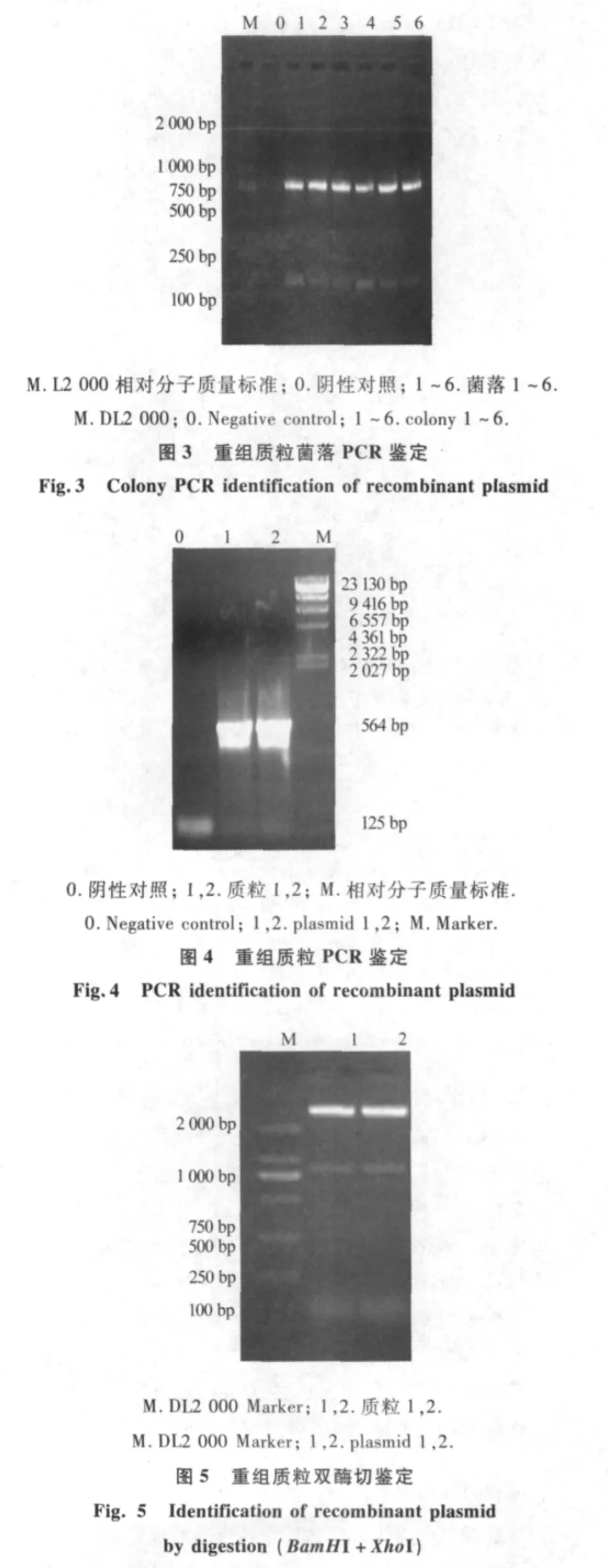
以pENTR-At5g55690质粒为模板,以P1和P2为引物扩增得到850 bp基因片段,BamHⅠ与XhoⅠ双酶切后与原核表达载体pET-28a定向连接,构建重组质粒(图1和图2).重组质粒转入大肠杆菌DH5α,卡那霉素筛选阳性克隆,菌落PCR和质粒PCR均获得850 bp扩增片段(图3和图4).双酶切鉴定重组质粒得到大约834 bp的外源插入片段,与预期大小相符(图5).经测序鉴定,重组质粒的外源插入正确,重组质粒命名为 pET-28a-At5g55690.
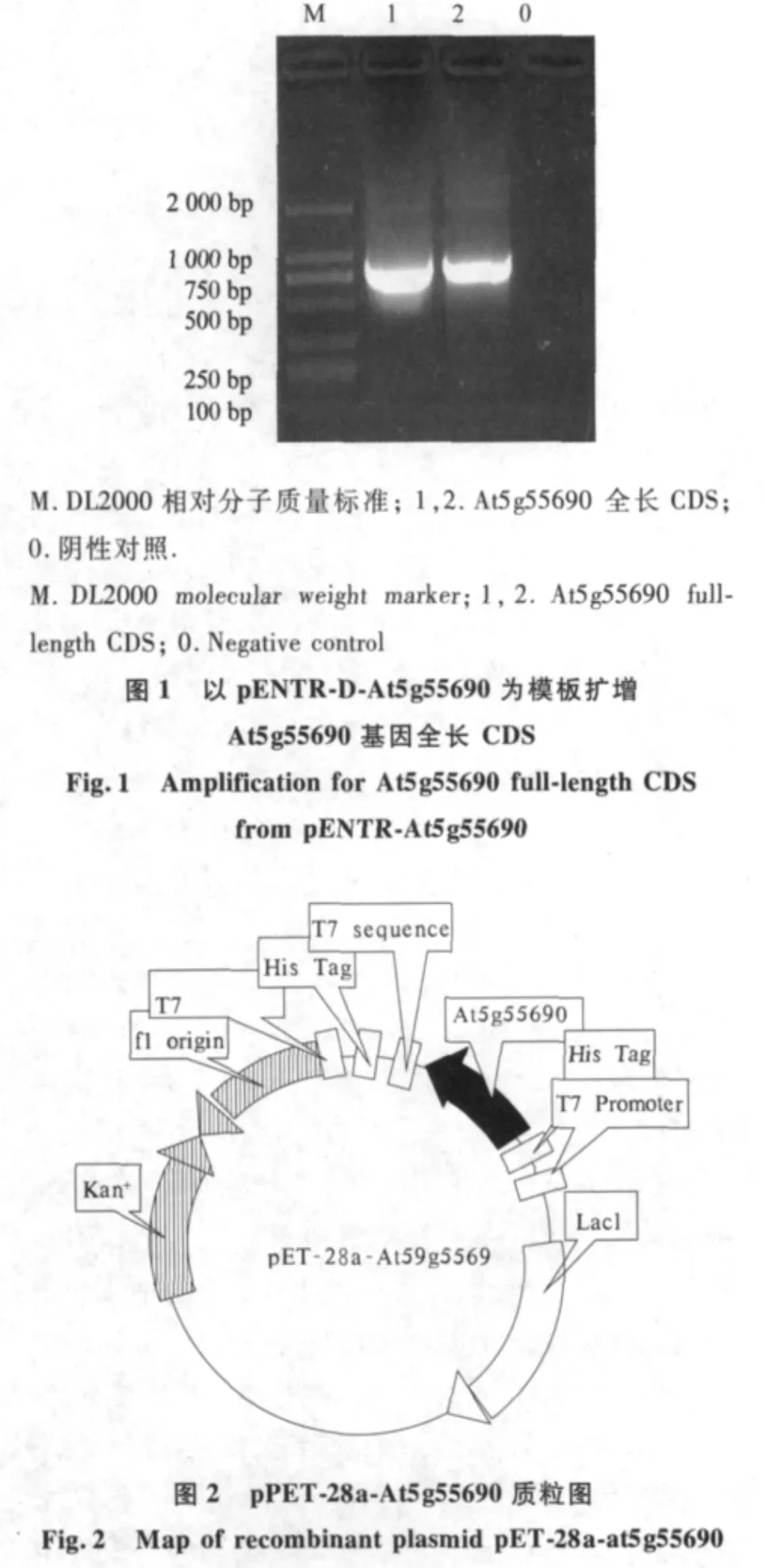
2.2 AGL47融合蛋白诱导表达
重组表达载体pET-28a-At5g55690转化大肠杆菌 BL21(DE3),用1 mmol·L-1IPTG 诱导融合蛋白表达.SDS-PAGE结果显示,诱导前融合蛋白没有表达,诱导后融合蛋白开始表达.但电泳结果表现为融合蛋白分布在3个条带(图6-A,B,C).其中A条带约为35 kD,大小与完整AGL47融合蛋白大小相符;推断B、C代表不同剪切本蛋白或不完整的AGL47融合蛋白,准确序列尚待纯化测序鉴定.空载体质粒转入大肠杆菌BL21(DE3)后,没有显示出诱导效应(图6).

图6 AGL47融合蛋白诱导表达Fig.6 Induced expression of AGL47 fusion protein in E.coli.
2.3 AGL47融合蛋白可溶性鉴定、复性及纯化
AGL47融合蛋白溶解性鉴定结果显示,诱导表达的目的蛋白以包涵体形式存在.纯化复性后目的蛋白仍在相同的位置呈现A,B,C 3条带,A带为完整目标融合蛋白,B,C带存在说明可能不同剪切或不完整的蛋白亦存在于包涵体中(图7).复性后透析袋内没有沉淀发生,说明目的蛋白以可溶的形式存在;复性后蛋白的SDS-PAGE结果显示,纯化后复性的蛋白中只有A,B,C 3条带,说明包涵体纯化成功,并初步获得了可溶性目的蛋白(图7).
3 讨论
转录因子蛋白具有诱导表达和不稳定的特点,在原核细胞中表达,由于表达速度非常快,而且缺乏正常的折叠环境和辅助折叠因子,易于形成包涵体.本研究中AGL47融合蛋白以包涵体的形式存在,纯化后SDS-PAGE仍呈现A,B,C 3条带,说明该融合蛋白表达存在复杂情况,这种现象在转录因子的原核表达中经常出现,可以通过进一步纯化获得目标蛋白[21].本研究中A带为完整目的蛋白,B,C带蛋白准确序列尚待进一步鉴定.
运用DNAMAN软件分析AGL47蛋白质氨基酸序列特征,显示该蛋白等电点pI 7.8左右.因此,实验中将变性复性缓冲液的pH值调至8.8,偏离AGL47蛋白的等电点,避免蛋白在等电点处析出.AGL47蛋白一共含有6个Cys,推测含有3对二硫健,这大大增加了蛋白复性时错误折叠的可能性.同时,不同多肽链之间二硫键的结合,使融合蛋白在复性时容易以沉淀的形式析出,从而造成复性失败.在本实验中,为了防止此现象的发生,成功获得可溶性蛋白,在透析液中在复性前期加入DTT作为还原剂,阻止二硫键的形成;在透析复性后期,在透析液中加入GSH/GSSG组合以帮助融合蛋白的正确折叠[17~20].
拟南芥基因组编码1 800个以上的转录因子,最近几年通过对拟南芥和水稻两种模式植物的低磷芯片数据分析,发现植物对低磷反应的适应性调控机制主要发生在转录水平上,目前已经分离鉴定到了多个发挥重要作用的低磷响应转录因子[22,23].本研究前期结果显示拟南芥转录因子AGL47受磷胁迫的特异调控,缺磷诱导下转录水平提高64.2倍,极有可能在磷调控通路中发挥重要的作用[16],本研究在原核细胞内实现了AGL47蛋白的表达,为进一步研究AGL47蛋白的结构和转录活性及其在磷调控基因网络中的作用奠定重要基础.
[1] SCHWARZ Z S,HUIJSER P,NACKEN W,et al.Genetic control of flower development by homeotic genes in Antirrhinum majus[J].Science,1990,250:931 -936.
[2] 段远霖,李维明,吴为人,等.植物MADS-box基因的研究进展[J].福建农林大学学报:自然科学版,2003,32(1):104-108.
[3] ANGENENT G C,COLOMBO L.Molecular control of ovule development[J].Trends Plant Sci,1996,1:228-232.
[4] OKADA K,SHIMURA Y.Genetic analysis of signaling in flower development using arabidopsis[J].Plant Mol Biol,1994,26:1357 -1377.
[5] COEN E S,MEYEROWITZ E M.The war of the whorls:genetic interactions controlling flower development[J].Nature,1991,353:31 -37.
[6] WEIGEL D,MEYEROWITZ E M.The ABCs of floral homeotic genes[J].Cell,1994,78:203 -209.
[7] ECKARDT N A.MADS monsters controlling floral organ identity[J].Plant cell,2003,15(4):803 -805.
[8] FERRARIO S,IMMINK R G H,SHCHENNIKOVA A,et al.The MADS box gene FBP2 is required for SEPALLATA function in petunia[J].Plant Cell,2003,15:914-925.
[9] 刘菊华,徐碧玉,张 静,等.MADS-box转录因子的相互作用及对果实发育和成熟的调控[J].遗传,2010,32(9):893-902.
[10] RIECHMANN J L,HEARD J,MARTIN G,et al.Arabidopsis transcription factors:genome-wide comparative analysis among eukaryotes[J].Science,2000,290:2105- 2110.
[11] PARENICOVA L D E,KIEFFER M.Molecular and phylogenetic analyses of the complete MADS-box transcription factor family in Arabidopsis:new openings to the MADS world[J].Plant Cell,2003,15(7):1538 -1551.
[12] DE BODT S,RAES J,FLORQUIN K,et al.Genomewide structural annotation and evolutionary analysis of the type I MADS - box genes in Plants[J].J Mol Evol,2003,56(5):573-586.
[13] RUMIKO K,NAOMI S,MISUZU Y,et al.Evolution and divergence of MADS-box gene family based on genome wide expression analyses[J].Mol Biol Evol,2003,20(12):1963-1977.
[14] DEBODT S,RAES J,VANDE PEER Y,et al.And then there were many:MADS goes genomic[J].Trends Plant Sci.2003,8(10):475 -483.
[15]石家春,邓晓旭,刘卫群.拟南芥GA20氧化酶家族的生物信息学分析[J].河南农业大学学报,2010,44(4):459-458.
[16] ROSA M,RAJENDRA B,ZHENG W M,et al.Genome-wide reprogramming of metabolism and regulatory networks of Arabidopsis in response to phosphorus[J].Plant,Cell and Environment,2007,30:85 -112.
[17]HAI H,YUKIKO M,YI H.Isolation and characterization of the binding sequences for the product of the Arabidopsis floral homeotic gene AGAMOUS[J].Nucleic Acids Research,1993,21(20):4769-4776.
[18]吴正辉,郜金荣,佘应龙,等.不同复性条件对重组人组织纤溶酶原激活剂复性的影响[J].武汉大学学报:自然科学版,2008,54(4):462 -466.
[19]李 炯,崔凯军,文 静,等.人白细胞介素4的原核表达、复性、纯化及生物学活性鉴定[J].生物医学工程学杂志,2007,24(4):866 -869.
[20]梁 兰,余 蓉,邓 璇,等.透析法体外复性抗凝溶栓双功能HV12p 2rPA融合蛋白[J].药物生物技术,2009,16(2):140-143.
[21] AI-SAMARRAI T H,KIRK C A,JONES W T,et al.Expression in escherichia coli and in vitro refolding of the plant transcription factor Arabidopsis thaliana RGL3[J].Protein Expression and Purification,2007,53:289-292.
[22] SHINOZAKI K,DENNIS E S.Cell signaling and gene regulation global analyses of signal transduction and gene expression profiles[J].Current Opinion in Plant Biology,2003,6:405 -409.
[23] WU P,MA L,HOU X,et al.Phosphate starvation triggers distinct alteration of genome expression in Arabidopsis roots and leaves[J].Plant Physiol,2003,132:1260-1271.
