谷胱甘肽合成酶基因St GCS-GS的表达提高大肠杆菌对重金属的抗性
2011-05-07李平平柳生奎邱志奇安志刚
李平平,柳生奎,邱志奇,安志刚*
(1.东北林业大学盐碱地生物资源环境研究中心,哈尔滨150040;2.广州中山大学生命科学学院,广州510275)
重金属是一类主要的环境污染物,对生物的生存构成严重威胁。有些重金属如 Co,Cu,Fe,Mn,Ni,Zn是生物体所必需的微量元素,通过形成稳定的复合物在生化反应中起着重要的作用。如催化代谢反应,调节细胞的渗透压,稳定蛋白质和细胞壁结构[1-3]。生物体所需这些重金属含量是极低的。而其他非必需重金属如Ag,Al,Cd,Au,Pb和Hg则没有任何生理生化作用,非必需重金属元素和过量的必需重金属元素对生物都是有害的。重金属对生物体的毒害作用主要有三种:软性金属,如Cd,Hg,Ag能够与巯基发生化学作用[4],使得活性位点含有巯基的酶失去活性,或者与细胞内重要的微量元素相互作用,抑制其生理功能[3]。有氧化还原活性的重金属,如Cu,Fe,Mn直接参与氧化反应。其他重金属,如 Ni,Co,Zn能够通过呼吸作用、光合作用氧化传递链的解耦联,或降低谷胱甘肽 (GSH)含量间接造成氧化逆境,导致细胞内活性氧自由基积累。
真核生物体内存在一些蛋白或多肽类,如金属硫蛋白 (MTs)、谷胱甘肽 (GSH)和植物络合素(phytochelatins,PCs)等所具有的-SH具有与金属离子结合形成硫肽复合物的功能,这些复合物通过一些转运蛋白的作用能够运输到胞外,或者将其储存在液泡等细胞器内,降低重金属的毒性。金属硫蛋白主要参与铜离子平衡,而植物络合素(PCs)和谷胱甘肽 (GSH)则主要对Cd离子的有效解毒起主要作用。
谷胱甘肽 (GSH)是由谷氨酸和半胱氨酸、甘氨酸三个氨基酸组成的三肽,广泛存在于生物体内,主要由谷氨酰半胱氨酸合成酶 (γ-GCS)和谷胱甘肽合成酶 (GS)催化的两个连续反应合成,其中γ-GCS受产物GSH的反馈抑制。编码γ-GCS和GS的基因gshA及gshB已被测序并克隆出来,早期研究表明γ-GCS催化活性受GSH的反馈抑制[5]。GSH有多种生物功能,与其分子结构有着密切关系。分子结构中的活性巯基重要的生化作用,使其能络合金属离子,降低重金属对细胞的毒害。且其作为一种抗氧化剂,能够清除重金属毒性产生的活性氧自由基。所以,提高GSH的含量可能提高生物体对重金属的耐性。采用转基因技术在植物、微生物体内过量表达大肠杆菌γ-GCS或GS,可以将GSH含量提高2~6倍[6]。在印度芥菜中分别过量表达了γ-GCS、GS这两种酶,均增加了植物对Cd的耐性和积累[7-8]。但在拟南芥中过量表达γ-GCS却未增加Cd的耐性[9]。在烟草中过量表达大肠杆菌的γ-GCS反而引发了严重的氧化胁迫[10]。这种表型可以通过转入GS部分恢复过来。在以后的研究中发现,适当的平衡γ-GCS和GS这两种酶的活性、并且定位在相同的部位 (细胞质或质体)是提高GSH含量的关键[6]。
在植物、微生物体内表达革兰氏阳性菌无乳链球菌的谷胱甘肽合成酶基因StGCS-GS可以解决这一问题。该功能基因是编码具有γ-GCS和GS两种活性的双功能融合蛋白γ-GCS-GS,且γ-GCS的催化活性对GSH的反馈抑制不敏感。Bjorn等研究也表明GSH对S.agalactiae的γ-GCS-GS的的γ-GCS催化活性影响较小,且在应用试验的条件下,S.agalactiae的细胞中确实积累了大量的GSH(304 ± 11nmol/mg protein)[11]。Verena 等在烟草中表达这种酶,叶片中积累了大量的GSH,是野生型的20~30倍,且未对植株生长产生有害影响,并表现出对Cd较强的耐性[6]。目前未见在原核生物中过量表达该酶的报道。
本文将无乳链球菌的同属菌嗜热链球菌 (S.thermophilus)的功能基因StGCS-GS转入大肠杆菌,得到了转化菌株,并对其在重金属Cd、Ni、Cu胁迫条件下的生长情况进行了研究。
1 材料与方法
1.1 材料
1.1.1 质粒和菌株
所用大肠杆菌 (Eshenchia coli)菌株为Rosetta-gamiTM(含有质粒pETG-10A+GCSGS)。起始质粒为pETG-10A,质粒图如图1所示。采用Gateway技术将StGCS-GS基因克隆到原核表达载体pETG-10A上 (与中山大学合作)。
1.1.2 试剂
生物素标记的羊抗兔Ig G抗体 (与中山大学合作开发)。
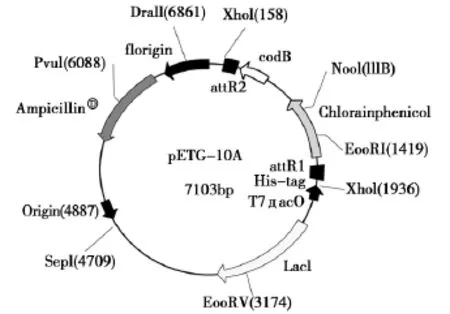
图1 质粒图Fig.1 Plasmid map
1.2 方法
1.2.1 His-GCS-GS融合蛋白的表达与纯化
取含有质粒pETG-10A+GCS-GS的大肠杆菌过夜培养物各2 ml,加入到含有50 μg/ml Amp的LB培养基中进行培养,并在37℃的温度下振荡培养,待菌液浓度为OD600=0.5时,加入0.1 mM IPTG,进行诱导培养。收集菌液。6 000 g/4℃/10 min离心,弃上清,沉淀至于冰上。加入5ml冰冷的裂解缓冲液 (50 mM NaH2PO4,300 mM NaCl,10mM imidazole,PH 8.0),悬浮细胞沉淀;再向悬浮液中加入含1 ml 10 g/L溶菌酶、6 μl 1M PMSF,冰浴30 min,进行细胞裂解;13 000 g/30 min/4℃ 离心,将上清液转移到新的离心管中。与此同时加入1 ml Ni-agarose于蛋白纯化柱中,静止30min。然后加蛋白液于柱中,进行目的蛋白的纯化;待总蛋白溶液被充分吸附后,用5倍体积的漂洗缓冲液 (50 mM NaH2PO4,300 mM NaCl,20mM imidazole,PH 8.0)漂洗杂蛋白;清洗完毕后,加入300 μl洗脱缓冲液 (50 mM NaH2PO4,300 mM NaCl,250mM imidazole,PH 8.0),静止30min,收集洗脱液,重复3次。取15 μl样品进行SDS-PAGE电泳检测,用考马斯亮蓝进行胶染色;纯化后的目的蛋白置PB(pH 7.0)缓冲液中,过夜透析。取适量进行SDS-PAGE电泳,并进一步Western blot检测。
1.2.2 Western blot
SDS-PAGE结束后,取出胶,置转移缓冲液(20 ml Tris-base,11.26 g甘氨酸,200 ml甲醇,dH2O容至1L)浸泡20min。将表达产物电转移到硝酸纤维膜上,加入新鲜配制的封闭液 (含5%的脱脂奶粉的的TBS)4℃封闭过夜。弃去封闭液,加入一抗 (1:5000)室温振荡孵育1h。将结合了一抗的硝酸纤维膜置于洗膜缓冲液 (加200μl Tween 20于200mldH2O中)中洗3次,每次10min。用生物素标记的羊抗兔Ig G为二抗 (1;2000)室温振荡孵育1h。洗去二抗,用100ml检测平衡液 (100mM Tris-HCl,100mM NaCl,pH 9.5)平衡,1~5min。NBT/BCIP室温避光显色至出现理想条带,照相。
1.2.3 转基因大肠杆菌在重金属胁迫条件下的生长状态的比较
将含有pETG-10A+GCS-GS和野生型的大肠杆菌 (Rosetta-gamiTM)单克隆接种于2mlLB液体培养基中37℃/200rpm振荡培养过夜。取5ul菌液加入200mlLB中扩大培养10h。测定OD600,计算使50ml菌液浓度OD值达到0.5所需菌液的量,3000rpm/10min集菌,将收集的菌体加入50ml对照培养基以及分别含有0.5mM CdCl2、0.75mM CdCl2、1mM CdCl2、1Mm NiSO4、2mM NiSO4、3mM NiSO4、0.5 mM、1.5 mM、3 mM 和 5mM CuCl2的LB培养基中,37℃/200rpm振荡培养。每2h测一次OD600值,共测定20h,并用Excel表格对数据进行统计分析。
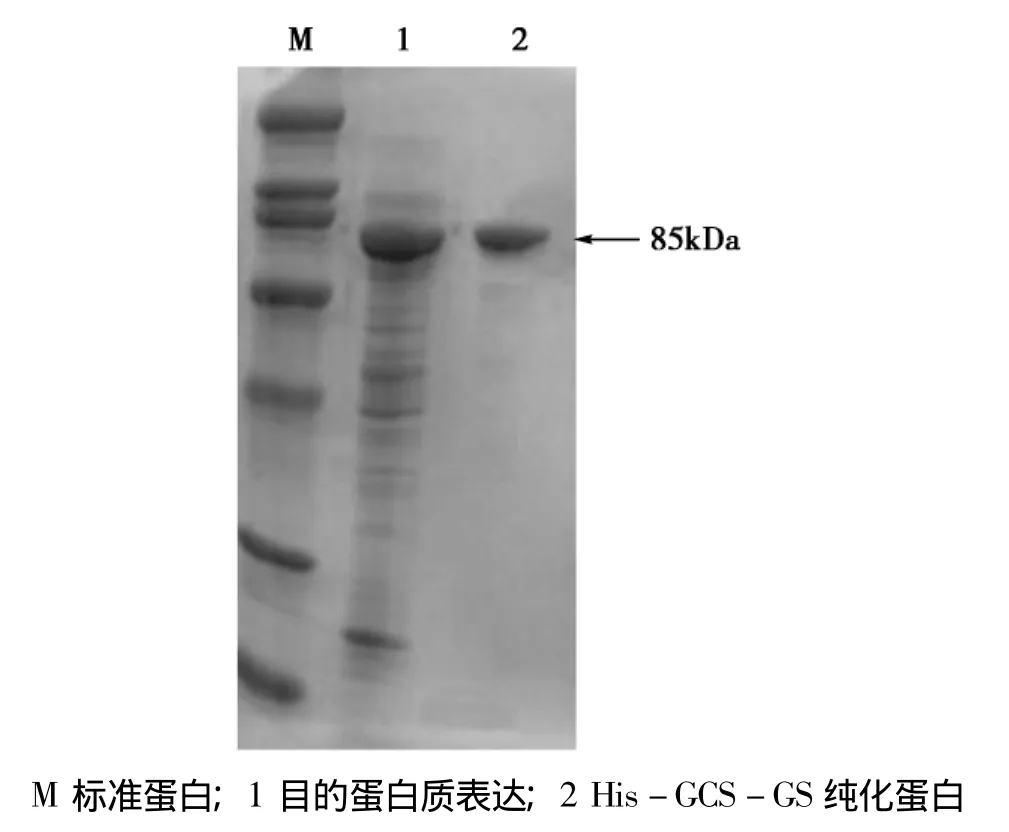
图2 纯化融合蛋白His-GCS-GS在浓度10%上的聚丙烯酰胺凝胶电泳图Fig.2 10%SDS-PAGE of His-GCS-GS proteins isolated by affinity chromatography from culture supernatant
2 结果与分析
2.1 His-GCS-GS融合蛋白的纯化与鉴定
表达产物经亲和层析和透析脱盐后,取适量进行SDS-PAGE并进一步Western Blot鉴定。SDSPAGE结果显示纯化后融合蛋白纯度较高如图2所示,Western blot结果证实成功获得His-GCS-GS融合蛋白如图3所示。
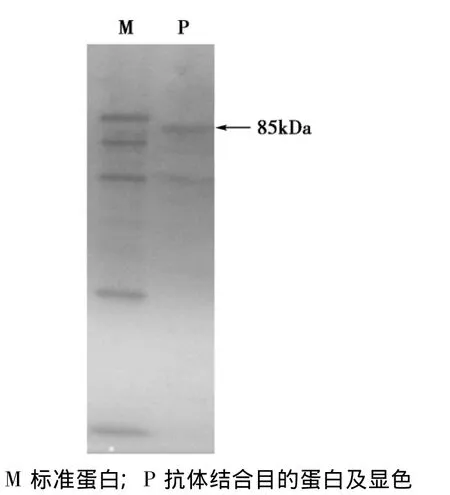
图3 利用抗体对His-GCS-GS融合蛋白进行Western blot分析Fig.3 Western blot analysis of His-GCS-GS fusion protein
2.2 转基因大肠杆菌对重金属Cd、Ni和Cu的耐受性
在正常条件下,Petg10A+GCS-GS转化菌和野生对照菌的生长势几乎没有差别,如图4(a)所示。在加入不同的重金属后,两个菌株的生长势出现了差异。在不同浓度的CdCl2胁迫下,转化菌和对照菌的生长都受到抑制,但随着CdCl2浓度的增加,两者的耐受差异逐渐增大,当浓度为1mM时,差异最明显,如图4(b)所示,转化菌的数量几乎是对照菌的2倍。在NiSO4存在条件下,当NiSO4浓度较低时 (1mM),两者的生长势无明显差别。当NiSO4浓度为2mM时,两者的耐受差异最明显,如图4(c)所示,转化菌的数量约是对照菌的2倍。在CuCl2的浓度分别为0.5 mM、1.5 mM、3 mM和5 mM时,两者的生长势无明显差别。以上结果表明,嗜热菌StGCS-GS基因的表达对大肠杆菌在Cd、Ni胁迫下的生长发挥重要作用。
3 讨论

图4 转StGCS-GS基因的大肠杆菌在重金属胁迫条件下的生长曲线Fig.4 Growth curve of StGCS-GS-expressing E.coli cells to heavy metal stress
Cd、Ni对大肠杆菌的毒害作用主要是使其细胞内产生过多的过氧化物,从而引起氧化胁迫[13]。目前,细菌细胞内主要存在3种重金属抗性机制。一是通过外排机制来限制细胞内的重金属浓度。二是与含有巯基的复合物相结合。三是改变重金属离子的氧化态,降低其毒性[1]。大量文献记载,植物中也同样存在这些重金属耐受机制[13]。GSH作为一种抗氧化剂直接参与逆境胁迫产生的活性氧簇的还原。而且能够络合重金属,在细胞内重金属的解毒起重要作用。大量研究表明,通过在植物中过量表达GSH合成相关的基因,能够提高其对重金属的抗性。除真核生物之外,细菌也依靠细胞内的GSH来抵御重金属毒害。自身不能合成GSH的细菌也会利用胞外的GSH或胞内其他的巯基化合物如谷氨酰半胱氨酸 (γ-EC)来替代GSH[14]。本文向大肠杆菌中转化StGCS-GS基因,得到了与Verena等[6]人相似的研究结果,过量表达嗜热链球菌 (S.thermophilus)的谷胱甘肽双功能合成酶基因提高了大肠杆菌对重金属Cd的抗性。为进一步研究该基因在其他重金属胁迫下的功能,本文又研究了过量表达该基因的大肠杆菌在Ni、Cu胁迫下的耐受性。结果表明,过量表达该基因提高了对Ni的耐受性,对Cu的耐受性却没有提高。推测原因可能是在这种遗传背景下,GSH可能不是抵抗Cu胁迫所必需的。
[1] Nies D H.Microbial heavy-metal resistance[J].Appl Microbiol Biotechnol,51:730 – 750.
[2] Rossbach S,Kukuk M L,Wilson T L,et al.Cadmium-regulated gene fusions in Pseudomonas fluorescens[J].Environ Microbiol,2000(2):373–382.
[3] Bruins M R,Kapil S,Oehme F W.Microbial resistance to metals in the environment[J].Ecotoxicol Environ Saf,2000(45):198-207.
[4] Hultberg B,Andersson A,Isaksson A.Copper ions differ from other reactive metal ions in their effects on the concentration and redox status of thiols in HeLa cell cultures[J].Toxicology,1997(117):89-97.
[5] Murata K,Kimura A.Overproduction of Glutathione and its derivatives by genetically engineered microbal cells[J].Biotechnol Adv,1990(8):59-96.
[6] Verena,Andreas W,An Z,et al.Exp-Loiting plants for glutathione(GSH)production:Uncoupling GSH synthesis from celluar controls results in unprecedented GSH accumulation[J].Plant Biotechnology joural,2010(8):1-14.
[7] Zhu Y L,Pilon-Smits E A H,Jouanin L,et al.Overexpression of glutathione synthetase in Indian mustard enhances cadmium accumulation and tolerance[J].Plant Physiol,1999(119):73-79.
[8] Zhu Y L,Pilon-Smits E A H,Tarun A S,et al.Cadmium tolerance and accumulation in Indian mustard is enhanced by overexpressingγ-glutamylcysteine synthetase[J].Plant Physiol,1999(121):1169-1177.
[9] Goldsbrough P B.Metal tolerance in plants:the tole of phytochelatins and metallothioneins[A].Terry N Banuelos GS.Phytoremediation of Trace Elements[C].Michigan:Ann Arbor,1998.
[10] Creissen G P,Firmin J,Fryer M,et al.Elevated glutathione biosynthetic capacity in the chloroplast of transgentic tobacco plants paradoxically causes increaced oxidative stress[J].Plant cell,1999(11):1277-1291.
[11] Bjorn V,Dark D V,Jozef J,et al.Charaterization of the Bifunctional γ-Glutamate-cysteine Ligase/Glutathion Synthetase(GSH)of Pasteurella multoxida[J].The Journal of Biological Chemistry,2006(7):4380-4394.
[12] Ceslin C,Llanos J,Prieur D,et al.The manganese and iron superxiode dismutases protect Escherichia coli from heavy metal toxicity [J].Res Microbiol,2001(152):901-905.
[13] Clemens S.Mechanism of plant metal tolerance and homeostasis[J].Planta,2001,212:475-486.
[14] Kerstin H,Corinna B,Gerd J K,et al.Glutathione and Transition-Metal Homostasis in Escherichia coli[J].Journal Of Bacteriology,2008(15):5431-5438.
