N胁迫对黄瓜嫁接苗生长及光合特性的影响
2011-05-02王秀峰杨凤娟史庆华
刘 燕,王秀峰,杨凤娟,魏 珉,史庆华
(山东农业大学园艺科学与工程学院,作物生物学国家重点实验室,园艺作物生物学农业部重点开放实验室山东泰安 271018)
在设施生产中,由于设施的特殊环境及大量肥料施入,加之无雨水淋洗等原因,容易造成土壤次生盐渍化[1],不仅严重影响了作物的生长,而且降低其产量及品质。黄瓜(Cucumis sativus L.)是我国设施主栽蔬菜作物之一,由于其根系较浅,具有喜肥不耐肥的特点,易受盐害。土壤次生盐渍化已成为设施黄瓜生产的主要障碍,但其中主要的胁迫阴离子为N[2]。研究表明,盐胁迫明显降低黄瓜[3]、玉米[4]的光合速率,而通过嫁接可以明显提高植物的光合速率[5,6]。生产实践中已证实嫁接换根栽培不但可以有效地预防作物各种病害的发生,还有利于提高作物的抗逆性[1,5,7,8,9],从而提高经济效益。而在 N胁迫下,黄瓜嫁接改善幼苗光合速率机理的研究,目前还较少。为此,本试验以栽培面积较大的蔬菜作物黄瓜及嫁接专用砧木‘铁力砧F1’南瓜为材料,进行嫁接,对N胁迫下嫁接苗和自根苗生长、光合特性进行了研究,以期为改善硝酸盐对作物胁迫及蔬菜作物上合理施用氮肥提供理论依据。
1 材料与方法
1.1 材料及处理
试验于2008年10~11月在山东农业大学玻璃温室内进行。供试黄瓜品种为‘新泰密刺’(山东新泰市祥云种业有限公司提供),砧木为‘铁力砧F1’南瓜(山东昌邑市砧木研究所提供)。按常规方法浸种催芽,挑选发芽整齐的黄瓜接穗和砧木种子分别播于穴盘(50孔)和营养钵(8 cm×8 cm),黄瓜比南瓜提前两天播种。待黄瓜子叶展平、真叶刚露头时采用改良插接法进行嫁接。嫁接分为黄瓜与黄瓜自根嫁接(自根苗)和黄瓜与南瓜嫁接(异接苗),以黄瓜不嫁接(自根苗)作对照。待幼苗长至三叶一心时,选长势一致的幼苗定植于水培槽中,营养液大量元素参照山崎配方,微量元素采用Arnon配方。预培养3 d后,进行N胁迫处理,浓度为140 mmol/L,N由Ca(NO3)2·4H2O和KNO3各50% 组成,分2次加入营养液中,每隔24 h加入一次,使浓度达到140 mmol/L。正常N浓度(14 mmol/L)的营养液为对照。营养液用浓H2SO4调节pH值保持在5.5~6.5之间,每3 d更换一次营养液。胁迫9 d后进行生理指标的测定。
1.2 测定项目与方法
1.2.1 形态指标的测定 胁迫前,各处理随机选取植株5株(做标记),测定株高(接穗子叶下端至生长点)、茎粗(接穗子叶下端)和叶面积;处理9 d后再分别测定上述5株幼苗的株高、茎粗和叶面积。用直尺测量叶片长(L)和宽(W),按以下公式计算叶面积(A),取平均值。A=14.16-5.0×(L)+0.94×(L2)+0.47 ×(W)+0.63 ×(W2)-0.62 ×(L ×W)[10]。
1.2.2 气体交换参数的测定 选择晴朗无风的天气,于上午9:00~11:30用美国LI-COR公司生产的Li-6400便携式光合仪,测定叶片的净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)等值。测定时使用红蓝光源叶室,光强为800 μmol·m-2·s-1,温度25℃,CO2浓度380±10 μmol·mol-1,选取上数第3片完全展开的功能叶进行测定,每处理随机测定5片叶。
1.2.3 叶绿素荧光参数的测定 Fo、Fm、Fm'、Fs等荧光参数采用英国Hansatech公司生产的FMS-2脉冲调制式叶绿素荧光仪[11]测定。将叶片暗适应30 min后,测定最大荧光及PSⅡ最大光化学效率Fv/Fm。光适应下PSⅡ实际光化学效率ΦPSⅡ按(Fm'-Fs)/Fm'计算,光适应下荧光参数的的测定参见文献[12]。
采用Excel2003和DPS7.05软件对实验数据进行差异显著性分析。
2 结果与分析
表1 N胁迫对嫁接苗生长的影响Table 1 Effect of nitrate stess on the growth of grafted seedling

表1 N胁迫对嫁接苗生长的影响Table 1 Effect of nitrate stess on the growth of grafted seedling
CK:黄瓜自根苗 Own-rooted seedlings;ZJ:以黄瓜做砧木的嫁接苗 (自根苗)Grafted seedlings with cucumber as rootstork;YJ:以南瓜做砧木的黄瓜嫁接苗(异接苗)Grafted seedlings with pumpkin as rootstock.同列数值不同字母表达差异达5%显著水平。Different letters within the same column indicate sighificant difference at 5%level.下同 The same below.

图1 N胁迫对嫁接苗净光合速率的影响Fig.1 Effects of Nstress on the photosynthetic rate of grafted seedling
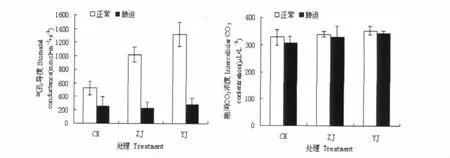
图2 N胁迫对嫁接苗气体交换参数的影响Fig.2 Effects of Nstress on the gas exchange parameter of grafted seedling
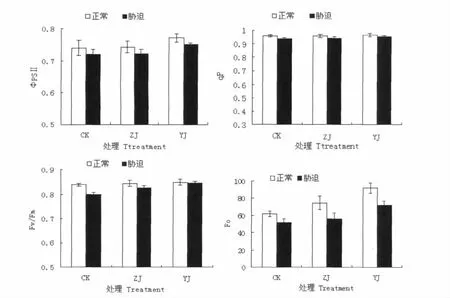
图3 N胁迫对嫁接苗叶绿素荧光参数的影响Fig.3 Effects of Nstress on the chlorophyll fluorescence parameter of grafted seedling
3 小结
与黄瓜自根苗相对较弱的根系相比,异接苗(YJ)凭借砧木发达的根系,具有更强的吸收水分与养分的能力,有利于地上部的生长和发育,促进植株的生长。而自接苗(ZJ)的生长势不但没有增强反而有所减弱,其原因可能是:虽然ZJ也进行了嫁接过程,但其嫁接不仅未能促进植株生长,反而延迟了生长,说明单纯的嫁接伤口刺激对生长没有促进作用。
盐胁迫通过抑制光合作用间接影响生长[13]。水培条件下植株根系首先接触高盐营养液,易引起渗透胁迫,导致其水势及气孔导度降低[14]。本试验条件下,由于异接苗(YJ)砧木根系的作用,使其受盐胁迫程度相对较轻。Farquha等[15]认为,当Gs与Ci同时下降时,Pn下降主要是由气孔限制因素引起的,如果Pn的下降伴随着Ci的升高,则光合作用的主要限制因素是非气孔因素。本试验结果主要是气孔限制。与前者表述基本一致。另外,嫁接在减轻N胁迫对黄瓜幼苗光合机构的损伤,增强幼苗的光合性能等方面也发挥着作用。
[1] 刘 文,尤丽群,毛建让.日光温室黄瓜嫁接技术试验报告[J].石河子农学院学报,1996,14(3):60-64
[2] 李志英,卢育华,徐立.土壤低温对嫁接黄瓜生理生化特性的影响[J].园艺学报,1998,(3):25-31
[3] 郁继华,杨秀玲,许耀照,等.NaCl胁迫对黄瓜自根苗和嫁接苗光合速率的影响[J].植物营养与肥料学报,2003,10(5):554-556
[4] 张宪法,于贤昌,张振贤.土壤水分对温室嫁接和非嫁接黄瓜生长与生理特性的影响[J].应用生态学报,2002,13(11):1399-14
[5] 孙 艳,黄 炜.两个黄瓜品种嫁接苗光合特性及养分吸收特性的研究[J].园艺学报,2002,29(2):179-180
[6] 郁继华,秦舒浩.黄瓜嫁接苗和自根苗光合特性研究[J].兰州大学学报,2001,36(6):63-67
[7] 李合生,孙群,赵世杰.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.258-260
[8] Cakmak I,Marschner H.Magnesium deficiency and high light intensity enhance activities of superoxide dismutase,ascorbate peroxidase,and glutathione reductase in bean leaves[J].Plant Physiollgy,1992,98:1222-1227
[9] 刘绍诸.不同南瓜砧木对黄瓜接穗共生亲和性及产量的影响[J].中国蔬菜,1988,(2):17-20
[10] Suzanne N R,David M P.Leaf area predication model for cucumber from linear measurents[J].Hort.Sci.,1987,22(6):1264-1266
[11] Hulsebosch R J,Hoff A J,Shuvalov V A.Influence of K F,DCMU and removal of Ca2+on the light-spin EPR signal of the cytochrome b-599 Fe(III)ligated by OH-in chloroplasts[J].Biochim Biophys Acta,1996,1277:103-10
[12] Demmig-Adams B,Adam m WW.Photoprotection and other response of plant to high light stress[J].Review of Plant Physiology and Plant Molecular Biology,1992,43,599-626
[13] Wolf DJ.Effect of NaCl salinity on flows and partitioning of C.N.and mineral ions in whole plants of white lupin,lupinus albus L[J].J Exp Bot.,1992,43(251):777-788
[14] Sibole JV,Montero E,Cabot C,et al.Role of sodium in the ABA-mediated long growth response of bean to salt stress[J].Physiol Plant,1998,104:299-305
[15] Farquhar G D,Sharkey T D.Stomatal conductance and photosynthesis[J].Annual Review of Plant Physiology,1982,33:317-345
[16] Peterson R B.Effects of O2and CO2concentrations on quantum yields of photosystems Ⅰ and Ⅱ in tobacco leaf tissues[J].Plant Physiol,1991,97:1388-1394
[17] Tiwari B S,Bose A,GhoshB.Photosynthesis in rice under a salt stress[J].Photosynthetiea,1997,34(2):303-306
