不同蛋白源日粮对断奶仔猪小肠形态的影响
2011-04-28贵州师范大学生命科学院孙云子
贵州师范大学生命科学院 孙云子
四川农业大学动物营养研究所 余 冰 陈代文*
早期断奶仔猪肠道机能发育还不完善,断奶后日粮的改变,首先使肠道受到损伤。如何通过营养缓解断奶应激对肠道造成的不利影响,成为仔猪饲养的关键。小肠的结构和功能在种属和不同生命周期的差异是由遗传因素决定的,但该遗传因素却受进化过程中日粮(营养)物理形态、日粮来源、组成以及加工方式的影响(Bikker等,2006)。
断奶后日粮特点对仔猪小肠结构和各种功能的调节起重要作用(Klurfeld,1999;Mathers,1998;Sanderson,1998)。研究表明,断奶后日粮中蛋白质种类对胰腺和十二指肠食糜中胰蛋白酶和糜蛋白酶的分泌有影响。含脱脂奶粉的日粮对断奶3 d的仔猪胰腺中的胰蛋白酶合成和分泌具有强烈的刺激作用,而大豆浓缩蛋白对断奶6 d的小肠和胰腺中的胰蛋白酶活性影响最大,在断奶10 d后,蛋白质种类对机体消化酶的影响作用消失(Makkink 等,1994a、b)。 总之各种蛋白质源的比较研究都表明,乳制品对早期断奶仔猪小肠形态结构、消化酶活性及机体机能的影响最小(张宏福,2000)。因此不同蛋白源对小肠消化生理机能和结构影响的机制还有待进一步研究。
本研究利用形态组织学技术直接观察早期断奶仔猪不同日龄小肠形态结构及肠上皮细胞超微结构的差异,以帮助了解不同蛋白源日粮对早期断奶仔猪小肠发育过程中结构和功能影响的差异。
1 材料与方法
1.1 试验动物 选24头21 d断奶仔猪,随机分成2组,处理1组饲喂乳源蛋白代替30%总蛋白日粮,处理2组饲喂全植物蛋白日粮,每个处理12头。试验期14 d。
1.2 试验日粮 各个处理基础日粮原料组成和营养水平参照NRC(1998)体重为5~10 kg猪的营养需要配制,饲粮原料组成及营养水平见表1。其中处理1组使用乳源蛋白代替30%日粮总蛋白日粮组,处理2为全植物蛋白日粮组。
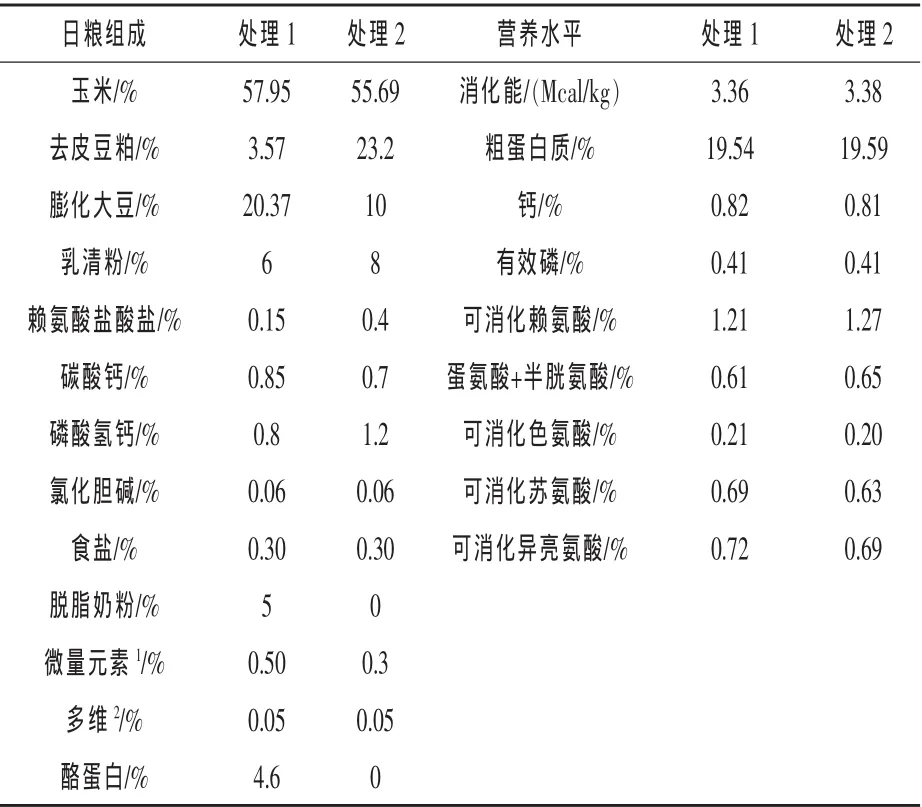
表1 试验日粮组成及营养水平
1.3 样本采集 分别在断奶0、3、7 d和14 d清晨各处理屠宰3头,其中2头公猪,1头母猪,采集肠道组织样品,用于肠道形态组织学观察。样本采集:分离部分空肠,修剪成大约1 cm长短,用4℃生理盐水冲洗干净,放入10%甲醛液固定样品中,室温保存。用于细胞超微结构观察组织样,按照电镜观察要求迅速在冰上用刀片将肠组织块修成大约1 mm×1 mm×1 mm,也可将组织修成1 mm×1 mm×2 mm大小长条形。取材具体操作方法:将取出的空肠组织放在洁净的石英板上,滴一滴预冷的固定液,用两片新的剃须刀片成“拉锯式”将组织切下并修小,然后用牙签或镊子将组织块移至盛有预冷的固定液小青瓶中。如果组织带有较多的污物,先用固定液洗几遍,然后再切成小块固定。
1.4 仔猪空肠形态组织学观察 取10%甲醛溶液固定样品,常规脱水,石蜡包埋,切片,H.E染色。采用多媒体彩色病理图像分析仪测量小肠黏膜厚度、隐窝深度和绒毛高度。双盲法读片,每张切片观察5个视野。4%生理盐水冲洗干净后放入4%多聚甲醛中固定,修整、脱水、包埋、切片和H.E染色制成切片,采用多媒体彩色病理图像分析仪测量空肠固有膜厚度、绒毛长度、绒毛宽度、隐窝深度等。双盲法读片,每张切片测量5个视野。
1.5 仔猪空肠上皮细胞超微结构观察 样品在4℃下5%戊二醛中进行24 h前固定后,4℃0.1%PBS清洗3次:1%四氧化锇固定90 min;0.1%PBS清洗3遍; 用50%、70%、80%、90%和100%的丙酮进行梯度脱水2次,每次15 min;环氧树脂∶丙酮(1∶1)于 37 ℃烘箱聚合 24 h;用包埋剂∶丙酮(3∶1)纯浸透2 h后再用包埋剂加DMP-30包埋45℃ 24 h;之后转移到60℃烘箱固化24 h;利用超薄切片机切厚度为1~10 μm的切片。将切下的片子用镊子或小毛刷转移到干净的预先滴有蒸馏水的载玻片上,加温,使切片展平,干燥后经甲苯胺蓝染色,光学显微镜观察进行半薄切片定位;再于LKB超薄切片机切500-600A超薄切片;醋酸双氧铀,柠檬酸铅双重染色,日立H-7650透射电镜观察。
1.6 数据处理 采用SPSS’S 13.0对该组数据进行方差分析,Duncan’s法进行多重比较,结果用平均数±标准误表示,以P<0.05作为差异显著性判断标准。
2 结果
2.1 不同蛋白源日粮组仔猪小肠组织结构和组织学变化 由表2可看出,与断奶时(0 d)相比,处理1日粮组在断奶后3、7 d和14 d的绒毛高度、绒毛宽度和隐窝深度均显著降低(P<0.01)。绒毛高度和断奶时0 d相比,急剧下降,只有断奶时的43%;断奶7 d时,大约恢复到断奶时的61%;断奶14 d时,达到了断奶时的88%。绒毛宽度在断奶3 d时也降低到最低,大约只有断奶时的57%,其后增加并超过断奶时的宽度。处理1日粮对隐窝深度和固有膜厚度的影响,在断奶后不同日龄变化模式基本与绒毛高度和绒毛宽度一致,均在断奶3 d时表现为最低水平。在断奶7 d时,隐窝深度已经加深,固有膜厚度增厚;在断奶14 d时,已经超过断奶时的深度和厚度,差异极显著(P < 0.01)。
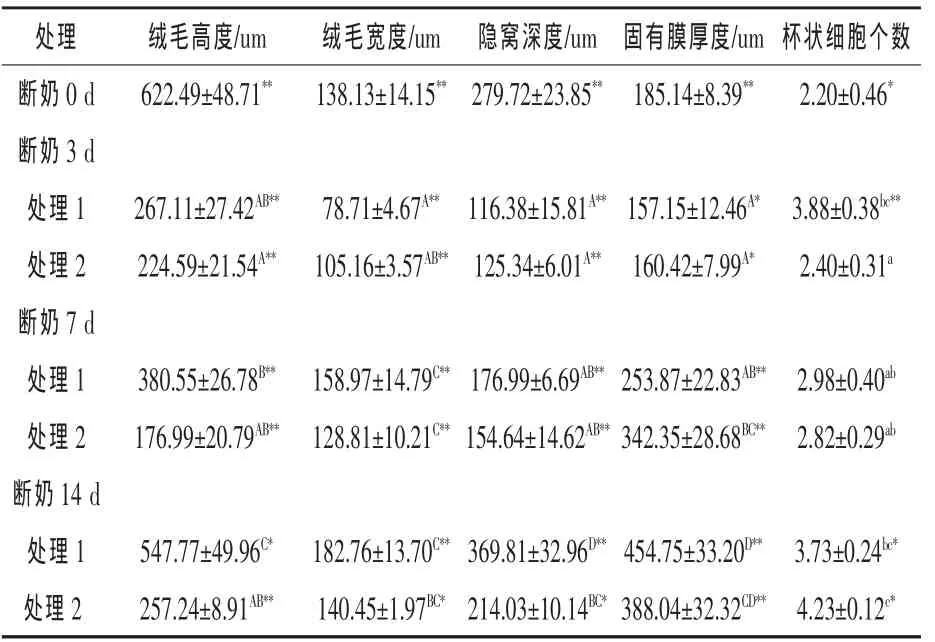
表2 不同蛋白源日粮对仔猪空肠组织结构的影响
在处理2组中,绒毛高度在从断奶到断奶7 d是持续降低的,在断奶14 d出现增高的趋式,但是还是显著低于断奶时的高度,差异达到极显著水平(P<0.01),只有断奶时的41%。绒毛宽度和隐窝深度的变化模式与绒毛高度一致,均在断奶3 d时最低,而后有所恢复,但远未达到断奶时的水平,差异极显著(P<0.01)。固有膜厚度的变化同样在断奶3 d时为最低水平,但其后能够恢复并超过断奶时厚度,差异极显著(P<0.01)。与处理1组相比,处理2组显著降低了空肠绒毛高度、隐窝深度、绒毛宽度(P<0.01)。
2.2 不同蛋白源日粮对仔猪小肠上皮细胞超微结构的影响 对仔猪空肠上皮细胞超微结构进行观察,在断奶3 d采食处理1日粮仔猪的吸收细胞微绒毛的整齐度较好,线粒体、粗面内质网和游离核糖体也很丰富,而采食处理2组日粮的结构已经开始发生比较大的变化,如吸收细胞微绒毛稀疏、变短、甚至出现脱落,而且部分微绒毛丝心小根不清晰。粗面内质网部分扩张病变,线粒体也是同样状况。断奶7 d时,处理1组的吸收细胞整体微绒毛变短,但程度不一样,且稀疏,同时可见部分粗面内质网扩张,部分发生了病变,线粒体数量减少,并可以观察到极少数溶酶体的雏形。对应的处理2组,空肠上皮吸收细胞表现微绒毛短而稀疏,并可见微绒毛融合,脱落现象。粗面内质网和核糖体数量少,且粗面内质网肿胀,并出现坏死的吸收细胞;断奶14 d时,采食处理1日粮的仔猪空肠上皮细胞超微结构明显发生好转变化,主要表现为:线粒体个数增加,粗面内质网变化不大,微绒毛密度增加,但还是可以观察到溶酶体的初级形态。处理2日粮组仔猪空肠上皮细胞超微结构未见好转,微绒毛严重脱落,粗面内质网和核糖体数量较少,并大部分发生病变。
3 讨论
3.1 不同蛋白源日粮对小肠组织结构和组织学变化的影响 断奶后日粮形态和组成变化给仔猪小肠的消化酶活性以及形态组织学带来影响(Kiarie 等,2007;Hampson 等,1986)。 一直以来,以豆粕为主的大豆蛋白是饲料中的主要蛋白质,但由于含一些抗原性物质,如大豆球蛋白、抗胰蛋白酶抑制因子等,而使仔猪小肠易产生暂时性的过敏反应,引起仔猪小肠形态组织结构发生变化,如绒毛高度降低、绒毛萎缩等现象。而动物来源的动物蛋白在动物机体经酶解可释放出许多具有重要生理功能的生物活性肽,能够刺激小肠细胞增殖、组织蛋白质合成、消化酶成熟,促进矿物质元素吸收利用,调节胃肠运动(赵念等,2008;霍永久等,2006)。
断奶后仔猪的食物由流质的母乳转变成固态饲料,这对仔猪小肠组织来说是一个强烈的刺激。许多研究表明,断奶后日粮组成的变化使小肠绒毛长度和隐窝深度都造成不同程度的影响(Kim等,2001;Van 等,1998)。 Pluske(1996a、b)等研究表明,仔猪肠壁形态结构在断奶前后完全不同,断奶前小肠黏膜上皮绒毛呈现纤长手指状,隐窝较浅,断奶后1周内绒毛变为较短的平滑舌状,隐窝加深。Hampson(1986)报道,仔猪在断奶后24 h绒毛高度缩短至断奶前的75%,并继续缩短至断奶第5天,此时绒毛高度仅为断奶前的50%。本研究中,断奶后小肠形态学结构都发生了显著变化。在处理1组中,无论是绒毛高度还是绒毛宽度都发生了显著的变化,断奶3 d时均处于最低水平,差异极显著(P<0.01),在断奶 14 d时,绒毛高度和绒毛宽度又重新恢复到断奶时水平;而隐窝深度在断奶3 d变浅后逐渐变深,在断奶14 d时达到最高水平。
在全植物日粮组中,小肠各个形态组织学指标的变化与处理1组在断奶3 d时基本一致,但是从后期的恢复状态看来,未能恢复到断奶时水平。由于植物蛋白中各种抗营养因子的存在,使得断奶后动物的小肠受到严重损伤,修复过程就很缓慢。从各项指标看,基本都在断奶3 d表现最差,之后有所回升,但很缓慢。尤其是绒毛高度在断奶14 d依然没有达到断奶时水平,差异极显著。在断奶14 d,绒毛宽度和隐窝深度有所恢复,差异不显著。
本研究结果表明,处理1组对小肠形态组织结构的影响程度不深,动物能够迅速修复而恢复并超过到断奶时的水平。而处理2组对断奶仔猪小肠的强烈刺激,造成动物自身的调控修复能力不能正常发挥,使小肠组织形态状况发生严重损伤,并难于修复。
3.2 不同蛋白源日粮对小肠上皮细胞超微结构的影响 断奶对小肠的形态组织结构不仅仅是在生长性能上具有重要的影响,对肠上皮细胞超微结构也有影响。哺乳阶段能够促进肠上皮细胞的增殖分化(Buccigrossi等,2007),而断奶应激使小肠的组织结构和功能受到一定程度的不利影响(Nabuur等,1998)。 本研究发现,仔猪断奶 3 d和断奶时相比,处理1组的肠上皮细胞的微绒毛大部分正常,但变短、变稀、整齐度较好,各种细胞器总体未出现较大变化。但断奶7 d时,部分细胞器发生了病变,如部分的线粒体和RER水肿,已经可以看到溶酶体雏形开始出现,在断奶14 d时状况发生好转,线粒体和粗面内质网数量明显增加。而处理2组的总体状况比较严重,如微绒毛变短变稀甚至脱落,线粒体出现肿胀、电子密度明显下降,甚至空泡,内嵴变短甚至消失;粗面内质网出现扩张,基质透明呈气球样等超微结构改变;伴随线粒体肿胀同时发生,还可以发生RER脱颗粒,其表面附着核糖体减少或者稀疏,从而影响细胞蛋白质合成和分泌。
4 结论
不同蛋白源日粮对肠道形态结构有影响,全植物蛋白日粮对肠道形态结构的影响较乳源蛋白替代部分总蛋白严重。
[1]霍永久,王恬,张莉莉,等.酪蛋白酶解产物对新生仔猪胃肠道生长发育的影响[J].扬州大学学报(农业与生命科学版),2006,4:47 ~50.
[2]张宏福.仔猪营养生理与饲料配制技术研究[M].北京中国农业科技出版社,2000.
[3]赵念,张莉莉,王恬,等.添加酪蛋白酶解物对宫内生长迟缓仔猪肠道生长发育的影响[J].畜牧兽医学报,2008,5:594 ~600.
[4]BikkerP,DirkzwagerA,FledderusJ,et al.The effect of dietary protein and fermentable carbohydrateslevelson growth performance and intestinal characteristics in newly weaned piglets.J Anim Sci,2006,84:3337 ~3345.
[5]Buccigrossi V,Marco G de,Bruzzese E,et al.A Guarino,Lactoferrin induces concentration-dependent functional modulation of intestinal proliferation and differentiation[J].Pediatr Res,2007,61:410 ~414.
[6]Hampson D J.Alterations in piglet small intestinal structure at weaning[J].Res Vet Sci,1986,40:32 ~40.
[7]Hampson D J.Attempts to modify changes in the piglet small intestine after weaning[J].Res Vet Sci, 1986,40:313 ~317.
[8]Kiarie E,NyachotiC M,Slominski B A,et al.Growth performance,gastrointestinal microbial activity,and nutrient digestibility in early-weaned pigs fed diets containing flaxseed and carbohydrase enzyme[J].J Anim Sci,2007,85:2982 ~2993.
[9]Kim J H,HeoK N,Odle J,et al.Liquid diets accelerate the growth of early-weaned pigs and the effects are maintained to market weight[J].J Anim Sci,2001,79:427 ~434.
[10]Klurfeld D M.Nutritional regulation of gastrointestinal growth[J].Front Bio sci,1999,4:D299 ~D302.
[11]MakkinkC A,NegulescuG P,Qin G, et al.Effect of dietary protein source on feed intake,growth,pancreaticenzyme activitiesand jejunal morphology in newly-weaned piglets.Br J Nutr,1994,72:353 ~368.
[12]Makkink C A,BerntsenP J,VerstegenM W,etal.Gastric protein breakdown and pancreatic enzyme activities in response to two different dietary protein sources in newly weaned pigs[J].J Anim Sci,1994,72:2843 ~2850.
[13]Mathers J C.Nutrient regulation of intestinal proliferation and apoptosis[J].Proc Nutr Soc,1998,57:219 ~223.
[14]Nabuur M J S.Weaning piglets as a model for studying pathophysiology of diarrhea[J].Vet Q,1998,20(Suppl 3):S42 ~S45.
[15]Pluske J R,Siba P M,Pethick D W,et al.The incidence of swine dysentery in pigs can be reduced by feeding diets that limit the amount of fermentable substrate entering the large intestine[J].J Nutr,1996,126:2920 ~2933.
[16]Pluske J R,Thompson M J,Atwood C S.Maintenance of villus height and crypt depth,and enhancement of disaccharide digestion and monosaccharide absorption,in piglets fed on cows'whole milk after weaning[J].Br J Nutr,1996,76:409 ~422.
[17]Reeds P J,BurrinD G.Glutamine and the bowel[J].J Nutr,2001,131:2505S~2508S;discussion 2523S~2504S.
[18]Sanderson I R.Dietary regulation of genes expressed in the developing intestinal epithelium[J].Am J Clin Nutr,1998,68:999 ~1005.
[19]Van Beers-Schreurs H M,Nabuurs M J,Vellenga L,et al.Weaning and the weanling diet influence the villous height and crypt depth in the small intestine of pigs and alter the conc,entrations of short-chain fatty acids in the large intestine and blood[J].J Nutr,1998,128:947 ~953.
[20]Wang J,Chen L,Li P,et al.Gene expression is altered in piglet small intestine by weaning and dietary glutamine supplementation.J Nutr,2008,138:1025 ~1032.
