菌酶协同处理豆粕制备饲用小肽的研究
2011-04-28华中农业大学生命科学与技术学院葛向阳
华中农业大学生命科学与技术学院 方 乐 葛向阳*
浙江省农业科学院植物保护与微生物研究所 汤江武 姚晓红 吴逸飞 孙 宏
传统营养理论认为,蛋白质必须被消化成游离氨基酸之后才可被消化道吸收利用,蛋白质营养即是氨基酸营养。而新的研究表明,蛋白质经消化道酶降解成游离氨基酸和各种小肽后,小肽以完整的形式和游离氨基酸同时被动物直接吸收利用(陈培赛和薛成君,2008;Backwell,1997b)。小肽是指由多个氨基酸残基组成的具有多种生物功能的肽(崔艳红,2009)。小肽在动物机体内的作用主要有传递神经息、促进胃肠道消化功能、强化养分与吸收、调控物质代谢、参与机体的免疫调节等(Boze,2000;Backwell,1997a)。豆粕是一种优质的饲用蛋白原料,具有较高的蛋白质含量,其氨基酸组成也较平衡,是一种潜在的优质小肽资源(Adetayo,2005)。传统的豆粕发酵主要是利用微生物的作用降低豆粕中的抗营养因子,或利用蛋白酶水解豆粕制备大豆肽,而采用微生物发酵和酶解协同作用处理豆粕,更有效地提高豆粕小肽化程度的报道较少(Lee,2005)。
本研究采用芽孢杆菌、酵母菌和中性蛋白酶混合处理豆粕,并优化菌酶协同处理豆粕工艺,以期获得小肽化程度更高的饲用肽,进而提高豆粕的利用率与蛋白质品质。
1 材料与方法
1.1 材料 豆粕:浙江绍兴中大生物科技有限公司提供,去皮豆粕,粗蛋白质 ≥45%。
菌种:BSW-2为枯草芽孢杆菌(Bacillus subtilis),YT为酿酒酵母菌(Saccharomyces cerevisiae),均为本实验室保藏菌株。
中性蛋白酶:购于上海楷洋生物科技有限公司,酶活 ≥ 50U/g;酶活定义:在(40±0.2)℃,pH 7.0条件下,1 min内水解酪蛋白底物,产生相当于1 μg酚类化合物(由酪氨酸等同物表示)所需的酶量,定义为1个酶活单位,以U/g表示(DB33/T 459-2003)。
1.2 培养基 PDA培养基:马铃薯(去皮)200 g、蔗糖(或葡萄糖)20 g、水 1000 mL、pH 值自然;
LB培养基:蛋白栋10 g、酵母粉5 g、氯化钠10 g、水 1000 mL、pH 7.0。
1.3 方法
1.3.1 液体种子的制备 枯草芽孢杆菌经斜面活化后刮取一环接入20 mL液体LB培养基,在30℃,160 r/min条件下摇瓶培养12 h,制成种子液;酵母菌经斜面活化后刮取一环接入20 mL液体PDA培养基,在30℃,160 r/min条件下摇瓶培养18 h,制成种子液。
1.3.2 豆粕发酵方法 豆粕基础菌酶协同处理条件为装料量100 g/瓶、中性蛋白酶添加量400 U/g、BSW-2和YT接种量各1%、料水比1∶1、发酵温度30℃、发酵时间48 h基础上,豆粕以一定比例加水,接种,加酶,混合均匀后装入罐头瓶中,用8层纱布加报纸封口,放入培养箱中,设定温度,在实验选取的时间取出,50℃烘干,粉碎,过80目筛待测。
1.3.3 豆粕菌酶混合发酵单因素试验
1.3.3.1 接种量对小肽含量的影响 在基础发酵条件上,控制其他因素不变,分别接种0.5%、1%、1.5%、2%、2.5%、3%的 BSw-2和 YT混合菌液(比例为1∶1)进行发酵,发酵结束经烘干、粉碎后测定小肽含量。
1.3.3.2 加酶量对小肽含量的影响 在基础发酵条件上,控制其他因素不变,分别添加0、100、150、200、250、300、350、400、450、500 U/g 中性 蛋白酶进行发酵,发酵结束经烘干、粉碎后测定小肽含量。
1.3.3.3 料水比对小肽含量的影响 在基础发酵条件上,控制其他因素不变,分别按料水比1∶0.6、1∶0.8、1∶1、1∶1.2、1∶1.4、1∶1.6、1∶1.8 加水进行发酵,发酵结束经烘干、粉碎后测定小肽含量。
1.3.3.4 处理温度对小肽含量的影响 在基础发酵条件上,控制其他因素不变,分别设定30、35、40、45、50℃的温度进行发酵,发酵结束经烘干、粉碎后测定小肽含量。
1.3.3.5 处理时间对小肽含量的影响 在基础发酵条件上,控制其他因素不变,分别设定0、12、24、36、48、60、72 h 的时间进行发酵,发酵结束经烘干、粉碎后测定小肽含量。
1.3.4 菌酶协同处理工艺优化 根据单因素试验结果,设计5因素4水平L16(45)的正交试验进行发酵工艺优化。发酵结束经烘干、粉碎后测定小肽、粗蛋白质含量和进行聚丙烯酰胺变性凝胶电泳(SDS-PAGE)。
1.3.5 发酵样品小肽含量的测定 将待测样品过80目筛,等体积加入10%三氯乙酸(TCA),在160 r/min摇床中30 min,然后4000 r/min离心15 min,取上清液做适当稀释后用改良Lowry法测定蛋白质总量(张康,2001;GB/T 22492-2008)。
1.3.6 发酵样品粗蛋白质含量的测定 采用凯氏定氮法,参照GB/T 14771食品中蛋白质的测定方法(GB/T 14771)。
1.3.7 发酵样品蛋白质降解度的检测 发酵样品蛋白质降解度的检测采用聚丙烯酰胺变性凝胶电泳法,(SDS-PAGE),具体方法见参考文献(高丽和张声华,2009;欧阳亮,2008)。
2 结果与分析
2.1 豆粕菌酶混合发酵工艺的研究
2.1.1 接种量对小肽含量的影响 由图1结果可知:小肽含量随着接种量的增加,说明BSW-2+YT发酵可以使小肽含量得到提高。当接种量为2.5%时,豆粕发酵后小肽含量最高,为185.16 mg/g。
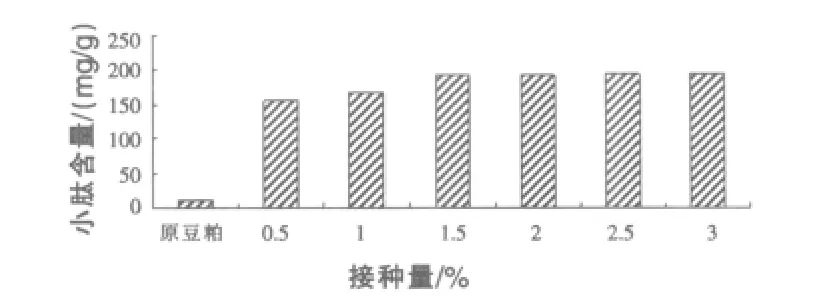
图1 不同接种量对小肽含量的影响
2.1.2 加酶量对小肽含量的影响 由图2结果可知,随着加酶量的增加,小肽含量也呈增加趋势,当加酶量为400 U/g时,小肽含量最高,为192.89 mg/g。
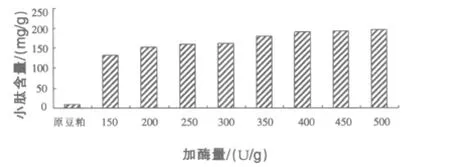
图2 不同加酶量对小肽含量的影响
2.1.3 料水比对小肽含量的影响 料水比是影响固体发酵的重要因素之一。水分含量影响发酵过程中微生物的生长,同时对酶的作用影响也比较大。由图3的结果可知,小肽的含量随着料水比的增加,呈现先增大后减小的趋势,当料水比为1∶1.2时,小肽含量最高,为194.90 mg/g。当料水比过大时,小肽含量呈现减少的趋势,可能是由于芽孢杆菌这类好氧菌在水分过多时生长受到抑制,从而影响了蛋白质降解成小肽。

图3 不同料水比对小肽含量的影响
2.1.4 发酵温度对小肽含量的影响 温度是影响酶活的重要因素,酶活的高低,直接影响到豆粕中蛋白质酶解成小肽。由图4的结果可知,小肽含量随温度的升高,先增加后减少。当发酵温度为40℃时,小肽含量最高,为192.73 mg/g。
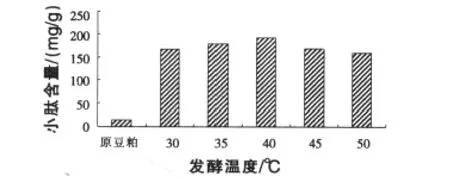
图4 不同发酵温度对小肽含量的影响
2.1.5 发酵时间对小肽含量的影响 由图5的结果可知:随着发酵时间的延长,小肽的含量先上升后略有下降。当发酵时间为48 h时,小肽含量最高为182.43 mg/g。当发酵时间长于48 h,随着酶解时间的延长,小肽被进一步酶解生成游离氨基酸,含量反而出现下降趋势,因此酶解时间不宜过长。

图5 不同发酵时间对小肽含量的影响
2.2 豆粕菌酶混合发酵工艺优化 在单因素试验的基础上,得到各因素的适宜水平后,设计5因素4水平L16(45)的正交试验进行发酵工艺优化,试验因素水平编码表、试验设计及实施方案和结果见表1、表 2。
2.2.1 正交试验结果的直观分析 从表2直观分析可以看出,极差列中接种量因素的极差值最大,所以得出结论接种量因素对小肽含量的影响最大,其次是发酵温度、料水比、发酵时间、发加酶量。
发酵最优条件为A1B3C2D4E3,即接种量1.5%,加酶量 450 U/g,料水比 1∶1.4,温度 40 ℃,时间60 h。
2.2.2 发酵方案的确定 从正交表中观察得知最优组合为A1B3C3D3E3,与理论最优条件A1B3C2D4E3对比可知发酵时间不同,结合单因素试验结果,发酵时间过长小肽含量反而有所下降,因此对这两种方案进行3次验证试验,测得小肽含量与粗蛋白质含量见表3。
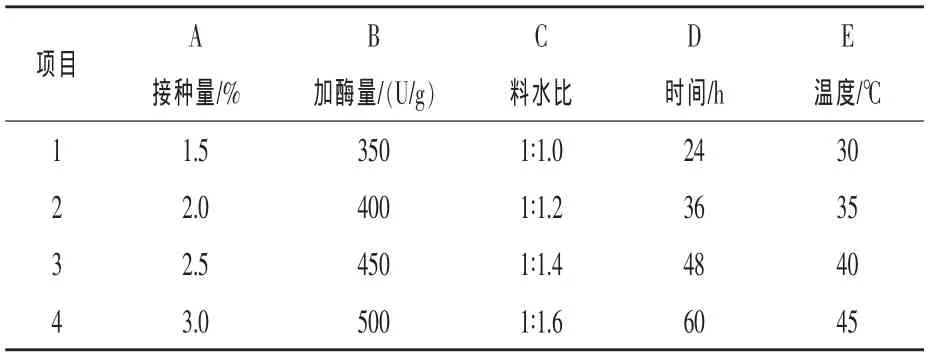
表1 试验因素编码表

表2 试验设计及实施方案和结果
由表3可知,理论最优条件没有正交表中最优组合结果好,因此最优条件为A1B3C3D3E3,即接种量 1.5%,加酶量 450 U/g,料水比 1∶1.4,温度40℃,时间48 h,发酵结束后小肽含量从11.40 mg/g提高到199.65 mg/g;粗蛋白质从47.62%提高到56.72%。

表3 正交试验验正试验结果
2.3 SDS-PAGE电泳检测蛋白降解程度 将最终确定的发酵工艺的发酵产品进行SDS-PAGE检测,以原料豆粕做对照,结果见图6。
图6结果显示,与原豆粕相比,发酵产品中的大分子蛋白得到有效降解,生成小分子的多肽、小肽和氨基酸,其蛋白质的分子质量在45 kDa以下,小于14.4 kDa的占很大一部份,由此可见,发酵后豆粕的品质得到了有效提升。

图6 发酵豆粕SDS-PAGE图
3 讨论
小肽的制备主要采用微生物发酵法和酶解法。从本质上讲,微生物发酵法和酶解法都是利用蛋白酶的酶解作用(Jung,2006;李书国,2000)。微生物发酵法生产小肽的工艺主要有固体发酵和液体发酵。微生物固体发酵的优点是能较好地去除豆粕中的抗营养因子,发酵过程中加入的微生物如乳酸菌、酵母菌、芽孢杆菌等,其本身就是益生菌,有利于改善动物胃肠道的微生态环境,减少抗生素的应用和疾病的发生(吴胜华和李吕木,2008;周伏忠,2007)。本研究采用的是芽孢杆菌和酵母菌混合发酵豆粕,芽孢杆菌相对于霉菌来讲,生长速度较快,发酵周期较短,降低了生产成本。并且在发酵过程中分泌蛋白酶,利用蛋白酶的内切作用将蛋白质降解成低分子质量的肽,因此对豆粕蛋白有较好的降解作用;酵母菌在发酵过程中产生酒香味,使发酵产品的风味有所提升,同时酵母本身也是很好的菌体蛋白,使豆粕发酵后的粗蛋白质提高。
目前酶解法制备小肽,主要采用中性蛋白酶、碱性蛋白酶和酸性蛋白酶(刘通讯,2002)。万琦(2003),刘大川和钟方旭(1996)研究了 5 种蛋白酶:中性蛋白酶、碱性蛋白酶、木瓜蛋白酶、胃蛋白酶、胰蛋白酶的特性,筛选出碱性蛋白酶水解大豆蛋白制大豆肽,水解效果虽然较好,但是产物带有强烈的苦味,需要采取一定的脱苦工艺后方可使用。王之盛和况应谷(2004)的研究结果表明,在碱性条件下有利于豆粕抗原蛋白的降解,中碱性条件有利于7S和2S小分子质量抗原蛋白的进一步降解。本研究采用中性蛋白酶酶解豆粕,相对于碱性蛋白酶和酸性蛋白酶,避免固体发酵pH调节困难的问题,使发酵方式更为简单有效。
菌酶混合协同处理法生产小肽,充分利用微生物发酵与酶解各自的优势,发挥微生物与蛋白酶的协同作用使豆粕蛋白降解更充分,小肽化程度更高,同时避免了酶解产品的苦味,提高产品风味及适口性,进一步改善了豆粕饲用肽产品品质和营养价值,这对实现饲用肽的工业化生产具有重要的参考价值。
4 结论
以豆粕为原料,利用芽孢杆菌、酵母菌、中性蛋白酶混合发酵豆粕生产小肽饲料,在接种量1.5%、加酶量 450 U/g、料水比 1∶1.4、发酵温度40℃、发酵时间48 h条件下,豆粕发酵后,小肽含量和粗蛋白含质量都有显著提高,小肽含量从11.40 mg/g提高到 199.65 mg/g;粗蛋白质从47.62提高到56.72%。
[1]陈培赛,薛成俊.小肽的动物营养研究进展[J].养殖与饲料,2008,4:95~97.
[2]崔艳红,韩庆功等.小肽营养的研究及应用 [J].兽药与饲料添加剂,2009,2:20 ~22.
[3]高丽,张声华.大豆蛋白凝胶前后SDS-PAGE图谱比较分析[J].粮油食品科技,2009,17(3):25 ~27.
[4]李书国,陈辉,杜进民.大豆多肽的功能特性及加工工艺[J].粮油食品科技,2000,27(19):4 ~5.
[5] 刘大川,钟方旭.酶水解法制备大豆肽的研究[J].中国油脂,1997,22(3):14~16.
[6]刘通讯,朱小乔,杨晓泉.多酶协同作用生产大豆多肽的研究[J].食品科学,2002,23(11):29 ~32.
[7]欧阳亮,李亮,蔡源锋.垂直型SDS-PAGE分析发酵豆粕中蛋白类抗营养因子的研究[J].饲料工业,2008,29:43 ~45.
[8]万琦,陆兆新,高宏.脱苦大豆多肽产生菌的筛选及其水解条件的优化[J].食品科学,2003,24(2):29 ~32.
[9]吴胜华,李吕木.多菌种固态发酵豆粕生产小肽饲料[J].食品与发酵工业,2008,34(10):113 ~115.
[10]张康.生物制品蛋白质含量Lowry测定法应注意的几个问题[J].海峡药学,2001,4:26.
[11]浙江省质量技术监督局.DB33T 459-2003[S].饲料添加剂:饲料用复合酶制剂.2003.
[12]中华人民工和国国家质量监督检验检疫总.GB/T 14771[S].食品中蛋白质的测定方法:2008.
[13]中华人民工和国国家质量监督检验检疫总局.GB/T 22492-2008[S].大豆肽粉:2008.
[14]周伏忠,贾蕴丽,陈国参.豆粕发酵适宜菌株筛选及其发酵技术研究[J].河南科学,2007,25(3):409 ~412.
[15]王之盛,况应谷.酶解去除大豆产品抗原蛋白的效果研究[J].饲料博览,2004,11:1 ~4.
[15]Adetayo O,Omoni.Soybean Foods and Their Benefits:Potential Mechanisms of Action[J].Nutrition Reviews,2005,63:272 ~283.
[16]Backwell F R C.Peptide utilization by tissues∶current status and applications of stable isotope procedures[J].Proc Nutr Soc,1997a,53(3):457 ~464.
[17]Backwell F R C.Quantification of cireulating peptides assessment of peptide uptake across the gastrointestinal tract of sheep[J].Anim Sci,1997,79(3):315~322.
[18]Boze J J.Portein hydrolysate vs free amino acid based on the nutritional recovery of the starved rat[J].European Journal of Nutrition,2000,39(6):237~243.
[19]Jung S.Functionality of soy protein produced by enzyme assisted extraction[J].JAOCS,2006,83(1):71 ~78.
[20]Lee K A.New peptides isolated from a soy protein hydrolysate that inhibit platelet aggregation[J].Food Chemistry,2005,90:389 ~393.
