罗布麻种子老化过程中的生理生化特性
2011-04-25张永娟冯子蓉戎郁萍
张永娟,韩 蕊,原 烨,梁 虹,冯子蓉,戎郁萍
(中国农业大学动物科技学院草业科学系,北京 100193)
罗布麻(Apocynumvenetum)是夹竹桃科罗布麻属中具有重要生态价值和经济价值的多年生草本植物[1],耐旱、耐寒、耐盐碱、耐风沙,生长在山沟、岸边、干旱沙漠或内陆盆地、海滨盐碱低湿地[2]。罗布麻可在极端恶劣的环境下生存,在最低温度-47 ℃的新疆北部阿勒泰地区能够安全越冬;在我国最热地区吐鲁番盆地夏天温度达47 ℃时依旧生长良好[3]。近年来,关于罗布麻的研究大多集中在抗盐、医药应用、纤维纺织利用等领域[4-5],关于罗布麻种子的适应性及劣变规律的研究较少。
种子是蕴藏着生命力的植物器官,它和一切活的有机体一样,同外界环境构成不可分割的统一整体[6]。种子活力水平主要受遗传因子和外界因素的制约[7]。环境对种子劣变影响很大。在自然老化条件下,种子内部发生一系列的生理生化变化,生理变化表现为种子萌发缓慢,萌芽力下降,耐逆境能力减弱;生化方面表现为超氧化物歧化酶(SOD)和过氧化物酶(POD)活性、贮藏性物质、合成能力、呼吸作用、有毒物质含量和遗传物质变异等多方面的变化[6]。种子在普通贮藏条件下老化非常缓慢,很难在较短的时间内测定种子活力。加速老化能够克服这个缺点,使种子活力差别在较短时间内表现出来[8]。在人为控制条件下,将种子短期内放在高温和高湿环境中,从潮湿的环境中吸水,可提高种子含水量,伴随高温导致种子迅速老化[9]。老化不仅影响种子萌发及幼苗生长,也影响后期植株的品质和产量[10]。目前,国内外关于种子老化及劣变机理的报道很多。老化在茄子(Capsicoidesallioni)、黄瓜(Cucumissativus)、辣椒(Capsicumannuum)等蔬菜种子中研究已较普遍[11-13]。粮食作物方面,覃鹏等[14]、刘明久等[15]分别研究了人工老化对小麦(Triticumaestivum)、玉米(Zeamays)生理生化特性的影响。在牧草种子研究中也已开展了相关研究[16-18]。但不同植物种子对老化要求的条件不同,生理生化特性的表现也不尽相同,因此需要进一步研究不同植物在老化条件下的生理生化特性的变化规律。
本研究以罗布麻种子为试验材料,采用人工加速老化法,对其老化过程中的生理生化特性变化规律进行初步研究,探讨老化条件下种子活力的劣变规律,分析其在自然生态环境中活力丧失的机制,对合理贮藏种子,以保持或提高种子活力提供理论依据,也对罗布麻资源的开发利用具有积极意义。
1 材料与方法
1.1试验材料 2009年采集于新疆巴州地区尉犁县的罗布红麻种子。
1.2试验方法
1.2.1人工加速老化处理 老化方法参照王玉红等[19]的方法加以调整。选取洁净种子铺于装有蒸馏水的老化盒内干燥筛网上,水面距种子约1 cm。放入设定温度的老化箱内。老化箱上放置一水源,确保老化期间湿度为100%。老化温度设定为35、50 ℃,分别进行12、24、36、60和84 h的人工老化处理,以未经加速老化处理的种子为对照,分期取出老化种子,摊晾使其恢复至原质量后进行生理生化指标的测定。
1.2.2电导率测定 参照徐本美和韩建国[20]方法,称取处理后种子0.1 g,重复4次,先用清水冲洗3次,再用去离子水冲洗2次,将种子表面的浮水用滤纸擦干,放入100 mL三角瓶中,同时设一对照,加入30 mL去离子水,用锡箔纸封口后在20 ℃恒温培养箱中放置24 h,用DDS-Ⅱ型电导仪测定浸出液的电导率。
1.2.3脱氢酶活性测定 参考陶梅和辛萍萍[21]的方法,称取各处理种子0.1 g,4次重复,浸泡于蒸馏水中在20 ℃条件下放置24 h,用滤纸吸干浮水,小心剥除种皮,用0.1%TTC在38 ℃恒温条件下黑暗染色3 h,达到反应时间后倒出TTC溶液,用蒸馏水将种子洗净,用滤纸吸干表面浮水,将染色的胚放入具塞试管内,加入95%酒精10 mL,然后在35 ℃恒温箱中提取24 h,达规定时间后提取液于490 nm处以95%酒精做空白测吸光度值,以光密度OD值的大小表示脱氢酶活性的高低。
1.2.4POD活性测定 参照李玲[22]方法。酶粗提液提取:称取种子0.2 g,3次重复,加入6 mL 50 mmol/L的pH值7.8的磷酸缓冲液,于研钵中研磨成匀浆,4 000 r/min离心15 min,收集上清液低温保存。
活性测定:比色杯中加入3 mL反应液和1 mL磷酸缓冲液作为对照,间隔2 min读值。POD活性[U/(g·min)]=(ΔA470·VT)/(W·VS·0.01×t)。ΔA470为反应时间内吸光值变化;W为种子质量(g);t为反应时间(min);VT为提取酶液总体积(mL);VS为测定时取用的酶液体积(mL)。
1.2.5浸出液可溶性糖含量测定 参照黄学林和陈润政[23]的方法,称取0.1 g处理种子,3次重复,将种子放在20 ℃条件下用100 mL蒸馏水浸泡24 h,然后吸取浸提液1 mL,放入干净的试管中,各加入5 mL蒽酮试剂,小心振荡使其混合均匀。在沸水浴中保温10 min冷却,以对照调零在620 nm波长测定光密度,然后根据标准曲线求可溶性糖的含量。
标准曲线的制作:准确称取0.1 g无水葡萄糖溶先用蒸馏水定容至1 000 mL,此为葡萄糖标准母液。由母液配制成的每毫升含葡萄糖0、20、40、60、80、100 μg的标准溶液各1 mL,再加入5 mL蒽酮试剂(0.2 g蒽酮溶于100 mL 76%稀硫酸中)充分混合均匀,放入100 ℃水浴锅中加热10 min,自然冷却后,以空白为对照,在620 nm处测定吸光值,根据吸光值绘制标准曲线。
1.3数据处理 试验数据采用SPSS 13.0软件进行单因素方差分析,用新复极差法进行多重比较。
2 结果与分析
2.1老化处理对罗布麻种子浸出液电导率的影响 随着老化温度的提高和老化时间的延长,罗布麻种子的电导率在初期平缓下降后逐渐上升,并在老化后84 h达到最高值。在相同老化温度下,随着老化时间的延长,电导率急剧上升(图1)。
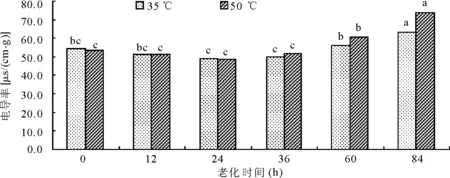
图1 人工加速老化处理对种子电导率的影响
在老化初期12和24 h罗布麻种子的电导率与对照相比均出现下降趋势(图1),且35 ℃与50 ℃老化处理电导率基本持平,都与对照之间差异不显著(P>0.05)。尽管36 h老化处理后种子电导率增加,但与对照相比差异不显著。从老化处理60 h后,种子电导率比对照显著提高(P<0.05)。50 ℃老化条件下的电导率增幅高于35 ℃,50 ℃老化处理60、84 h的电导率比35 ℃老化处理的电导率分别高7.64%和16.09%。说明随着种子老化程度的加剧,膜系统受到破坏,且温度越高破坏性越大,细胞内的矿物质和无机物质外渗,导致电导率升高。
2.2老化处理对罗布麻种子脱氢酶活性的影响 随着老化时间的延长,脱氢酶活性均呈下降趋势(图2)。35 ℃老化条件下下降趋势较为平缓,50 ℃在老化初期就急剧下降。在各处理时期35 ℃老化条件下脱氢酶活性远远高于50 ℃,50 ℃老化条件下在处理36 h以后脱氢酶活性变为0。各处理与对照相比均差异显著(P<0.05)。脱氢酶在种子萌发过程中起非常重要的作用,其活性的下降反映了种子萌发能力的下降[24]。说明,脱氢酶活性对老化处理反应比较敏感,温度越高对脱氢酶活性影响越大,在高温老化条件下短期内即可失活。
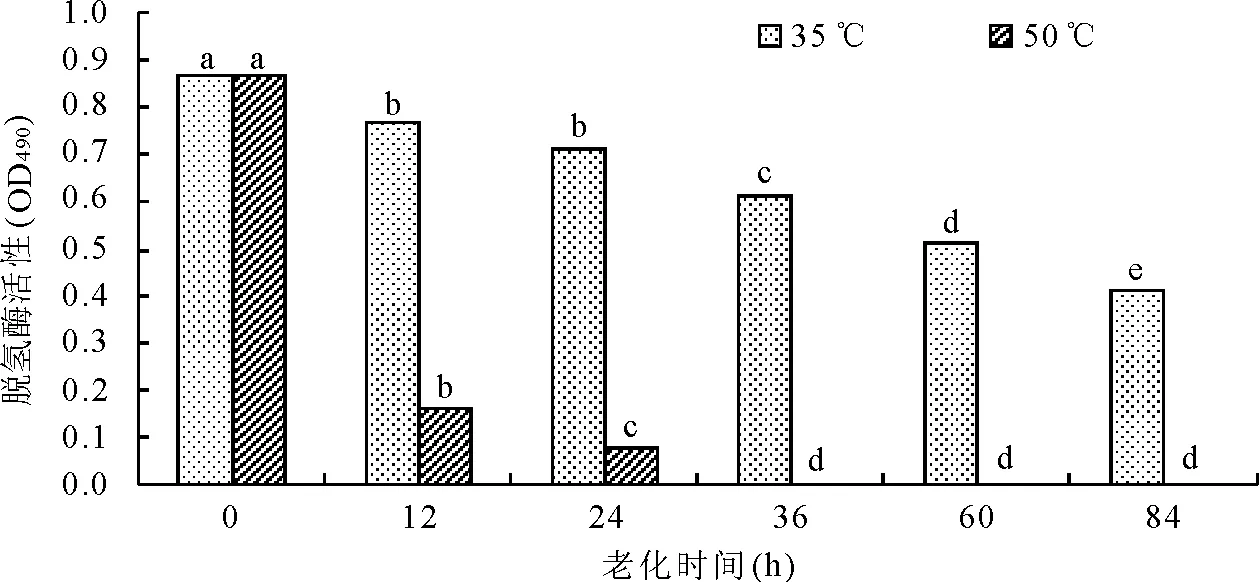
图2 人工加速老化处理对种子脱氢酶活性的影响
2.3老化处理对罗布麻种子过氧化物酶活性的影响 POD活性均随着老化时间的延长而逐渐下降(图3),老化初期(0~12 h),POD活性迅速降低,老化后期下降速度趋于平缓。不同处理之间POD活性下降趋势有所不同,在整个处理期间POD活性50 ℃明显高于35 ℃。其中,在50 ℃老化条件下,处理12 h后随处理时间延长呈微升趋势,但是各处理(12、24、36、60、80 h)之间差异不显著(P>0.05),但均显著低于对照(P<0.05)。35 ℃老化条件下,各处理均显著低于对照,处理12 h显著高于其他处理,24、36、60、80 h处理之间差异不显著。结果表明,罗布麻种子POD活性在老化初期都会有不同程度地下降,随后变化趋势趋于平稳。POD是清除活性氧的抗氧化酶之一,POD 活性的下降使种子中超氧化物阴离子自由基的含量积累增加,加大了对种子的毒害作用。
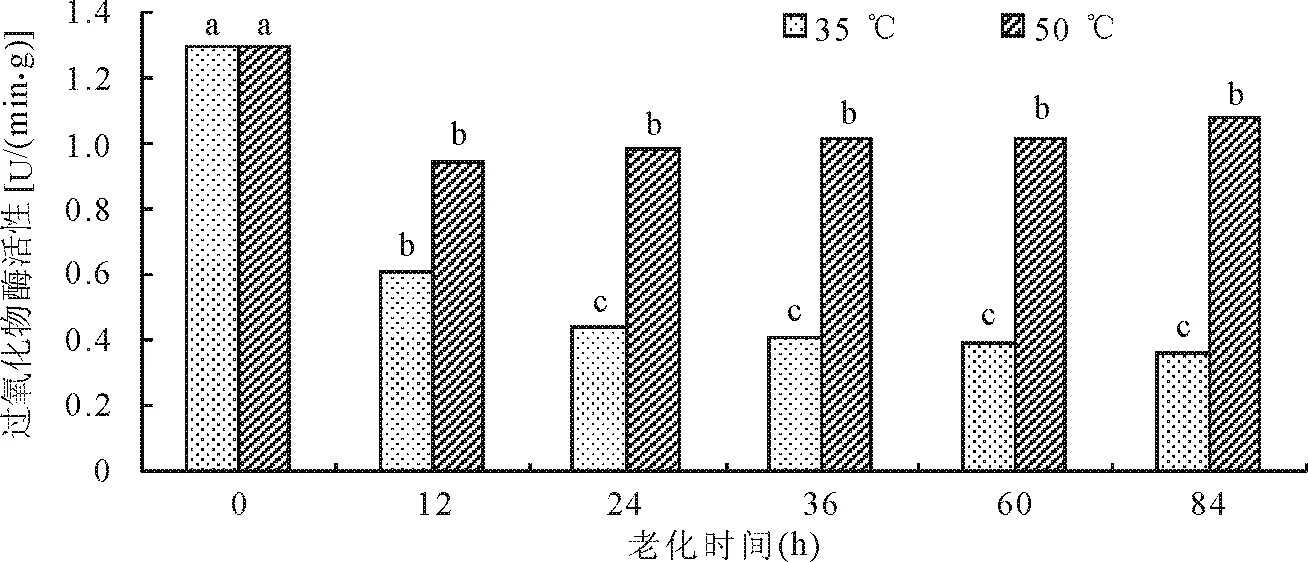
图3 人工加速老化处理对种子过氧化物酶活性的影响
2.4老化处理对罗布麻种子浸出液可溶性糖含量的影响 在高温高湿老化过程中,相同温度下罗布麻种子浸出液中可溶性糖含量随着老化时间的延长逐渐增加;相同老化时间下,温度越高,浸出液可溶性糖含量上升趋势越大(图4)。在整个处理过程中50 ℃处理种子可溶性糖含量一直高于35 ℃处理种子,84 h时都达到最大值,分别为82.97和65.63 μg/mL。
老化初期(0~24 h)可溶性糖含量上升比较缓慢。随着老化的进行,在35 ℃条件下,24~36 h阶段可溶性糖含量增速明显加快;在50 ℃条件下,24~36和60~84 h阶段可溶性糖增速明显加快(图4)。除12 h处理与对照相比差异不显著外,其他各处理与对照相比差异均显著(P<0.05)。说明,种子可溶性糖含量均在老化24 h后显著增加,与电导率变化有相似特征,可能是由于在老化初期种子经过短暂自我修复,膜的伤害程度相对较小,可溶性糖作为电导率浸出液的成分之一,影响较小。在处理后期,质膜的透性增大,种子受伤害的程度增加,可溶性糖量损失增加。

图4 老化处理对种子可溶性糖含量的影响
3 讨论
植物细胞膜对物质具有选择通透性。质膜是植物在逆境胁迫中首先受到伤害的原初位点[25]。植物组织受到伤害,膜的结构受损,膜透性增大,细胞内各种水溶性物质将外渗,此时将植物组织浸入去离子水中,水的电导率将因电解质的外渗而加大。伤害愈重,外渗愈多,电导率的增加也愈大,故可通过测定外液电导率增加值得知膜伤害程度[26]。近年来关于质膜受损这一植物生理指标在种子老化裂变期间的研究越来越多[27-28]。40 ℃加速老化处理下,2种小麦种子的电导率随着老化处理时间的延长先降后升,因此,在轻度老化条件下植物抗逆性增加,减小了细胞膜的受损程度[26]。穆瑞霞[29]在人工老化与引发对大葱(Alliumfistulosum)种子活力及幼苗生理生化变化的影响中发现,种子浸出液的电导率在出现短暂下降后升高,认为随着老化的进行膜系统经过短暂的自我修复,电导率下降,之后由于高温高湿老化程度的加重,膜系统受损严重电导率升高。然而在老化过程中,不同材料的电导率并不都是先降低后升高的。李玉荣等[17]在人工加速老化蓝茎冰草(Agropyronsmithii)种子中发现,电导率随老化时间的延长逐渐降低,这可能是由种子组成导致的。在牧草种子中,羊草(Leymuschinensis)、新麦草(Psathyrostachysjuncea)、高羊茅(Festucaelata)、紫花苜蓿(Medicagosativa)老化研究中种子电导率则随老化的进行一直上升[30-33]。本研究得出电导率随着老化时间的延长在老化初期下降缓慢,这可能是由于罗布麻种子本身耐热性较强在初期高温环境中抗逆机制导致电导率降低;而后逐渐增大,且老化条件越高对种子伤害程度越大,膜的透性增大造成与代谢有关的各种物质外渗,电导率可以反映种子劣变情况,可以作为测定罗布麻种子老化生理指标之一。
脱氢酶是测定种子生活力的重要指标之一,在呼吸过程中起重要作用,其可以快速地体现种子胚的还原能力。在本研究中,50 ℃老化处理比在35 ℃老化处理下脱氢酶活性丧失速度快且在36 h以后活力就消失,而35 ℃脱氢酶活性下降比较缓慢,表明在高温老化进程中罗布麻种子脱氢酶活性下降速率明显大于低温老化的种子。50 ℃老化条件对罗布麻种子活性影响较大。
植物遭受渗透胁迫时,细胞中生物活性氧的积累是造成细胞伤害乃至死亡的主要原因,而细胞中清除活性氧的保护酶系统的存在和活性增强,是细胞免于伤害或抗性增强的主要原因之一[34]。过氧化物酶是细胞内活性氧清除剂之一,和超氧化物歧化酶、过氧化氢酶统称为细胞保护酶。一般认为人工老化会影响细胞酶活性的变化,进而影响种子内部的代谢过程,酶活性降低,清除过氧化物和自由基的能力逐渐降低,细胞损害加大[35]。通常情况下过氧化物酶活性会随着老化的进行逐渐减低,对酶分子结构的破坏随老化时间的延长逐渐加剧。在本研究中种子过氧化物酶在不同的老化温度下初期都有下降趋势,这对于有毒物质活性氧、自由基等的清除非常不利。本研究结果显示在高温高湿下过氧化物酶活性远远大于低温高湿老化环境下的活性,且在高温(50 ℃)老化处理12 h后有微升趋势。这可能是种子长时间处于高温环境中为抵御50 ℃高温的伤害,通过提高自身过氧化物酶的活性来降低伤害,这是对高温老化作出主动适应。说明罗布麻种子耐热较强,能够对高温环境作出抗逆反应,罗布麻抵抗高温及老化的能力强。
糖是植物组织含量最多的有机化合物,是生命活动的主要能量来源和细胞的重要物质,可溶性糖是种子萌发至开始进行光合作用前的呼吸底物。细胞内糖分的损失会对细胞正常的生理生化活动造成影响[30]。Kalpana和Madhava[36]在木豆(Cajanuscajan)栽培品种种子加速老化过程中脂类的变化中发现,随种子劣变的发生,引起膜结构损伤,造成渗出液的可溶性糖含量增加。朱世东和黎世昌[37]指出,老化洋葱(A.cepa)种子浸出液电导率增加的同时,浸出液可溶性糖也有所增加。本研究结果表明,随着老化的进行可溶性糖含量逐渐增大,在老化初期与正常种子相比变化不大,认为可能是由于在老化初期种子经过短暂自我修复,膜的伤害程度相对较小,可溶性糖作为电导率浸出液的成分之一,影响较小。在处理后起,质膜的透性增大,种子受伤害的程度增加,可溶性糖量损失增加。本研究中证实电导率的变化受浸出液可溶性糖含量变化的影响。
4 结论
种子浸出液随着老化程度的加大逐渐升高,且温度越高增加越快,对膜的损伤程度越大,老化影响了罗布麻种子的膜系统,增加了细胞膜的渗透性,造成可溶性糖的渗漏。电导率的变化和浸出液糖含量有着直接的关系,电导率和可溶性含糖量的大小能反映出罗布麻细胞膜系统的完整性程度,可以作为快速测定罗布麻种子老化生理指标。
人工老化过程中脱氢酶活性降低,脱氢酶不耐高温在50 ℃条件下短时间内活性完全丧失,对老化反应比较敏感,温度越高对脱氢酶活性影响越大。POD活性在50 ℃老化条件下大于35 ℃,说明罗布麻种子能够对高温老化环境作出抗逆反应,种子抗热性较强。
[1]周平.积极发展罗布麻的人工栽培[J].新疆农业科学,1988(1):46-47.
[2]张磊,李惠琪,祁和英.阿克苏地区罗布麻资源的分布及利用[J].新疆农业科学,2003,40(3):172-174.
[3]刘萍,李春颖.罗布麻的研究现状及展望[J].吉林农业科技学院学报,2009,18(3):19-21.
[4]张秀玲,李瑞利,石福臣.盐胁迫对罗布麻种子萌发的影响[J].南开大学学报,2007,40(4):13-18.
[5]张志斌,白树敏.罗布麻研究现状及发展[J].邢台职业技术学院学报,2007,24(1):42-43.
[6]那潼.两种锦鸡儿种子人工老化中生理生化变化及基因组DNA损伤的ISSR研究[D].扬州:扬州大学,2007.
[7]王自霞.玉米种子人工老化及其修复的研究[D].太原:山西大学,2008.
[8]张兆英,秦淑英,王文全,等.人工老化过程中黄芩种子发芽率、酶活性等变化规律的研究[J].河北林果研究,2003(2):120-123.
[9]毛培胜,李寅菲.紫花苜蓿种子人工加速老化方法研究[J].种子,2010,29(10):10-14.
[10]李景秀,管开云,扬鸿森.云南紫金牛属植物资源调查研究[J].广西植物,2009,29(2):236-241
[11]Demir I,Ozden Y S,Yilmaz K.Accelerated ageing test of aubergine,cucumber and melon seeds in relation to time and temperature variables [J].Seed Science and Technology,2004,32:851-855.
[12]崔鸿文,王飞.黄瓜种子人工老化过程中某些生理生化规律研究[J].西北农业大学学报,1992(1):51-54.
[13]刘月辉,王登花.辣椒种子老化过程中的生理生化分析[J].种子,2003(2):51-52.
[14]覃鹏,孔治有,刘叶菊.人工加速老化处理对小麦种子生理生化特性的影响[J].麦类作物学报,2010,30(4):656-659.
[15]刘明久,王铁固,陈士林,等.玉米种子人工老化过程中生理特性与种子活力的变化[J].核农学报,2008,22(4):510-513.
[16]王小丽,李鸿雁,李志勇,等.人工老化对扁蓿豆种子活力与生理特性的影响[J].安徽农业科学,2010,38(1):515-517,535.
[17]李玉荣,韩建国,孙彦,等.蓝茎冰草种子劣变过程中生理生化变化[J].种子,2007,26(2):10-13.
[18]刘贺,毛培胜,孔令琪,等.马棘种子发芽及人工加速老化测定标准化研究[J].草业科学,2010,27(2):144-149.
[19]王玉红,王新国,廉佳杰,等.草地早熟禾种子加速老化方法研究[J].草地学报,2008,16(6):600-604.
[20]徐本美,韩建国.ISTA种苗评定与种子活力测定方法手册[M].北京:北京农业大学出版社,1993.
[21]陶梅,辛萍萍.用种胚浸提法测定种子脱氢酶活性的探讨[J].种子科技,1993(5):28.
[22]李玲.植物生理学模块试验指导[M].北京:科学出版社,2009:97-98.
[23]黄学林,陈润政.种子生理试验手册[M].北京:农业出版社,1990.
[24]李颜,王倩.大葱种子人工老化与膜脂过氧化的研究[J].种子,2007(3):27-30.
[25]时丽冉,牛玉璐,李明哲.苣荬菜对盐胁迫的生理响应[J].草业学报,2010,19(6):272-275.
[26]孔治有,刘叶菊,覃鹏.40℃加速老化处理对小麦种子生理生化特性的影响[J].安徽农业科学,2010,38(12):6155-6157.
[27]Basavarajappa B S,Shetty H S,Prakash H S.Membrane deterioration and other biochemical changes,associated with accelerated ageing of maize seeds[J].Seed Science and Technology,1991,19:279-286.
[28]Kalpana R,Madhava Rao K V.On the ageing mechanism in pigeonpea(Cajanuscajan(L.)Millsp.)seeds[J].Seed Science and Technology,1995,23:1-9.
[29]穆瑞霞.人工老化与引发对大葱种子活力及幼苗生理生化变化的影响[D].郑州:河南农业大学,2008.
[30]毛培胜,常淑娟,王玉红,等.人工老化处理对羊草种子膜透性的影响[J].草业学报,2008,17(6):66-70.
[31]云锦凤,于卓,郝新民,等.不同贮藏年限新麦草种子活力研究初报[J].内蒙古畜牧科学,1998(2):22-24.
[32]浦心春,韩建国,毛培胜,等.加速老化对高羊茅种子生理生化特性的影响[J].草地学报,1998,6(3):191-196.
[33]孙建华,陈江辉.紫花苜蓿种子活力的不同方法测定[J].草业科学,1990,7(4):53-57.
[34]万里强,李向林,石永红,等.PEG胁迫下4个黑麦草品种生理生化指标响应与比较研究[J].草业学报,2010,19(1):83-88.
[35]唐祖君,宋明.大白菜种子人工老化及劣变的生理生化分析[J].园艺学报,1999,26(5):319-322.
[36]Kalpana R,Madhava Rao K V.Lipid changes during accelerated aging of seeds of pigeonpea cultivars[J].Seed Science and Technology,1996,24:475-485.
[37]朱世东,黎世昌.洋葱种子老化过程中的生理变化[J].植物生理学通讯,1990(5):29-31.
