盐胁迫对虉草种子萌发与幼苗生理生化的影响
2011-04-25丛丽丽张蕴薇李永祥张新全
丛丽丽,张蕴薇,陈 新,李永祥,张新全
(1.四川农业大学草业科学系,四川 雅安 625014;2.中国农业大学动物科技学院草业科学系,北京 100193;3.新疆维吾尔族自治州草原总站,新疆 乌鲁木齐 830049)
虉草(Phalarisarundinacea),别名草芦、园草芦,为禾本科虉草属(Phalaris)植物[1]。因其具有较强的抗逆性和较高的产量及营养价值而被广泛用于饲草、人工湿地植物、造纸原料和生物质能源等[2-3]。
虉草是禾本科多年生大型直立C3植物,根系强大具根状茎,根系深度超过3 m[4]。生长季株高为1.5~3.0 m[5-8]。虉草抗逆性强,耐湿、耐水淹性高于其他冷季型禾草,同时又很耐旱和耐寒。对土壤要求不严,在土壤pH值4.9~8.4内都能良好地生长。与其他禾本科牧草比较,虉草具有生物产量高、维护成本低、抗逆性强、木质纤维含量高、易于管理和收获等特点,是可再生的能源,在北方气候条件下可以栽培后连续收割10~12年[9],具有开发成生物质能源的潜力。现在,芬兰和瑞典大规模种植虉草用于转化生物质能源[10-12]。在芬兰,约1%的农作物区种植虉草[13]。甚至,芬兰的农业部和林业部官方制订到2015年虉草栽培面积是目前5倍的目标[14],超过了目前油菜(Brassicacampestris)、马铃薯(Solanumtuberosum)、甜菜(Betavulgaris)、白菜型油菜的总面积。根据Lewandowski等[6]的研究,在瑞典Bjurholm自治区,将220 hm2废弃农田用于种植虉草,其生产的生物质燃料可占该地区家庭耗能的25%。
边际土地发展能源草是我国生物质能源草发展的方向之一,我国盐碱滩涂面积较大,具有发展能源草栽培种植的潜力。目前,对虉草的研究主要倾向于营养成分[15-16]、栽培[17]、刈割[18]及分子领域等方面[19],对虉草种子萌发期及幼苗的耐盐性研究报道很少,同时我国虉草品种较少,只有“通选7号”草芦、“川草3号”虉草和威宁草芦3个审定品种。因此,本研究在搜集虉草种质的基础上,通过不同NaCl浓度下虉草种子发芽、幼苗生理生化指标的测定,评价其耐盐性,以期为筛选耐盐性更强的种质和培育品种提供理论依据。
1 材料与方法
1.1试验材料 本试验选择6份国外虉草材料,来自国家草种质资源中期库(北京),材料信息详见表1。
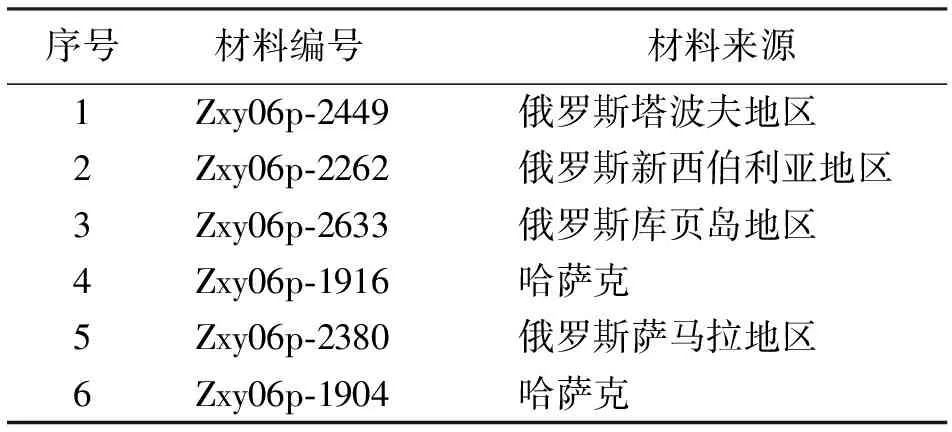
表1 供试虉草材料名称及来源
1.2试验方法
1.2.1NaCl胁迫下虉草种子萌发试验 根据预试验,本试验设定0(CK)、50、100、150、200和250 mmol/L 6个浓度梯度的NaCl溶液对虉草种子进行处理。发芽床采用3层滤纸法,每处理3次重复,每重复100 粒种子,于30 ℃/20 ℃,8 h/16 h的变温光照培养箱中发芽,每天更换滤纸和NaCl溶液,以保持一定的NaCl浓度及湿度。发芽第3天开始每天观察、记录发芽数,即正常苗数(以胚根和胚芽均长到种子一半为发芽标准)。发芽21 d[20]结束后,每重复随机选择10株正常苗测定苗高(不包括根)、鲜质量和根长,小于10株的不作统计,计算21 d时的种子发芽率。
1.2.2NaCl胁迫下虉草幼苗生理生化测试 挑选籽粒饱满的种子,用3%的H2O2消毒10 min后再用蒸馏水冲洗干净,播于盛有1/4浓度Hoagland营养液的塑料育苗钵的纱布上,放入智能温室培养。种子萌发后用改良的Hoagland营养液水培,水培器皿的外部用黑胶带包好,一方面避免影响根的生长,另一方面防止产生大量绿藻。培养30 d后分别用含有NaCl浓度为0(CK)、50(C50)、100(C100)、150(C150)、200(C200)和250(C250) mmol/L的Hoagland营养液对虉草幼苗进行盐胁迫处理,每处理3个重复,每3 d更换营养液,其余时间用去离子水来补充蒸发所散失的水分。处理5 d后取叶片对各项生理指标进行测定。
游离脯氨酸含量测定采用磺基水杨酸提取,茚三酮显色法测定[21];丙二醛含量的测定采用硫代巴比妥酸(TBA)氧化法[21];叶绿素含量的测定采用丙酮乙醇混合液法[22]。
1.3统计分析 数据通过Excel 2007、SPSS 17.0软件进行统计分析,多重比较采用Duncan法。采用Systat Software公司的SigmaPlot 10.0软件作图,表和图中的数据均为3次重复测定值的平均值。
2 结果与分析
2.1NaCl胁迫对虉草发芽率的影响 在本试验中,随着NaCl浓度的增大,所有参试材料发芽均推迟,低浓度NaCl溶液处理的种子第7 天基本完成发芽,而较高浓度NaCl溶液处理的种子要推迟发芽5~6 d,并且不正常苗和硬实种子比例增加,第19天后,各处理的发芽数均不再改变。
随着NaCl浓度的增大,6份材料的发芽率均有下降趋势,因材料的不同,降低的程度也不同(表2)。对照组中,所有参试材料的发芽率均在89%以上,且材料间不存在显著差异。50 mmol/L NaCl浓度下,盐胁迫对种子萌发的影响较小。当浓度升高到100 mmol/L时,盐胁迫对种子萌发的影响已经逐渐显现出来,但仍有较高的发芽率。150 mmol/L NaCl浓度下,只有Zxy06p-2449的发芽率还保持在80%,表现了极强的种子活力,其余材料发芽率迅速下降。NaCl浓度200 mmol/L时,Zxy06p-2449、Zxy06p-1904及Zxy06p-2380仍有发芽的种子,其余的3份材料不萌发。250 mmol/L NaCl浓度时,所有材料发芽率几乎为0(<1%),因此,虉草发芽极限盐浓度为250 mmol/L。
综上所述,NaCl浓度低于100 mmol/L时,对虉草种子发芽率影响较小,高于这个浓度,明显抑制种子的萌发。在150 mmol/L NaCl浓度下,Zxy06p-2449发芽率最高(80%),其次为Zxy06p-2380(54.67%)、Zxy06p-1904(34.33%)、Zxy06p-2633(12.33%)、Zxy06p-2262(11.67%),Zxy06p-1916发芽率最低(4.33%)。因此,150 mmol/L NaCl浓度可以较好地鉴定出不同材料萌发期的耐盐能力。
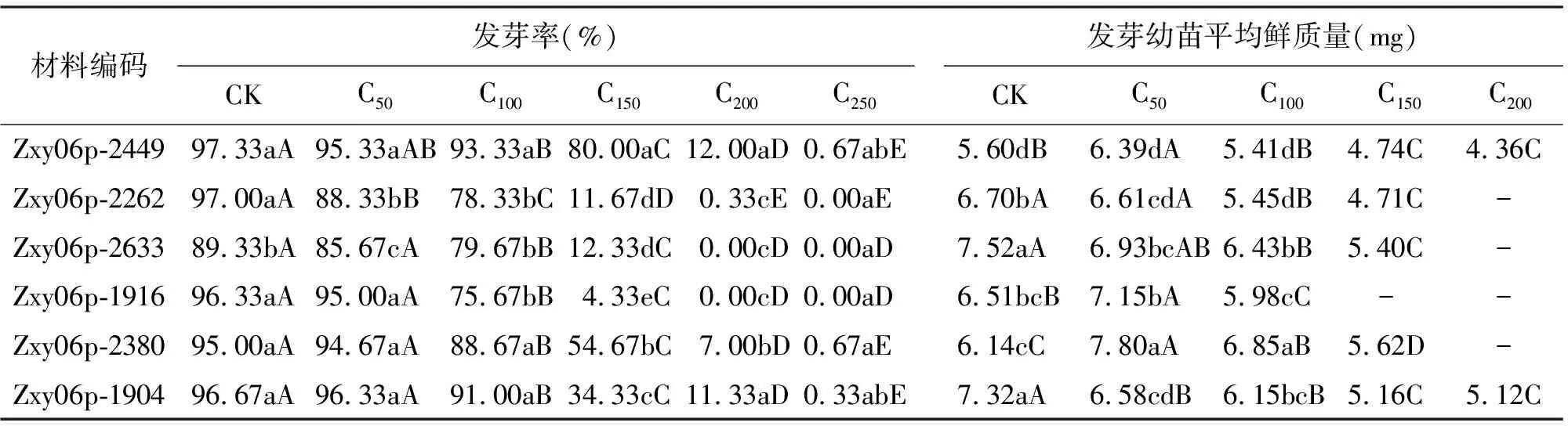
表2 NaCl胁迫对虉草发芽率和发芽幼苗平均鲜质量的影响
2.2NaCl胁迫对虉草幼苗鲜质量的影响 随着NaCl浓度的增大,虉草幼苗鲜质量的变化趋势有所差异(表2)。当NaCl浓度从0升高到50 mmol/L时,Zxy06p-2449、Zxy06p-2380和Zxy06p-1916这3份材料的鲜质量增加,并且长势比对照强壮,说明在一定程度下促进了这些材料幼苗的生长,其余3个材料均降低,幼苗生长受到了抑制。NaCl浓度从50升高到100 mmol/L时,所有材料鲜质量均下降,但Zxy06p-2380的鲜质量仍然大于对照,这也说明它在100 mmol/L NaCl溶液下仍促进生长,但相对于50 mmol/L NaCl溶液有所降低。NaCl浓度大于100 mmol/L时,随着NaCl浓度的提高,所有参试材料幼苗鲜质量均低于对照。150 mmol/L NaCl浓度时,Zxy06p-1916由于发芽株数较少,不足3株,无法统计;200 mmo/L时,只有Zxy06p-2449和Zxy06p-1904可以统计;250 mmo/L时,均无法统计。
2.3NaCl胁迫对虉草发芽种子苗高的影响 Zxy06-2380和Zxy06-2449的苗高变化趋势相同,在50 mmol/L NaCl溶液下苗高大于对照,后随浓度升高逐渐降低,并且小于对照,说明低NaCl浓度对Zxy06-2380和Zxy06-2449种苗的抑制较小,它们可能具有一定的耐盐性(表3)。其余4份材料都随NaCl浓度的升高而逐渐降低,因材料不同降幅有所差异。150 mmol/L NaCl浓度下,Zxy06p-1916因发芽率不足10株,无法统计。200 mmol/L时,Zxy06p-2449与Zxy06p-1904的苗高均大于30 mm,表现出较好的耐盐性,其他材料均无法统计。250 mmol/L NaCl溶液处理下,正常苗均不足5株,所有材料的根都受到严重抑制,无法统计。
2.4NaCl胁迫对虉草幼苗根长的影响 研究胁迫环境对种子萌发的影响时,多以根的生长作为指标之一[23]。对照组因不受NaCl胁迫的影响,根较长且不定根较多,随着NaCl浓度的增大所有参试材料的根长逐渐降低(表3)。100 mmol/L时,6份材料的根长已经下降了约50%,表现出明显的抑制作用。150 mmol/L时,Zxy06p-1916由于正常苗仅1~3株,无法统计,Zxy06p-2449根长相对于对照组降幅最低(15.6 mm),幼根耐盐性相对较强。200 mmol/L时,除了Zxy06p-2449和Zxy06p-1904,其余无法作统计分析或是正常苗为0株,根部生长受抑制严重,即根长为0。NaCl浓度到250 mmol/L时,只有3个材料有正常苗,但均不足5株,其余材料无正常苗。
在这6份材料当中,Zxy06p-2449在150和200 mmol/L NaCl浓度下,根长降幅最低(>10 mm),与其他材料相比,表现出较强的耐盐能力。
2.5不同浓度NaCl处理对虉草幼苗脯氨酸含量的影响 6份材料对照组的脯氨酸含量差异不大(图1),在50 mmol/L NaCl浓度下,所有材料脯氨酸含量变化不明显,当NaCl浓度高于100 mmol/L时,脯氨酸含量均显著增大,因材料不同,增幅也不同。200 mmol/L时,与对照相比,脯氨酸含量是对照组的10~35倍,Zxy06p-2449与Zxy06p-1904的增幅较大,积累脯氨酸的能力较强,说明这2份材料对盐胁迫的适应调节能力较好。虉草幼苗在NaCl处理下,脯氨酸含量增幅显著,可见脯氨酸是虉草在盐胁迫下重要的渗透调节物质之一。
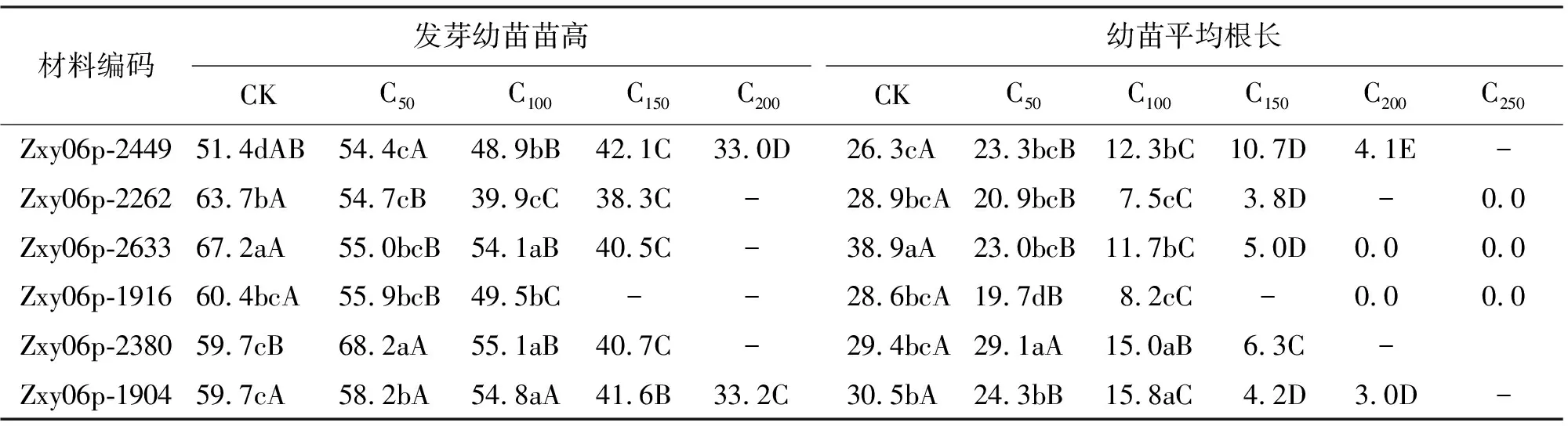
表3 NaCl胁迫对虉草种子发芽幼苗苗高和幼苗平均根长的影响 mm

图1 NaCl胁迫对虉草幼苗脯氨酸含量的影响
2.6不同浓度NaCl处理对虉草幼苗丙二醛含量的影响 6份材料的丙二醛含量随NaCl浓度的增加呈先降低后升高的趋势(图2),可能因为NaCl浓度低于200 mmol/L时,通过积累脯氨酸等渗透调节物质或其他耐盐机制的相互作用,丙二醛含量降低,当浓度继续增大时,超过了调节的阀值,使丙二醛含量升高,膜质过氧化程度增大,但增幅与对照相比较小,甚至有的材料低于对照,如Zxy06p-2449与Zxy06p-1904。可见,在高NaCl胁迫下丙二醛含量的变化不能反映虉草受盐害程度,可能虉草有自己的抗膜质过氧化的机制或与其他机制相互作用,保护膜系统的完整性。

图2 NaCl胁迫对虉草幼苗丙二醛含量的影响
2.7不同浓度NaCl处理对虉草幼苗叶绿素含量的影响 在低NaCl浓度下,叶绿素a含量变化不明显(图3a),NaCl浓度大于150 mmol/L时,所有材料均有不同程度的降低。250 mmol/L NaCl浓度时,Zxy06p-2262与Zxy06p-1916下降幅度较大,叶绿素a含量比对照分别降低了48.9%和53.7%,其次是Zxy06p-2449、Zxy06p-2380、Zxy06p-1904,Zxy06p-2633降幅最低,这可能是叶绿素合成与分解相互调节的结果。
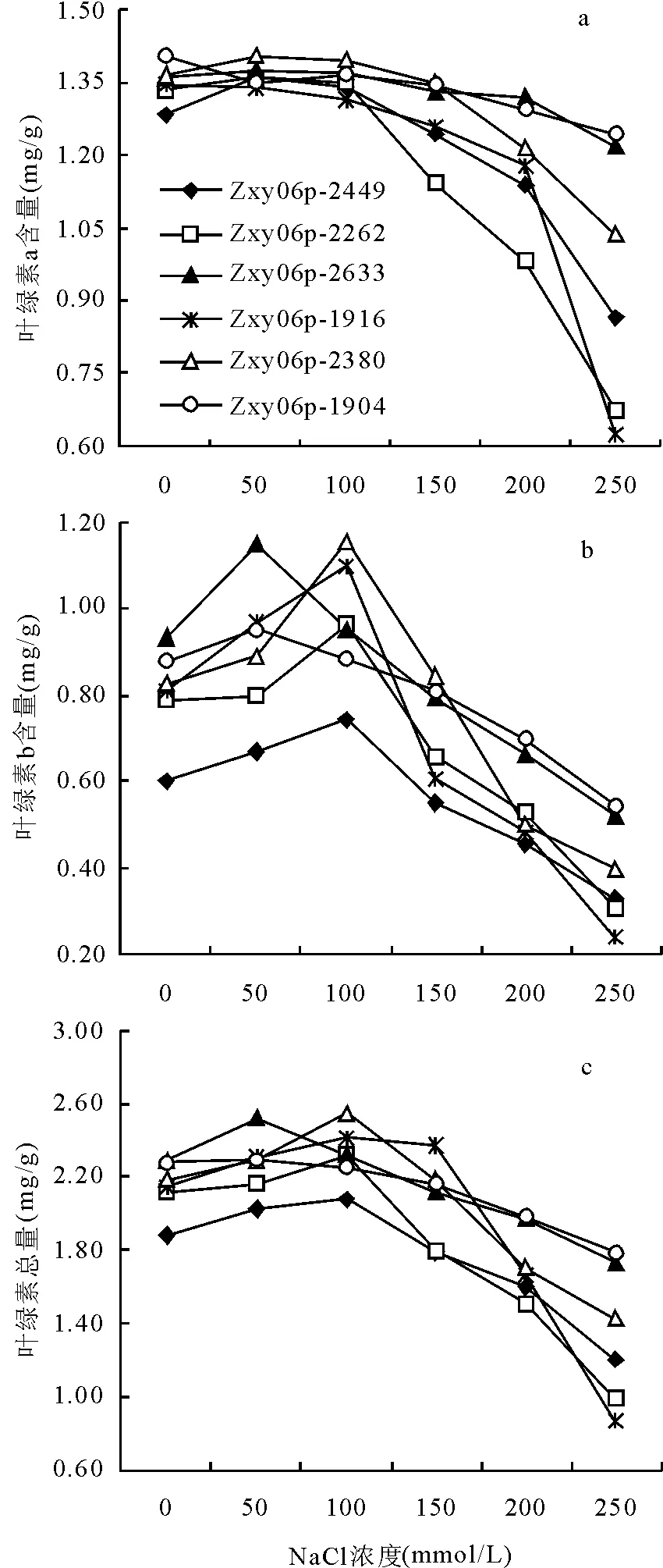
图3 NaCl胁迫对虉草幼苗叶绿素含量的影响
所有参试材料的叶绿素b(图3b)和叶绿素总量均呈先升高后降低的趋势(图3c),当NaCl浓度大于200 mmol/L时,叶绿素b与叶绿素总量都低于对照。250 mmol/L NaCl浓度时,Zxy06p-1916的叶绿素b含量及叶绿素总量下降幅度最大,与对照相比分别照降低了70.3%和59.9%,其次是Zxy06p-2262,分别降低了61.1%和53.5%,Zxy06p-2380与Zxy06p-2633居中,Zxy06p-2449、Zxy06p-1904的降幅较小。
3 讨论与结论
3.1盐胁迫对虉草种子发芽和生长的影响 目前,国内外对植物种子耐盐性的研究已经有大量的报道[24-28],对于大多数植物,无盐条件下种子的发芽最好,低浓度盐会延缓种子的萌发,高浓度盐分抑制种子的萌发[29]。种子萌发期是耐盐能力相对较弱的时期,盐胁迫环境可减少植物种子水分吸收,同时盐胁迫还打破了植物体内激素平衡,降低了种子内储存物质的利用[30]。本研究发现,随盐胁迫浓度增加,虉草种子发芽率、鲜质量、苗高、根长总体呈下降趋势,但因材料的不同,在不同盐浓度下所表现的差异很小,低盐浓度对虉草发芽影响较小,这与Guan等[31]和沈禹颖等[32]的研究结论一致,即低盐浓度对种子发芽抑制作用不明显。盐地碱蓬(Suaedasalsa)[33]、羊草(Leymuschinensis)、野大麦(Hordeumspontaneum)及朝鲜碱茅(Puccinelliachinampoensis)[34]在盐胁迫下,幼根对盐分的反应比幼苗敏感。在本试验中,盐胁迫对虉草幼苗的影响同样比幼根轻微得多,在高盐浓度下出现许多有芽无根的畸形苗,最高可达85%。根据在高盐和低盐浓度下种质的表现初步判断,Zxy06p-2449和Zxy06p-1904耐盐性较强,其次是Zxy06p-2380和Zxy06p-2633,Zxy06p-2262与Zxy06p-1916耐盐性较弱。
3.2盐胁迫对虉草脯氨酸、丙二醛及叶绿素的影响 植物在逆境条件下体内会发生一系列的生理生化变化,以提高植株抵抗逆境胁迫的能力。在盐胁迫下,脯氨酸是公认的渗透保护剂,其含量的多少,直接关系到其抗逆性的强弱。在正常生长条件下脯氨酸的含量低,但在逆境时脯氨酸在细胞质中会大量积累达几十倍甚至几百倍以进行渗透调节[35-36]。脯氨酸积累是植物为了对抗逆境胁迫而采取的一种保护性措施。盐胁迫下,随着盐浓度的增大虉草脯氨酸含量显著增加,说明虉草受到的逆境胁迫增大,渗透调节能力增强,所受胁迫强度高,适应能力强。董秋丽等[37]和李孔晨[38]等同样分别证实了盐胁迫下,芨芨草属(Achnatherum)和黑麦草属植物叶片的脯氨酸含量随胁迫浓度的增加而呈递增趋势,这与本研究结果一致。
丙二醛是植物在环境胁迫下膜脂过氧化而产生的一种具有细胞毒性的物质,普遍作为一种伤害指标[39],其产生数量的多少能够代表膜脂过氧化程度大小,间接反映植物组织的抗氧化能力的强弱。有研究[40-41]认为,在盐胁迫下,丙二醛含量随着盐浓度的增加而增加。但在本研究中,低盐浓度下丙二醛含量反而比对照低,随着盐浓度的增加,丙二醛含量呈上升趋势,这与汪月霞等[42]的研究结论一致,但由于在植株表现严重伤害时,丙二醛含量的变化幅度并不大,不能真正衡量虉草受盐害程度,所以丙二醛不能作为鉴定虉草耐盐性的重要指标,可作为虉草耐盐性大小鉴定的参考指标。
叶绿素是植物进行光合作用的物质基础,叶绿素含量与叶片光合作用密切相关。本研究结果表明,在盐胁迫条件下,低盐浓度下,叶绿素a、叶绿素b和叶绿素总量变化幅度较小,NaCl浓度大于150 mmol/L时,虉草幼苗叶片中的叶绿素a、叶绿素b和叶绿素总量都显著下降,说明盐胁迫抑制了虉草幼苗叶片中叶绿素的合成。这可能是由于盐胁迫下,植物吸收不到足够的水分和矿质营养,造成营养不良,致使叶绿素含量降低[43],也有可能是由于受盐胁迫,植株体内的叶绿素降解酶的活性增强,从而促进了叶绿素的降解[32]。
综上所述,不同浓度盐胁迫对6份虉草材料种子发芽、幼苗生长及生理生化指标均有影响,大部分指标的耐盐评价结果基本一致。Zxy06p-2449、Zxy06p-1904抗耐盐能力较强,其次为Zxy06p-2380、Zxy06p-2633,Zxy06p-2262和Zxy06p-1916的耐盐性较差。试验结果对虉草育种材料选择具有一定的参考价值。由于本试验仅探讨了盐对不同虉草材料幼苗的影响,但实际上盐土常含多种盐分,不同无机离子之间存在着相互作用,同时幼苗的耐盐性与成熟植株的耐盐性是否一致还有待研究。因此,关于虉草在实际盐碱土壤条件下的耐盐性状况尚需进一步探讨研究。
[1]Sahramaa M.Evaluating germplasm of reed canary grass,Phalarisarundinacea[M].Helsinki:University of Helsinki,2004:7.
[2]Sahramaa M,Hömmö L,Jauhiainen L.Variation in seed production traits of reed canary grass germplasm[J].Crop Science,2004,44:988-996.
[3]Sahramaa M.Evaluation of reed canary grass for different end-uses and in breeding[J].Agricultural and Food Science in Finland,2003,12(324):227-241.
[4]解新明,周峰,赵燕慧,等.多年生能源禾草的产能和生态效益[J].生态学报,2008,28(5):2329-2340.
[5]徐子敏,王连生.野生虉草的栽培驯化[J].中国草地,1992(6):23-27.
[6]Lewandowski I,Scurlock J M O,Lindvall E,etal.The development and current status of perennial rhizomatous grasses as energy crops in the US and Europe[J].Biomass and Bioenergy,2003,25:35-61.
[7]Landström S,Lomakka L,Andersson S.Harvest in spring improves yield and quality of reed canary grass as a bioenergy crop[J].Biomass and Bioenergy,1996,11:33-41.
[8]Sahramaa M,Jauhiainen L.Characterization of development and stem elongation of reed canary grass under northern conditions[J].Industrial crops and products,2003,18:155-69.
[9]Hadders G,Olsson R .Harvest of grass for combustion in late summer and spring[J].Biomass and Bioenergy,1997,12(3):171-175.
[10]Heide O M.Control of towering inPhalarisarundinacea[J].Netherlands Journal of Agricultural Science,1994,8:259-276.
[11]Marten G C,Heath M E.Reed canarygrass[A].In:Heath M E,Metcalfe D S,Barnes R F,etal.Forages:the Science of Grassland Agriculture[M].3rd ed.Iowa,USA:Iowa State University Press,1973:263-276.
[12]Gyulai G,Mester Z,Kiss J,etal.Somaclonal breeding of reed canary grass[J].Grass and Forage Science,2003,58:210-214.
[13]Burvall J.Influence of harvest time and soil type on fuel quality in reed canary grass (PhalarisarundinaceaL.)[J].Biomass and Bioenergy,1997,12(3):149-154.
[14]Lewandowski I,Scurlockb J M O,Lindvall E,etal.The development and current status of perennialrhiz omatous grasses as energy crops in the US and Europe[J].Biomass and Bioenergy,2003,25:335-361.
[15]刘刚,游明鸿,白史且.“川草3号” 虉草饲用价值初步研究[J].草业与畜牧,2008,12:11-12.
[16]Michael F,Calle N.Variations in ash content,pulp yield,and fibre properties of reed canary-grass[J].Industrial Crops and Products,2005:157-167.
[17]Katri P,Mikko A,Mika I.Large-scale energy grass farming for power plants——A case study from Ostrobothnia,Finland[J].Biomass and Bioenergy,2008,32:1009-1015.
[18]Nassio Di Nasso N,Angelini L G,Bonari E.Influence of fertilisation and harvest time on fuel quality of giant reed(ArundodonaxL.) in central Italy[J].European Journal of Agronomy,2010,32:219-227.
[19]Rajib B,Shailendra S.DNA polymorphism among 18 species ofTriticum-Aegilopscomplex using wheat EST-SSRs[J].Plant Science,2004,166:349-356.
[20]ISTA.国际种子检验规程[M].颜启传,毕辛华,译.北京:农业出版社,1985:204.
[21]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:258-261.
[22]张宪政.作物生理研究法[M].北京:农业出版社,1992:145-147.
[23]Muller D A.Germination and root growth of 4 osmoconditoned cool-season grasses[J].Range Management,1996,49:117-120.
[24]王玉祥,陈爱萍,张博.不同苜蓿品种耐盐性初探[J].草业科学,2010,27(3):102-106.
[25]Ajmal K M,Salman G.Germination responses ofSporobolusioclados:a saline desert grass[J].Journal of Arid Environments,2003,53:387-394.
[26]Chartzoulakis K S,Loupassaki M H.Effects of NaCl salinity on germination,growth,gas exchange and yield of greenhouse eggplant[J].Agricultural Water Management,1997,32:215-225.
[27]杜利霞,董宽虎,夏方山,等.NaCl胁迫对新麦草种子萌发特性和生理特性的影响[J].草地学报,2009,17(6):789-794.
[28]林紫玉,贾文庆.紫花苜蓿种子在高盐分条件下发芽特性的研究[J].种子,2008,27(3):80-82.
[29]秦峰梅,张红香,武祎,等.NaCl胁迫对黄花苜蓿发芽及幼苗生长的影响[J].草业学报,2010,19(4):71-78.
[30]Jaleel C A,Gopi R,Sankar B,etal.Studies on germination,seedling vigor,lipid peroxidation and proline metabolism inCatharanthusroseusseedlings under salt stress[J].South African Journal of Botany,2007,73:190-195.
[31]Guan D,Zhou B,Zhang H,etal.Germination responses ofMedicagoruthenicaseeds to salinity,alkalinity,and temperature[J].Journal of Arid Environments,2009,73:135-138.
[32]沈禹颖,王锁民,陈亚明.盐胁迫对牧草种子萌发及其恢复的影响[J].草业学报,1999,8(3):54-60.
[33]Song J,Fan H,Zhao Y Y,etal.Effect of salinity on germination,seedling emergence,seedling growth and ion accumulation of a euhalophyteSuaedasalsain an intertidal zone and on saline inland[J].Aquatic Botany,2008,88:331-337.
[34]李海燕,丁雪梅,周婵,等.盐胁迫对3种盐生禾草种子萌发及其胚生长的影响[J].草地学报,2004,12(1):45-50.
[35]李合生.现代植物生理学[M].北京:高等教育出版社,2002:433-434.
[36]Yamada M,Morishita H,Urano K,etal.Effects of free proline accumulation in petunias under drought stress[J].Journal of Experimental Botany,2005,56(417):1975-1981.
[37]董秋丽,夏方山,董宽虎.盐胁迫对芨芨草苗期脯氨酸代谢的影响[J].草业学报,2010,19(5):71-76.
[38]李孔晨,卢欣石.黑麦草属9个品种萌发及苗期耐盐性研究[J].草业科学,2008,25(3):111-115.
[39]Li G,Wan S W,Zhou J,etal.Leaf chlorophyll fluorescence,hyperspectral reflectance,pigments content,malondialdehyde and proline accumulation responses of castor bean(RicinuscommunisL.) seedlings to salt stress level[J].Industrial Crops and Products,2010,31:13-19.
[40]Sreenivasulu N,Ramanjulu S,Ramachandra-Kini K.Total peroxidase activity and peroxidase isoforms as modified by salt stress in two cultivars of fox-tail millet with differential salt tolerance[J].Plant Sciences,1999,141:1-9.
[41]Giridarakumar S,Madhusudhan K V,Sreenivasulu N,etal.Stress responses in two genotypes of mulberry (MorusalbaL.) under NaCl salinity[J].Indian Journal of Experimental Biology,2000,38:192-195.
[42]汪月霞,孙国荣,王建波,等.盐胁迫下星星草幼苗MDA含量与膜透性及叶绿素荧光参数之间的关系[J].生态学报,2006,26(1):122-129.
[43]梁云媚,李燕,多立安,等.不同盐分胁迫对苜蓿种子萌发的影响[J].草业科学,1998,15(6):21-25.
