白花败酱草对U14荷瘤鼠肿瘤细胞周期和PCNA表达的影响
2011-04-18田黎明田丽华
张 涛,田黎明,王 昭,田丽华
(佳木斯大学医学院,黑龙江佳木斯 154007)
白花败酱草是败酱科草本植物的根茎及带根全草,具有清热利湿、解毒排脓、活血化瘀、改善肝功能、抑菌和抗病毒等作用[1]。民间验方中与其它中药配伍,用于治疗肠癌和膀胱癌[2]。有报道此药可抑制鼠源性腹水癌[3]。但有关白花败酱草皂苷在抗肿瘤方面的作用,国内外尚未见报道。本实验探讨白花败酱草的抗肿瘤作用与机制,为寻找有效的抗肿瘤药物提供部分理论和实验依据。
1 材料与方法
1.1 实验动物及处理
昆明种雌性小鼠(6周龄20~22g),中国医学科学院实验动物研究所繁育场提供。动物随机分瘤源鼠组、皂苷低组(50mg/kg◦d)、皂苷高组(100mg/kg◦ d)、CTX(环磷酰胺25mg/kg◦d)组及对照组。每组10只,瘤源鼠组腹腔注射U14细胞株0.2mL/只,注射7d后在无菌条件下吸取腹腔中的腹水型瘤细胞,稀释成 1.6×106个/mL,无菌条件下给其余5组小鼠每只左前腋下接种0.2mL瘤细胞。在接种瘤细胞24h后,给各组鼠灌服皂苷,对照组灌服同剂量的凉开水;CTX组按25mg/kg◦d腹腔注射 CTX;连续14d,第15天小鼠摘眼球取血后,断髓处死,剥离瘤体称重。
1.2 瘤细胞株
U14鼠宫颈癌细胞株购自中国医学科学院细胞库。
1.3 药物制备及主要试剂
白花败酱草购于中国河北省秦皇岛市民乐医药公司,由安国市昌达中药材饮片有限公司提供,此药通过秦皇岛市药材公司鉴定。白花败酱草粉碎按1:10用70%食用酒精浸泡4h,加热回流提取2次滤液,减压回收乙醇,得白花败酱草醇粗提物[4],此醇提物上AB8大孔吸附树脂层析柱后用蒸馏水洗脱至洗脱液中无糖为止(M olish反应阴性)。再分别用30%、50%和70%乙醇洗脱,收集各浓度的洗脱液,至各洗脱液Liberman-Burchard反应阴性为止。混合各洗脱液,减压浓缩真空干燥得白花败酱草总皂苷粗提物。AB8大孔吸附树脂购于天津南开大学化工厂,环磷酰胺(CTX):江苏恒瑞医药股份有限公司产品,PCNA免疫组化试剂盒购于福建迈新生物技术有限公司。
表1 白花败酱草皂苷对U14荷瘤小鼠肿瘤的抑制作用(±s)
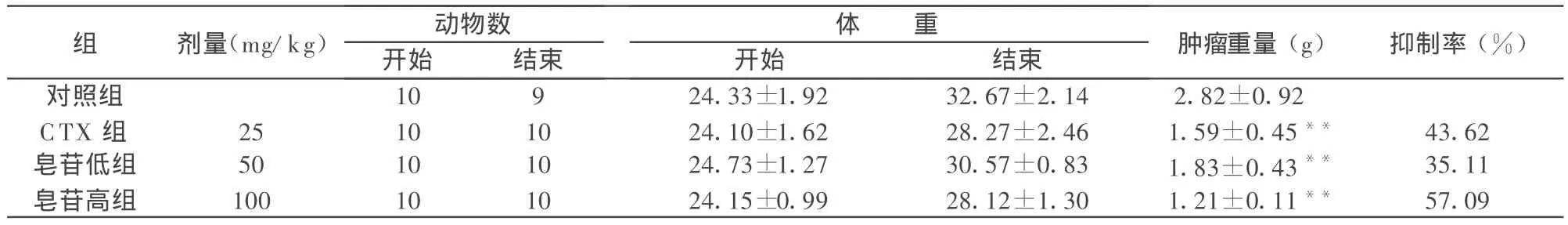
表1 白花败酱草皂苷对U14荷瘤小鼠肿瘤的抑制作用(±s)
与对照组比较**P<0.01。
组 剂量(mg/kg) 动物数 体____重开始___________结束 开始 结束 肿瘤重量(g) 抑制率(%)对照组 10 9 24.33±1.92 32.67±2.14 2.82±0.92 CTX 组 25 10 10 24.10±1.62 28.27±2.46 1.59±0.45** 43.62皂苷低组 50 10 10 24.73±1.27 30.57±0.83 1.83±0.43** 35.11__皂苷高组 100__________________10_______________10_______________________________________________________________________________24.15±0.99_28.12±1.30_1.21±0.11**_57.09
1.4 实验方法
肿瘤组织细胞PCNA蛋白的检测:对照组、皂苷高及CTX组的瘤体切片采用免疫组织化学SP法检测(按试剂盒说明书操作),光镜下观察PCNA蛋白的表达,判断标准:褐色核表达的是阳性细胞,蓝色核表达的是阴性细胞,随机计数5个高倍镜(40倍)视野中阳性细胞百分率。细胞周期分析和细胞凋亡检测:对照组、皂苷高及CTX组的瘤体组织剪碎,用200目过滤制备单细胞悬液。离心洗涤3次后,调整细胞浓度为1×106个/mL,4℃70%的乙醇固定30min,用含RNA酶的碘化丙啶染色液染色30min后上流式细胞仪检测DNA含量和分析细胞周期,并用Muhicycle软件处理,得出细胞各周期的百分率和凋亡细胞百分率[8]。
1.5 统计学处理
实验数据以均数±标准差表示,应用SAS 9.13软件进行统计学处理,组间差异的显著性先进行完全随机设计的方差分析,再采用 dunnet‵t检验 。
2 结果
2.1 白花败酱草总皂苷对U14荷瘤鼠肿瘤的抑制率
对照组瘤体平均重量为(2.82±0.92)g,皂苷低、高和CTX组,瘤体重量分别为(1.83±0.43)g、(1.21±0.11)g和(1.59±0.45)g,给药组瘤体重量明显低于对照组(P<0.01),肿瘤的抑制率分别是 35.11%、57.09%和43.62%(见表 1)。
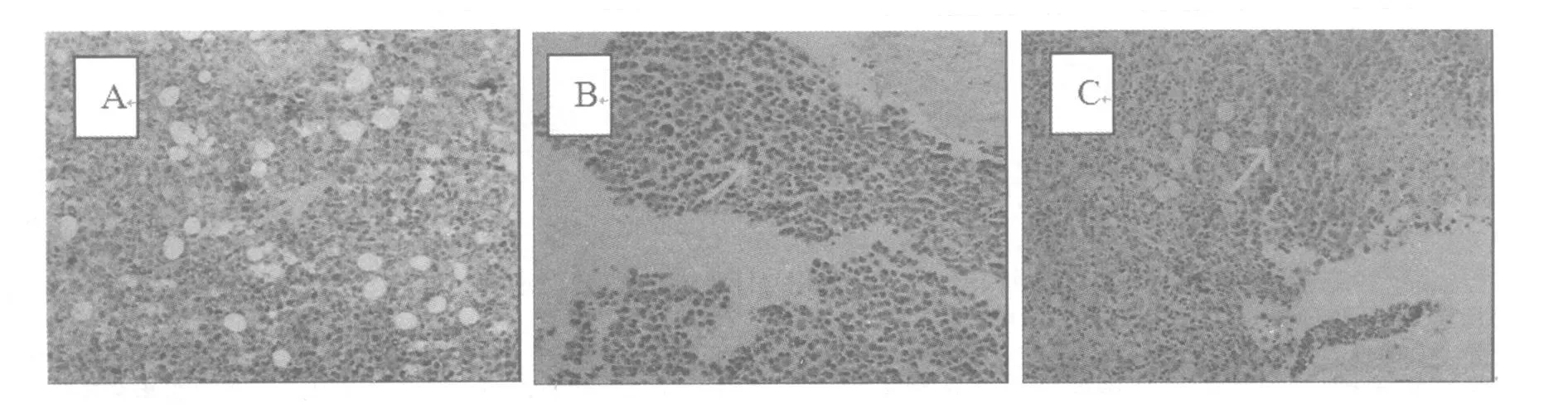
图1 白花败酱草皂苷对肿瘤细胞PCNA表达的影响(SP×100)
2.2 白花败酱草皂苷对U14荷瘤鼠肿瘤组织细胞PCNA蛋白表达的影响
皂苷高、CTX与对照组比较,PCNA蛋白的阳性细胞率明显减少,分别是(21.8±3.19)%、(26.2±3.68)%和(80.6±6.02)%;可见各给药组PCNA、蛋白的表达明显低于对照组(P<0.01,见表2,图1)。
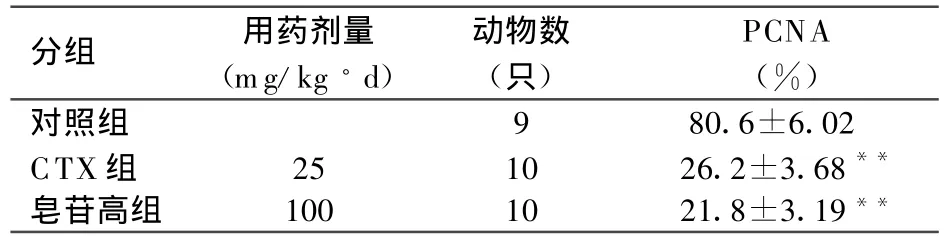
表2 皂苷对U14荷瘤鼠肿瘤组织细胞PCNA蛋白表达的影响
2.3 白花败酱草皂苷对U14荷瘤鼠肿瘤组织细胞周期和凋亡的影响
皂苷高组和CTX组,处于G0/G1期的肿瘤细胞数由对照组的38.1%增加为68.5%和65.0%,而处于S期和G2/M期细胞的百分数减少;肿瘤细胞凋亡数由对照组的(9.42±0.16)%增至(28.92±1.24)%和(23.86±0.13)%,结果见表3,图2。
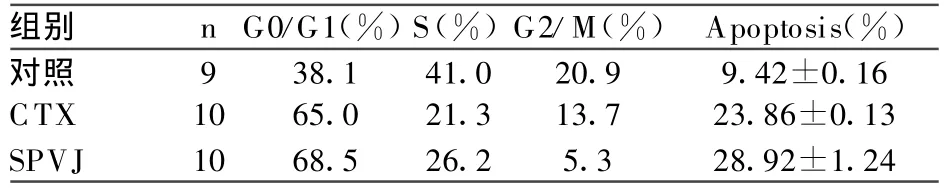
表3 白花败酱草皂苷对U14荷瘤鼠肿瘤组织细胞周期和凋亡的影响
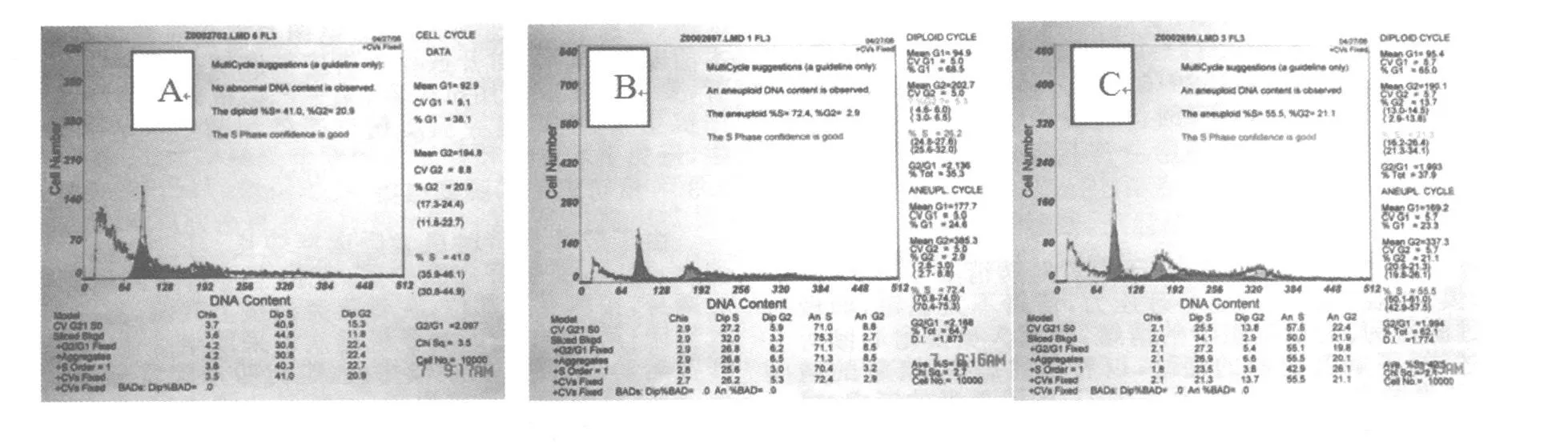
图2 白花败酱草皂苷对U14荷瘤鼠肿瘤组织细胞周期的影响
3 讨论
肿瘤发生的主要特征是细胞周期失调后导致的细胞无限制增殖,阻止癌细胞分裂即可达到抑制其恶性生长甚至将其杀灭的目的,实际上多数肿瘤化疗药物均是细胞周期的抑制剂。肿瘤细胞增殖的速度主要决定于G0/G1期的长短及参与分裂的细胞数量的多少[5]。本实验灌服100mg/kg◦d皂苷和25mg/kg◦d腹腔注射CTX后,U14荷瘤鼠瘤体组织细胞处于G0/G1期的细胞数由对照组的38.1%增加为68.5%和65.0%,而处于S期和G2/M期细胞的百分数减少,可见败酱草皂苷和环磷酰胺可使肿瘤细胞主要受阻于G0/G1期,G0/G1期阻滞使肿瘤细胞周期延长,S期细胞减少使参与分裂的细胞数减少,进而使肿瘤细胞的增殖速度降低,达到抑制其生长繁殖的作用。诱导细胞凋亡可能是不同机制的抗癌药物发挥作用的共同途径[6]。本研究表明,U14荷瘤鼠灌服大剂量白花败酱草皂苷后,肿瘤组织细胞凋亡率由对照组的(9.42±0.16)%明显上升为(28.92±1.24)%,环磷酰胺组细胞凋亡率也增致为(23.86±0.13)%,揭示败酱草皂苷可以诱导肿瘤细胞的凋亡,使肿瘤细胞数减少。诱导肿瘤细胞凋亡是败酱草皂苷抑制肿瘤细胞生长的又一机制。
PCNA是细胞核内DNA聚合酶δ的辅助蛋白,许多研究发现PCNA在G0~G1期细胞中无明显表达,G1晚期表达增加,S期达到高峰,G2/M期明显下降,PCNA量的变化与DNA合成一致,可作为评价细胞增殖状态的一个指标[7]。本研究表明,对照组肿瘤组织细胞PCNA蛋白高表达,而皂苷和CTX能抑制肿瘤细胞中PCNA的表达,同时阻止肿瘤细胞于G1期,揭示肿瘤细胞PCNA表达量与其增殖分化程度相一致,提示白花败酱草皂苷可以抑制PCNA的表达,推测可阻止肿瘤细胞DNA的合成,达到抑制肿瘤细胞增殖的目的。总之白花败酱草皂苷能抑制体内U14宫颈癌细胞的生长,其抗肿瘤作用可能是通过诱导肿瘤细胞凋亡,干扰肿瘤细胞周期,抑制肿瘤细胞中PCNA基因的表达而实现其抑制实体瘤的生长。
[1]陈炳华.白花败酱草食疗价值高[J].植物杂志,2002,6:15
[2]刘春安,彭明.抗癌中草药大辞典[M].武汉:湖北科学出版社,1994,624
[3]Dharmananda S.1997.The treatment of gastro-intestinal cancers with Chinese medicine.http://www.itmonline.org/arts/gicancer.htm.
[4]徐洁昕,周方钦,江放明.白花败酱总皂甙提取工艺研究[J].山东中医药大学学报,2005,29(3):227-229
[5]许杜娟,吴强,杨雁.黄芪总苷的抑瘤作用及其机制[J].中国药理学通报,2003,19(7):823-826
[6]M akin G.,Dive C.Apoptosis and cancer chemotherapy[J].Trends in Cell Biology,2001,11:22-26
[7]魏永昆.增殖细胞核抗原与肿瘤研究进展[J].国外医学肿瘤学分册,1996,23(增刊):47-49
[8]栗坤,王淑香,赵海峰.茜草醇提物对小鼠 U14宫颈癌抑制作用的研究[J].黑龙江医药科学,2008,31(6):16
