槲皮素对P-糖蛋白转录调控机制的研究*
2011-04-17左彦珍李宝群
左彦珍,李宝群,周 健
(承德医学院药理学教研室,河北承德 067000)
槲皮素为一种天然黄酮类化合物,广泛分布于多种植物的花和果实中,同时它还是一些中草药的有效成分,具有抗氧化、抗炎、抗过敏、抑制恶性肿瘤生长等多方面的药理作用[1]。近年来对其研究的报道逐渐增多。
MDR1基因产物P-糖蛋白在抗肿瘤多药耐药研究中首先被发现,它是一种药物外排泵,主要在肝脏、肠道及肾脏中表达,在药物的吸收、分布和排泄方面发挥重要作用。CYP3A4参与临床常用药物及多种致癌物的代谢,大多数药物是P-糖蛋白和CYP3A二者的共同底物,在被P-糖蛋白转运的同时又被CYP3A代谢[2]。早期研究发现,孕烷X受体(一种核受体,PXR)介导了外源性物质如槲皮素,对肝细胞CYP3A4的诱导表达,但在小肠细胞与肝细胞中CYP3A4的表达并不一致;维生素D3(Vitamin D3,VD3)与维生素D受体(VDR)结合后也可诱导CYP3A4表达上调,并且晚近研究表明VDR是小肠细胞中调控CYP3A4表达的重要核受体[3]。至今尚无槲皮素对P-糖蛋白表达影响机制的研究报道,因此,本研究基于P-糖蛋白诱导表达的分子机制,旨在探讨槲皮素能否通过活化hVDR影响MDR1的表达。
1 材料与方法
1.1 主要试剂 1,25(OH)2D3,Sigma公司;槲皮素(纯度>99%),昆明贝克诺顿制药有限公司;COS-7细胞,中科院上海细胞所;胎牛血清,四季清公司;DMEM培养基,Sigma公司。双荧光素酶活性分析试剂盒、海肾荧光素酶报告载体(pRL-TK)、空载体pcDNA3.1-myc/his B(-),Promega公司;含有编码VDR全长cDNA真核表达质粒pcDNA3.1-myc/his B(-)hVDR及 P-糖蛋白报告基因载体,中南大学临床实验室惠赠。
1.2 细胞培养与转染 COS-7细胞用DMEM+10% FBS培养基培养,37℃、5% CO2条件下生长至80%汇合时进行传代接种。调细胞浓度至4×104细胞/ml,按0.5ml/孔接种到48孔培养板,37℃、5% CO2培养细胞24h后进行转染。转染时将200ng P-糖蛋白报告基因载体(MDR1-SV40-Luc)、50ng hVDR真核表达载体与0.5μl Lipofectamine TM 2000阳离子脂质体混合孵育后,加入到1个培养孔,转染4h后更换为DMEM+10% FBS培养基再培养20h。同时设立空白对照(20ng空载体pcDNA3.1-myc/his B(-))和内对照(20ng海肾荧光素酶报告载体pRL-TK)。
1.3 待测药物处理和荧光素酶活性检测 槲皮素和1,25(OH)2D3分别用乙醇溶媒配制,继续培养24h弃去原培养基,加入含有10、15、20μmol/L的槲皮素完全培养基处理细胞48h后裂解细胞,各药物浓度处理组中的乙醇浓度控制为0.1%,同时设置仅含0.1%乙醇的溶媒对照组和含有100nmol/L的1,25(OH)2D3-0.1%乙醇阳性对照组。各组细胞用双荧光素酶活性分析试剂盒处理,分别测定萤火虫荧光素酶和海肾荧光素酶活性值。各组细胞的转染效率通过将萤火虫萤光素酶荧光值除以同一样品的海肾萤光素酶荧光值进行校正。细胞转染和荧光素酶活性检测重复3次,每次转染均设置复孔,取平均值。
1.4 统计学分析 所有数据都用(均数±标准差)表示,采用SPSS 11.0统计软件对各处理组荧光素酶比活性值进行ANOVA分析,多组之间均数比较采用LSD方法。P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度槲皮素均可诱导P-糖蛋白的表达 不同浓度的槲皮素处理转染后的细胞,均可出现MDR1驱动的荧光素酶表达显著增加;阳性对照组100nM 1,25(OH)2D3作用下亦可诱导MDR1的表达显著增加。见附表。
附表 槲皮素对MDR1的转录激活能力(±s)
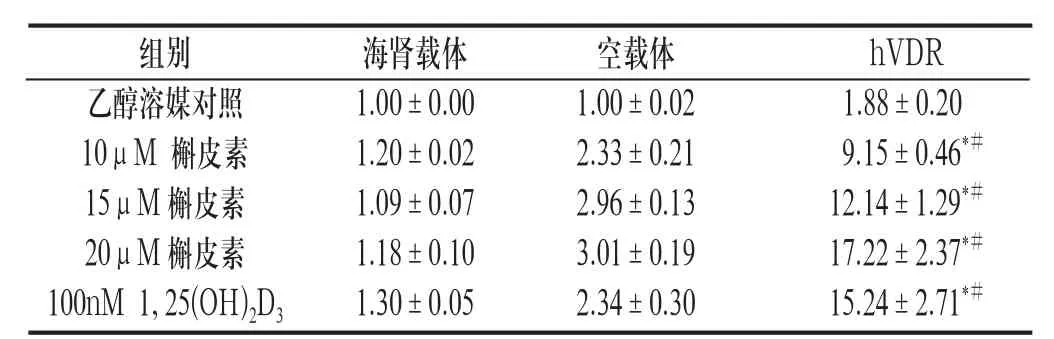
附表 槲皮素对MDR1的转录激活能力(±s)
与空载体组比较:*P<0.01;与乙醇溶媒对照比较:P<0.01
2.2 槲皮素诱导P-糖蛋白表达通过维生素D受体介导
槲皮素三种浓度均能通过激活hVDR介导MDR1的表达上调,与空载体组比较有统计学意义(P<0.01)。见附表。
3 讨论
鉴于诸多天然药物对药物代谢酶或转运体存在抑制、诱导作用,导致上市后发生严重药物相互作用或在少数人群中出现血药浓度异常致中毒的现象,很多国家已经对此做出相关规定:新药开发过程中必须研究对药物代谢酶的抑制或诱导特性,以增强药物的安全性和有效性。由于天然药物的使用越来越广泛,临床医生开处方时需要考虑病人服用天然药物的用药史,对于可能出现的药物不良相互作用给予充分重视。
目前,MDR1基因产物P-糖蛋白的底物药物在临床上应用非常广泛,包括许多抗肿瘤药物、地高辛、糖皮质激素等[4]。因此在药物研究和开发过程中,建立筛检核受体介导的药物诱导剂体系,淘汰具有诱导效应的先导化合物,对于降低新药研发成本及避免临床上的药物相互作用具有重要意义。本研究利用构建的人VDR真核表达载体和包含MDR1基因核受体反应元件的荧光素酶报告基因载体,体外共转染COS-7细胞,结果表明槲皮素可以通过活化VDR诱导MDR1的转录表达,进而可能影响某些药物、食物的代谢转化;由于人们摄入槲皮素的剂量范围较广,很可能会影响各种伴随服用的需经MDR1转运的药物(如地高辛),导致体内药物浓度以及半衰期显著降低,从而降低药物疗效[5]。
本研究还提示,槲皮素作为一种植物雌激素预防激素依赖肿瘤的机制除了通过与雌激素受体结合,竞争性拮抗内源性雌激素的作用外,可能还与其通过活化VDR诱导MDR1加速内源性激素的代谢、降低血液和组织中的激素水平有关,但有待进一步的研究证实。
[1]Chou CC, Yang JS, Lu HF, et al. Quercetin-mediated cell cycle arrest and apoptosis involving activation of a caspase cascade through the mitochondrial pathway in human breast cancer MCF-7 cells [J]. Arch Pharm Res, 2010, 33(8):1181-1191.
[2]Congiu M, Mashford ML,Slavin JL, et al. Coordinate regulation of metabolic enzymes and transporters by nuclear transcription factors in human liver disease [J]. J Gastroenterol Hepatol,2009, 24(6): 1038-1044.
[3]李宝群,郝志敏.维生素D受体多态性与肠道CYP3A4表达:维生素D受体基因突变在人群中分布有差异吗?[J].中国临床康复,2010,14(24):4533-4537.
[4]Hughes J, Crowe A. Inhibition of P-glycoprotein-mediated effl ux of digoxin and its metabolites by macrolide antibiotics[J].J Pharmacol Sci, 2010, 113(4):315-324.
[5]Benassayag C, Perrot-Applanat M, Ferre F. Phytoestrogens as modulators of steroid action in target cells[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2002, 777(1-2): 233- 248.
