人呼吸道合胞病毒不同纯化方法的比较研究
2011-04-03董莉娟蒋蕊鞠龙润乡白慧珠崔萍芳谢忠平
董莉娟 李 华 蒋蕊鞠 杨 蓉 龙润乡 白慧珠 崔萍芳 杨 婷 谢忠平
人类呼吸道合胞病毒 (hum an resp iratory virus, HRSV)是世界范围内婴幼儿病毒性下呼吸道感染最重要的病原体。从 1956年M o rris等[1]首次发现该病毒至今,尚无有效的疫苗问世。目前,国内外对HRSV的研究多集中在研制减毒活疫苗及亚单位疫苗。裂解型亚单位疫苗是直接裂解野毒株获得,其免疫原性比其他型的亚单位疫苗高。HRSV的纯度和得率是制备优质裂解疫苗的重要技术参数,而纯化方式对此两个指标产生直接影响。因此,我们对 HRSV不同纯化方法进行比较研究,为 HRSV裂解型亚单位疫苗的研制积累一些基础资料,现将结果报道如下。
材料与方法
1.材料:人二倍体细胞 KMB17细胞株,由本所检定室提供。人呼吸道合胞病毒 A2株由本所病毒免疫室提供。清洁级 ICR小鼠,雌性,18~22g,由本所小动物实验中心提供。β -丙内酯(β-p rop iono lactone,BPL)购于A lfaAesar公司;小鼠抗 RSV F蛋白单克隆抗体购于M illipo re公司;辣根酶标记山羊抗小鼠 IgG购于 KPL公司。Sepharose 4FF购于 GE公司。其他试剂皆为分析纯。超速离心机为BACKMAN L-90K型;层析柱 1.6cm×30cm。
2.方法:(1)感染性效价检测:采用微量细胞病变法,以孔内细胞病变≥50%为阳性孔,于第 7天判定结果,具体操作按参考文献进行[2]。(2)病毒的超滤浓缩:将 HRSV收获液以截留相对分子质量 100kDa的滤膜包进行 30倍超滤浓缩。(3)蔗糖密度梯度离心法纯化 HRSV:超速离心机运转至2000 r/m in时,用蠕动泵依次将 30倍 HRSV浓缩液、33%蔗糖、56%蔗糖和 0.125mo l/L PB(pH7.2)各约 500m l、540m l、750m l和 100m l注入区带转头,4℃、25000 r/m in离心 3h。离心结束后,当超速离心机转速降至 2000 r/m in时,在紫外检测仪 280nm下收集样品,每个组分约 100m l。按照文献[3,4]的方法,用 PEG-6000将所收集的病毒进行约 30倍浓缩。(4)Sepharose 4FF凝胶过滤层析纯化 HRSV:根据目的病毒的相对分子质量以 Sepharose 4FF凝胶作为层析介质,使用0.02mo l/L PBS(pH 7.4)以 1.7m l/m in流速平衡层析柱后,取30倍浓缩的 HRSV 1m l上样,再以 0.02mo l/L PBS以 1.7m l/ m in流速洗脱,在 280nm下同步紫外检测、分部收集样品[5]。(5)纯化产物的鉴定:使用W estern b lot鉴别纯化产物的特异性。蛋白经过 10%SDS-PAGE分离后,半干转印至 PDVF膜上,以 5%脱脂奶粉 37℃封闭 1h后,加一抗 (小鼠抗 HRSV F蛋白单克隆抗体 1∶200)4℃过夜、加二抗 (HRP-羊抗鼠 IgG抗体偶联物 1∶500)37℃反应 1h,DAB显色。(6)免疫原性评价:纯化病毒以 1∶4000的比例加入 38%的甲醛,于 37℃放置3天,或以1∶4000的比例加入β-丙内酯,于 2~8℃放置 7天,灭活病毒[6]。将灭活病毒加或不加 A l(OH)3制备成实验性疫苗。选取 ICR小鼠 45只,随机分为 9组,每组 5只。对照组每只腹腔注射 0.5m l生理盐水;实验组每只腹腔注射实验性疫苗 0.5m l、28天加强 1次,分别于初次免疫后 28天、加强后 7天眼球采血分离血清,检测中和抗体效价。(7)血清中和抗体效价检测:采用固定病毒稀释血清的微量中和试验法来检测血清中和抗体效价。待测血清 56℃灭活 30m in后,做 2倍系列稀释,每稀释度 50微升/孔,再加入 2000 CC ID50/m l病毒 50微升 /孔,混匀,37℃中和 1h后,加入 1×106/m l浓度的KMB17细胞 100微升/孔。置 37℃、4%CO2孵箱中培养。同时设置病毒对照、细胞对照和阴性血清对照。于第 7天判定结果。以抗体效价≥1∶4为阳性。(8)统计分析:使用 SPSS12.0软件进行数据的统计分析。
结 果
1.蔗糖密度梯度离心纯化 HRSV:(1)感染性效价和蛋白含量:所收集组分的感染性效价为 2.50~3.75 lgCC ID50/m l,各组分间感染性效价差异不大。蛋白含量以 3号组分的 86.10m g/m l最高,从 8号组分开始逐渐趋平(图 1)。(2)纯化产物的鉴定:经 SDS -PAGE还原电泳,仅 7~11号 5个组分都在 60~70kDa间可见一主要的蛋白带,与 HRSV F蛋白63kDa相对分子质量接近(图 2),W estern blot证实该条带具有 HRSV特异性(图 3)。上述 5个组分中,以7号和 8号组分的目的蛋白病毒含量较高,这与图 1所显示的病毒效价有一个小峰相吻合。

2.Sepherose 4FF凝胶过滤层析纯化 HRSV: (1)HRSV Sepherose 4FF凝胶过滤层析图:HRSV经过 Sepherose 4FF凝胶过滤层析呈现 2个峰。在约15m in时出现第 1峰 (小峰);在约 30m in时出现第 2峰(大峰)。第 2峰为目的病毒峰 (图 4)。(2)感染性效价及蛋白含量:凝胶过滤层析收集样品中,4~8号样品(第 2峰)均含有病毒,以 5号样品的感染性效价最高,为 4.50 lgCC ID50/m l;蛋白含量也以 5号样品的 4.65m g/m l最高,6、7号组分次之 (图 5)。(3)纯化产物的鉴定:4~8号样品 (第 2峰)都在 60~70kDa间可见一主要的条带,并且条带的粗细与蛋白含量检测结果一致(图 6)。 3.免疫原性:选取蔗糖密度梯度离心所得混合样及 Sepharose 4FF凝胶过滤层析所得蛋白含量最高的


图 6 Sepharose 4FF凝胶过滤层析纯化样品的电泳图
5号样品进行免疫原性评价(表 1)。(1)纯化方式对免疫效果的影响:蔗/甲醛/A l-/1组和层/甲醛/A l
-/1组的中和抗体 GM T和抗体阳性率均相同,分别为1∶4.00和 40%;蔗/甲醛/A l+/1组和层/甲醛/A l
+/1组的抗体阳性率相同,均为 60%,而中和抗体
GM T凝胶过滤层析法纯化样是蔗糖密度梯度离心纯化样的 1.3倍,但差异无显著的统计学意义 (P= 0.423)。(2)铝佐剂对免疫效果的影响:含铝佐剂组的抗体阳性率和中和抗体 GM T都比不含铝组高,尤以含铝佐剂 2针免疫组最高,但与其他组相比,差异
均无统计学意义 (P=0.444~1.000和 P=0.423~
0.815)。(3)免疫针数对免疫效果的影响:含铝和不含铝 2针免疫组的抗体阳性率是 1针免疫组的 1.7
倍和 2.5倍,差异均无显著统计学意义(P=0.444和P=1.000);中和抗体 GM T分别是 1针免疫组的 3.5倍和 2.5倍,差异均无显著的统计学意义 (P=0.075和 P=0.374)。(4)病毒灭活试剂对免疫效果的影响:层/甲/A l-/1组和层/BPL/A l-/1组的抗体阳性率和中和抗体 GM T均相同。层/BPL/A l+/1组的抗体阳性率和中和抗体 GM T均比层/甲醛/A l+/1组高(P>0.05)。
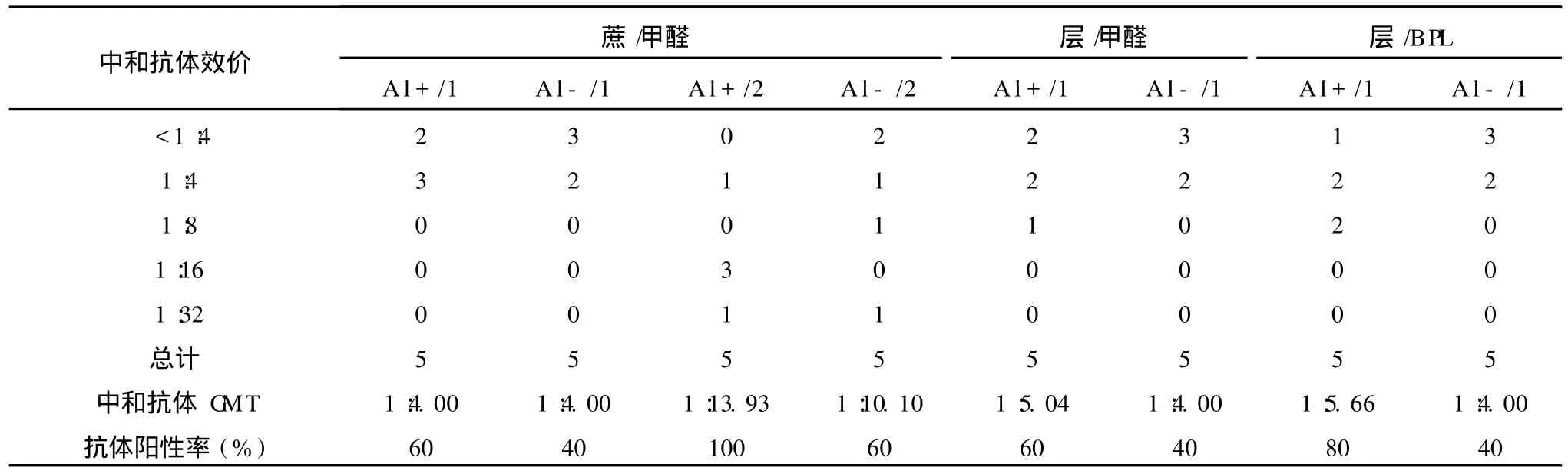
表 1 小鼠免疫后中和抗体水平
讨 论
本文对蔗糖密度梯度离心和 Sepherose 4FF凝胶过滤层析 2种方法纯化 HRSV的效果和效率作了比较,结果表明上述 2种方法均能成功获得目的病毒。
实验中,HRSV经 30倍浓缩,浓缩前后感染性效价相差不大(理论上应增加约 1.5 lgCC ID50/m l),分析认为与 HRSV在常温条件下极不稳定有关。在 22℃条件下,HRSV的感染性效价每天下降 0.2~1.0 lgCC ID50/m l[2]。HRSV经蔗糖密度梯度离心,各收集组分的感染性效价差异不大。主要原因是组分中含有高度黏稠的蔗糖,其高渗能力会对细胞产生毒性,同时也会导致极不稳定的 HRSV丧失感染力。经SDS-PAGE还原电泳,有 5个组分都在 60~70kDa间可见一主要条带,经检测证实为 HRSV F蛋白,同时含有少量的BSA。上述条带与W estern b lo t显示的40~62kDa间的条带大小不一致。其原因可能是:①W estern b lo t上样量增加后,造成 60~70kDa间的条带下移至 50kDa左右。蔗糖密度梯度离心收集的8号样品在 SDS-PAGE还原电泳时上样量 5μl,与图3中 2泳道相比,上样量增加后,60~70kDa间的条带下移至 50kDa左右,且与W estern b lot(图 4)5μl上样量呈现出的条带大小相近、形状相似。所以上样量增加造成条带下移的可能性较大;②HRSV F蛋白在β-巯基乙醇的作用下产生 47~52kDa的 F1亚基,我们使用的一抗能与 F蛋白的 F1a表位特异性结合[7~9]。从蛋白含量曲线上可以看出,这 5个组分的蛋白含量远低于 2~6号组分,后者主要是一些杂蛋白。HRSV经 Sepherose 4FF凝胶过滤层析呈现 2个峰。第 1峰无目的产物;第 2峰的 3个样品均含有目的病毒,SDS-PAGE还原电泳显示在 60~70kDa间可见一主要的条带,但W estern blot不能证实该条带具有 HRSV特异性。分析可能是在凝胶过滤层析时, 1m l上样量过低 (仅为蔗糖密度梯度离心上样体积的1/500),经柱层析纯化后,病毒又被稀释,未经浓缩的样品病毒含量低,导致W estern blot无法鉴别。将 2种方法制备的纯化样品免疫 ICR小鼠,抗体阳转率相同,中和抗体 GM T凝胶过滤层析法纯化样是蔗糖密度梯度离心纯化样的 1.7倍。加铝佐剂有助于提高抗体阳转率,加铝 2针免疫组的中和抗体 GM T最高。所以使用 HRSV免疫小鼠时,加铝佐剂、2针免疫十分必要。各免疫组间均无显著的统计学差异,主要与样本数较少有关。
蔗糖密度梯度离心法和凝胶过滤层析法是目前常用于疫苗生产的病毒纯化方法。对于极不稳定的HRSV,蔗糖密度梯度离心法操作较为繁琐,且比较费时,加上在蔗糖介质中离心会对病毒颗粒造成损伤,易导致病毒丧失感染性[11]。另外,由于蔗糖的高度黏稠和高渗透性会对细胞产生毒性,所以在对样品进行感染性效价分析前必须将其除去。凝胶过滤层析法设备简单,操作方便,实验周期短,有利于保持HRSV的稳定,并且仅用蔗糖密度梯度离心 1/500的上样体积就能达到与之同样的免疫效果。综上所述,我们认为选用凝胶过滤层析法纯化 HRSV比蔗糖密度梯度离心法更好。后续试验中还需对凝胶过滤层析条件进行优化,使用无血清培养基增殖病毒、增加病毒浓缩倍数以及对纯化所得病毒样品进行浓缩是十分必要的。
1 金奇,毕胜利,陈继明.医学分子病毒学.北京:科学出版社, 2001:461-479
2 蒋蕊鞠,李华,龙润乡,等.人呼吸道合胞病毒的稳定性[J].中国生物制品学杂志,2009,22(4):363-365
3 詹曦菁,秦晓勇,刘丽英,等.麻疹病毒的纯化及其在麻疹 IgG E IA诊断试剂中的应用[J].中国卫生检验杂志,2007,17(4): 618-621
4 俞建昆,谢忠平,董承红,等.PEG沉淀 HAV的最佳条件[J].中国生物制品学杂志,1997,10(1):52
5 黄祯祥,洪涛,刘崇柏.医学病毒学基础及实验技术.北京:科学出版社,1990:717-724
6 国家药典委员会.中国药典(三部)[S].北京:化学工业出版社, 2005:80
7 Gruber C.,Levine S.Resp iratory syncytial virus polypep tides.Ⅲ.The envelope-associated p roteins.[J].JGen V irol,1983,64(4):825-832
8 Huang Y.T.,Co llins P.L.,W ertz G.W.Characterization of the 10 p roteinsof hum an resp iratory syncytial virus:identification of a fourth envelope-associated p rotein.[J].V irusRes,1985,2(2):157-173
9 Routledge E.G.,W illcocksM.M.,Sam son A.C.,et al.The purification of four resp iratory syncytial virusp roteins and their evaluation as p rotective agentsagainstexperimental infection in BALB/cm ice.[J]. JGen V irol,1988,69(2):293-303
