超临界CO2萃取北方地区早园竹叶中总黄酮的工艺优化
2011-03-30张珊珊朱文娴赵晓红刘绍鹏
张珊珊,朱文娴,赵晓红,刘绍鹏
(1.徐州空军学院,江苏 徐州 221000;2.北京联合大学应用文理学院,北京 100083;3.中国矿业大学 煤炭加工与高效洁净利用教育部重点实验室,江苏 徐州 221008)
超临界CO2萃取北方地区早园竹叶中总黄酮的工艺优化
张珊珊1,朱文娴1,赵晓红2,刘绍鹏3
(1.徐州空军学院,江苏 徐州 221000;2.北京联合大学应用文理学院,北京 100083;3.中国矿业大学 煤炭加工与高效洁净利用教育部重点实验室,江苏 徐州 221008)
研究超临界CO2流体萃取法提取北方地区早园竹叶中黄酮的工艺。通过单因素试验确定影响总黄酮得率的主要因素及其最佳水平范围,并通过正交试验确定最佳萃取条件。结果表明:萃取温度36℃、乙醇体积分数50%、萃取压强35MPa、夹带比9%、萃取时间40min,在此条件下总黄酮得率可达到23.24mg/g。可以运用超临界CO2流体萃取技术对竹叶黄酮进行提取,且提取效率较高。
竹叶;超临界CO2流体萃取;总黄酮;提取
竹子是禾本科多年生常绿植物,是当今世界上最具有使用价值的植物之一,全世界约有70多属,1200多种,竹林面积约20000万hm2(约3亿亩)[1]。近年来的研究表明,竹叶中含有大量的黄酮、酚酸、葱醒、多糖、香豆素类、特种氮基酸、芳香成分和锰、锌、硒等微量元素[2]。已有的研究表明,竹叶黄酮的药理作用与银杏黄酮相似[2]。对竹叶黄酮主要组成成分和主要药理活性研究已有报道,结果表明其具有明显的抗脂质过氧化、清除羟自由基、调节血脂及明显的抑菌作用[3-4]。竹叶黄酮制剂以C-糖苷黄酮为主,具有结构稳定、亲水性强、能深入病灶部位等特点,工艺品质优良,适宜于多种药物剂型的开发[5]。现对竹叶黄酮的提取方法比较多样[6-9]但利用超临界流体萃取技术对黄酮提取的报道较少。
本实验采用超临界CO2流体萃取技术萃取竹叶黄酮,找出最优的提取条件,为对北方地区竹叶资源的利用及竹叶黄酮工业化生产工艺的建立提供一定参考。
1 材料与方法
1.1 材料与试剂
早园竹,2006年11月采摘于北京市鹰山森林公园。
芦丁标准品 中国药品生物制品检定所;无水乙醇、硝酸铝、氢氧化钠 北京化工厂;亚硝酸钠 上海试剂一厂。
1.2 仪器与设备
UV-2450紫外分光光度计 日本岛津公司;超临界流体萃取设备 日本Jasco公司;FW-100万用植物样品粉碎机 天津泰斯特仪器有限公司;DHG-9140A型电热恒温鼓风干燥箱 上海一恒科技有限公司;5804R冷冻离心机 德国Eppendonf公司;LA612型超纯水系统 美国Pall公司;KQ-500DE型数控超声波清洗器 昆山市超声仪器有限公司;电子天平 北京赛多利斯天平有限公司;加热磁力搅拌器 德国IKA公司。
1.3 方法
1.3.1 芦丁标准液的配制[10]
准确称取芦丁标准品0.0273g(含量91.7%)于30%乙醇溶液溶解,定容至25mL准确吸取标准液0、0.4、0.8、1.6、2.4、3.2、4mL分别置于10mL容量瓶中,加5% NaNO2溶液0.3mL摇匀,放置6min,加10% Al(NO3)3溶液0.3mL摇匀,放置6min,加入4% NaOH溶液4mL,再用30%乙醇定容并摇匀,放置10min。置比色皿中在波长400~600nm之间测定吸收光谱,确定最大吸收波长为510nm,在510nm条件下测定吸光度。
1.3.2 竹叶总黄酮的萃取
萃取竹叶黄酮工艺:竹叶→晒干→80目过筛→超声辅助提取→过滤→定容→定量分析。
采摘的竹叶自然风干5d,分别用粉碎机粉碎,80目过筛后分装于广口瓶,于烘箱55℃烘10h。待提取。
1.3.3 提取样液测定与黄酮类物质提取量的计算
将提取液无损转入10、25、50、100mL容量瓶(以提取液的量为标准),并以相应的浸提溶剂定容,然后移取0.50mL分别用上述芦丁标准液显色剂加入方法加入试剂,于波长510nm处测定吸光度。由回归方程计算出测定样品液黄酮质量浓度,经计算得出提取竹叶干样所得黄酮类物质的量。根据下式计算总黄酮得率。

1.3.4 最佳提取条件的确定
采用正交试验来确定竹叶总黄酮类物质最佳提取条件,采用L16(45)正交试验表,分别以萃取温度、萃取压强、萃取时间、乙醇体积分数和夹带剂在流体中比例(乙醇流速:CO2流速)这5个主要因素进行正交试验。各设置4水平试验,以确定竹叶总黄酮物质的最佳提取条件。
2 结果与分析
2.1 工作曲线与线性回归方程
对1.3.1节配制的芦丁标样溶液的不同质量浓度在波长510nm处测定吸光度,得标准曲线方程:Y=1.1442X+0.0237,R2=0.9989。
2.2 影响总黄酮得率的单因素条件的确定
2.2.1 压强对总黄酮得率的影响
准确称取0.3g竹粉放于萃取釜中,分别在16、20、24、28、32、36MPa的萃取压强下,其他参数为固定值进行萃取,即:萃取温度40℃、夹带剂为无水乙醇、夹带比3%(乙醇流速:CO2流速=0.15mL/min:5mL/ min)、萃取时间20min+5min(剂萃取时间20min后,关闭夹带剂,继续用CO2萃取5min,使萃取釜中前期提取物质全部进入收集管中);定容,冷冻干燥后,复溶,按1.3.1节进行显色处理;测定吸光度,计算竹叶总黄酮得率,并绘制提取率与萃取压强的关系图,见图1。
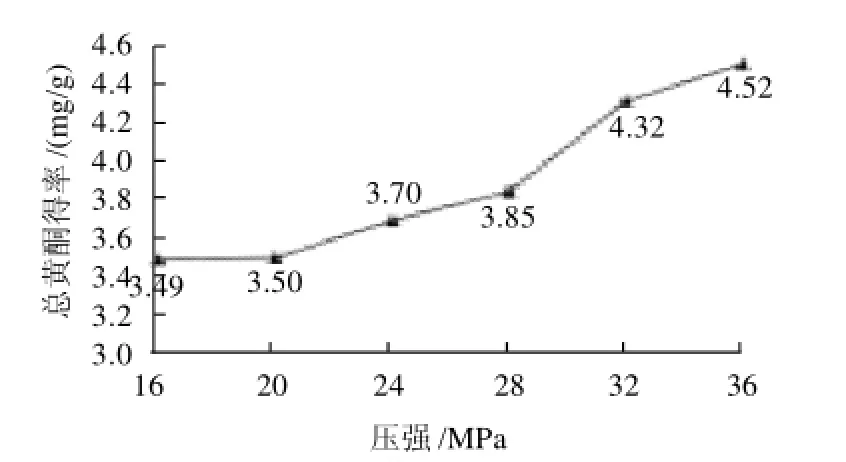
图1 提取压强对竹叶总黄酮得率的影响Fig.1 Effect of pressure on extraction rate of total flavonoids
根据图1可见,黄酮类物质随压强的升高,总黄酮得率也相应提高,在压强32MPa时最高总黄酮得率为4.52mg/g。这是由于随压强的增大,超临界流体的密度提高,对竹叶黄酮的夹带能力增大,从而使总黄酮得率升高。除压强条件在16~20MPa之间未出现显著性差异,其他条件之间均出现显著性差异(P<0.05)。
2.2.2 温度对总黄酮得率的影响

图2 提取温度对竹叶总黄酮得率的影响Fig.2 Effect of temperature on extraction rate of total flavonoids
准确称取0.3g竹粉放于萃取釜中,分别在32、36、40、44、48℃萃取温度下,其他参数为固定值进行萃取,即萃取压强28MPa、夹带剂为无水乙醇、夹带比3%;萃取时间20min+5min;定容,冷冻干燥后,复溶,按1.3.1节进行显色处理;测定吸光度,计算竹叶总黄酮得率。以总黄酮得率为纵坐标、温度为横坐标,绘制提取率与萃取温度的关系图,见图2。
由图2可见,竹叶黄酮在CO2中的溶解度随着温度的增加而降低,当萃取温度从36℃上升至48℃时,萃取物中的竹叶黄酮的提取率随温度的上升而呈下降趋势在36℃时,最高总黄酮得率为7.48mg/g。五种条件之间均出现显著性差异(P<0.05)。在相同压强下,由于温度的上升使得CO2流体的密度降低,故使其对竹叶黄酮的夹带能力下降。
2.2.3 夹带剂在流体中比例对黄酮得率的影响
准确称取0.3g竹粉放于萃取釜中,分别以1%、3%、5%、7%、9%的夹带剂比例(乙醇流速: CO2流速),其他参数为固定值进行萃取,即:萃取压强28MPa、萃取温度40℃、夹带剂为无水乙醇、萃取时间20min+5min;定容,冷冻干燥后,复溶,按1.3.1节进行显色处理;测定吸光度,计算竹叶总黄酮得率,以总黄酮得率为纵坐标、夹带此夹带剂在流体中比例为横坐标,绘制提取率与萃取夹带比的关系图,见图3。
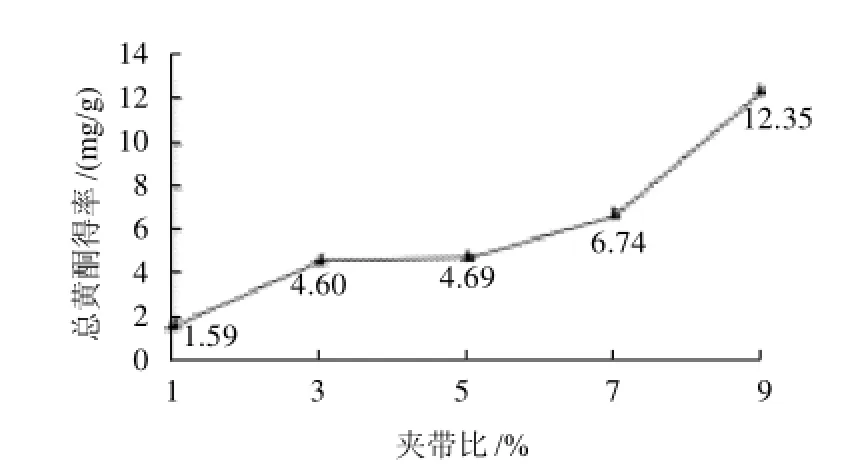
图3 夹带比对竹叶总黄酮得率的影响Fig.3 Effect of entrainer amount on extraction rate of total flavonoids
由图3可见,夹带比由1%升至9%时,黄酮类物质随夹带剂流量的升高,总黄酮得率也增高,在夹带比为9%时最高总黄酮得率为12.35mg/g。除夹带比为3%~5%之间没有出现显著性差异,其他条件之间均出现显著性差异(P<0.05)由于竹叶黄酮是具有极性的物质,所以有机溶剂作为夹带剂的加入更有利于提取。
2.2.4 时间对黄酮得率的影响
准确称取0.3g竹粉放于萃取釜中,分别提取10、20、30、40、50min,其他参数为固定值进行萃取,即:萃取压强28MPa、萃取温度40℃、夹带剂为无水乙醇、夹带比3%;定容,冷冻干燥后,复溶,按1.3.1节进行显色处理;测定吸光度,计算竹叶总黄酮得率,以总黄酮得率为纵坐标、时间为横坐标。绘制总黄酮得率与萃取时间的关系图,见图4。

图4 提取时间对竹叶总黄酮得率的影响Fig.4 Effect of extraction time on extraction rate of total flavonoids
由图4可见,随着时间的延长,总黄酮得率也增高,在提取50min时最高提取效率5.32mg/g。6种条件之间均出现显著性差异(P<0.05)。
2.2.5 夹带剂的乙醇体积分数对提取率的影响
取竹粉0.3g放入萃取釜中,分别以0、10%、20%、30%、40%、50%、60%、70%、80%、90%、100%体积分数乙醇溶液作为夹带剂,其他参数为固定值进行萃取,即:萃取温度40℃、萃取压强28MPa、夹带比3%、萃取时间20min+5min;定容,冷冻干燥后,复溶,按1.3.1节进行显色处理,测定吸光度,计算竹叶总黄酮得率。以总黄酮得率为纵坐标、夹带剂乙醇体积分数为横坐标,绘制总黄酮得率与夹带剂乙醇体积分数的关系图,见图5。

图5 夹带剂乙醇体积分数对竹叶总黄酮得率的影响Fig.5 Effect of ethanol concentration on extraction rate of total flavonoids
由图5可见,不同体积分数乙醇对黄酮类物质的夹带能力是有所区别的,乙醇体积分数由10%升至50%时,总黄酮得率随乙醇体积分数的增加而增加,当乙醇体积分数达到50%时,随着乙醇体积分数的增加,总黄酮得率反而下降。在50%乙醇溶液作为夹带剂时,最高总黄酮得率为11.03mg/g。乙醇体积分数0和10%、20%和30%、60%和70%条件之间无统计学意义(P>0.05),其他条件之间均出现显著性差异(P<0.05)。
2.3 超临界CO2流体萃取最佳提取条件的确定
通过单因素试验确定影响总黄酮得率的主要因素及其最佳水平范围,选用萃取温度、萃取压强、萃取时间、乙醇体积分数和夹带比(乙醇流速: CO2流速)这5个主要因素进行正交试验,以全面研究这5因素4水平的交叉作用对竹叶总黄酮得率的影响。各因素水平如表1所示。选用正交试验表进行试验设计,以竹叶总黄酮得率为试验指标,通过对结果的分析确立最佳提取条件。准确称取一定量备好的新生竹粉、将其放入超临界CO2萃取设备的萃取釜中,调节萃取温度、萃取压强、萃取时间、夹带剂、夹带比(夹带剂流速: CO2流速)等参数条件萃取竹叶黄酮,萃取液定容,测其吸光度,计算总黄酮得率。
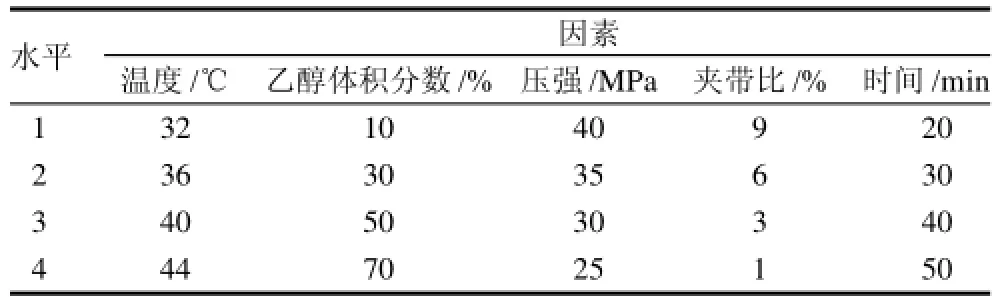
表1 最佳提取条件正交试验因素水平表Table 1 Factors and levels in orthogonal array design
综上所述,选用萃取温度、萃取压强、萃取时间、乙醇体积分数和夹带比(乙醇流速:CO2流速)这5个主要因素进行正交试验。选用正交试验表进行试验设计,试验水平由单因素试验结果确定范围,以竹叶总黄酮得率为指标。试验结果及极差分析见表2。
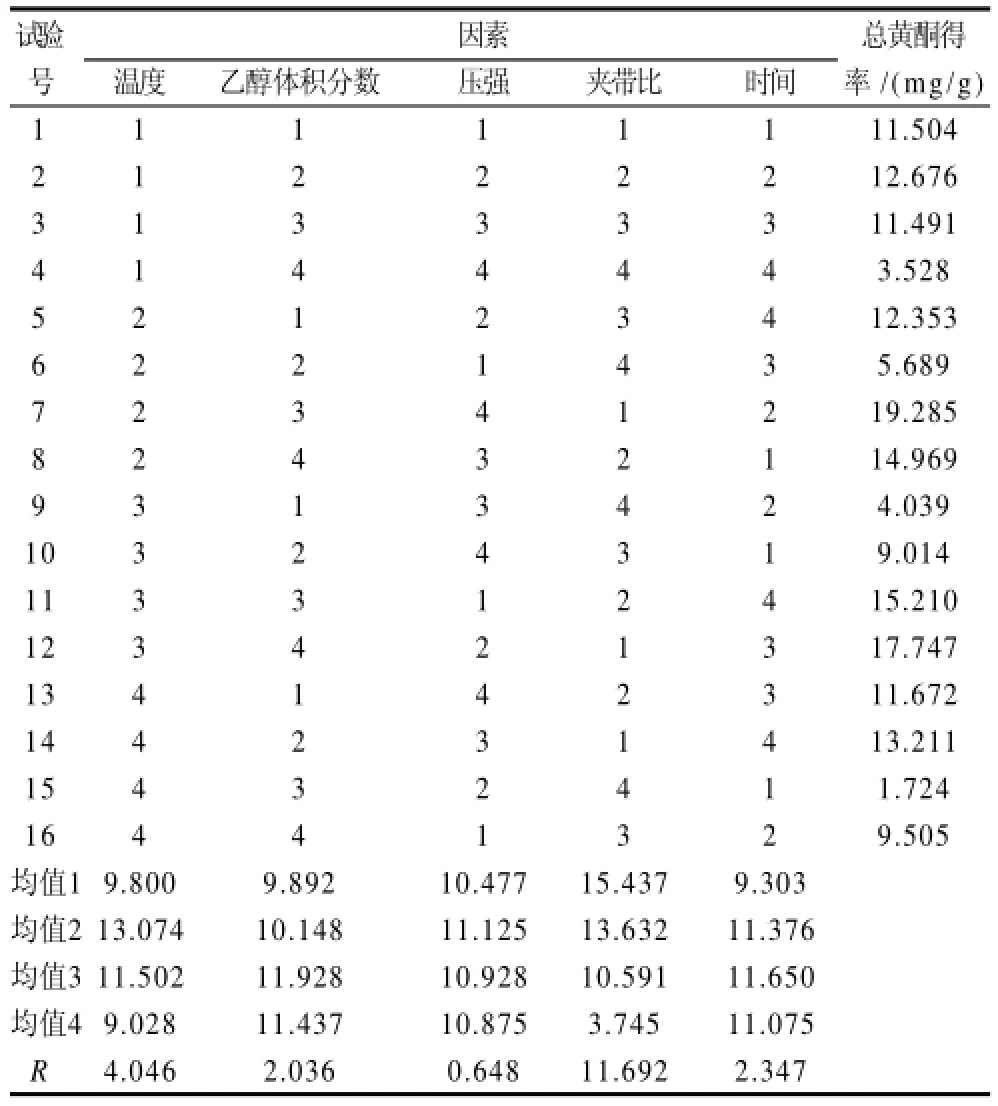
表2 早园竹叶总黄酮提取工艺优化正交试验设计及结果Table 2 Orthogonal array design matrix and results

表3 各因素方差分析表Table 3 Variance analysis of orthogonal array design experimental results
由表2极差分析和表3方差分析可以看出各因素对总黄酮得率影响的主次顺序为D>A>E>B>C,即夹带比>乙醇体积分数>萃取压强>萃取温度>萃取时间。5种因素对总黄酮得率的影响趋势与单因素试验结果所示趋势相同。其中夹带比、乙醇体积分数、萃取温度、萃取时间对试验结果影响具有显著性差异(P<0.05),萃取压强对试验结果影响不具有统计学意义(P>0.05)。
确定最佳萃取条件为A2B3C2D1E3,即萃取温度36℃、乙醇体积分数50%、萃取压强35MPa、夹带比9%、萃取时间40min。
2.4 验证实验
将正交试验得到的最佳条件进行验证,在该条件下重复萃取3次实验,计算总黄酮得率。
在上述样品中,分别加入0.4 mL芦丁标准品(0.5mg/mL),按1.3.1节溶液制备方法,分别测定吸光度,计算回收率。结果见表4。

表4 最佳提取率及加标回收率Table 4 Optimal extraction rate of total flavonoids and recovery rates in spiked samples
从表4可以看出,该方法的总黄酮平均得率为23.24mg/g,比正交表中最佳总黄酮得率(19.29mg/g)高20.48%。平均回收率在98.56%,说明本实验使用的分析方法准确度较高。
3 讨 论
文献[10]中报道不同竹叶总黄酮含量在1.18%~2.02%之间,而本实验中提取效率经换算约为2.32%。其原因可能是超临界CO2流体萃取技术有利于黄酮物质的溶出;竹子源产地为中国南方,为了适应北方寒冷的气候,需产生较多生物活性物质对抗寒冷[11]。由于目前北方地区竹叶中黄酮含量还没有文献记载,推测试验原料的采集时间(冬天)和竹子生长地区对竹叶中黄酮类物质的含量有较大影响。接下来需要进行同品种的竹叶在不同季节、不同生长区的竹叶黄酮含量比较实验研究以论证推测。
采用有机试剂从植物组织中提取黄酮物质的方法已经成熟。该方法的应用对象广泛,而且具有良好的回收率,但应用于商业目的时有一些明显的缺点,如成本较高、萃取试剂的毒性所引起的产品安全性问题、提取时间长等。超临界流体萃取技术与传统的溶剂萃取相比具有一些明显的优点,如操作成本低、萃取效率高、操作简单和无毒无污染等。本研究探讨利用超临界流体萃取技术从竹叶中制备黄酮。结果表明,利用超临界CO2流体萃取技术从竹叶中制备黄酮类物质是完全可行的。
[1]张英. 天然功能性竹叶提取物: 竹叶黄酮[J]. 中国食品添加剂, 2002 (3): 54-58.
[2]陆志科, 谢碧霞. 竹叶活性成分分析及其提取物抗菌效果[J]. 中南林学院学报, 2004(4): 70-74.
[3]陆柏益, 张英, 吴晓琴. 竹叶黄酮的抗氧化性及其心脑血管药理活性研究进展[J]. 林产化学与工业, 2005(3): 120-124.
[4]陆志科, 谢碧霞. 竹叶活性成分分析及其提取物抗菌效果[J]. 中南林学院学报, 2004, 24(4): 70-73.
[5]李瑶, 齐晓丽, 孟祥颖, 等. 竹叶中黄酮提取纯化工艺研究[J]. 东北师大学报: 自然科学版, 2006, 38(1): 91-94.
[6]许刚, 张虹. 竹叶中黄酮提取方法的研究[J]. 分析化学, 2000, 28(7): 857-859.
[7]沈海涛. 蜂胶提取工艺和抗氧化活性研究[D]. 杭州: 浙江大学, 2002. [8]刘志敏, 赵锁奇. 超临界流体色谱法测定银杏叶提取物中的黄酮类化合物[J]. 分析化学, 1999, 27(2): 214-216.
[9]胡敏, 甘璐, 姜发堂, 等. 银杏叶中黄酮类化合物最佳提取工艺研究[J]. 食品工业科技, 1997(5): 49-51.
[10]冯涛, 曹东旭, 吕晓玲. 竹叶总黄酮的测定[J]. 中国食品添加剂, 2002 (6): 85-88.
[11]唐传核. 植物生物活性物质[M]. 化学工业, 2005: 171-176.
Process Optimization for Supercritical Carbon Dioxide Extraction of Total Flavonoids from Praecox Leaves in Northern Areas
ZHANG Shan-shan1,ZHU Wen-xian1,ZHAO Xiao-hong2,LIU Shao-peng3
(1. Xuzhou Air Force College, Xuzhou 221000, China;2. College of Art and Science, Beijing Union University, Beijing 100083;3. Key Laboratory of Coal Processing and Efficient Utilization, China University of Mining and Technology, Xuzhou 221008, China)
Supercritical CO2fluid extraction technique was explored to extract total flavonoids from praecox leaves in northern areas of China. Single-factor design was used to determine main variables that influence extraction rate of total flavonoids. The optimal extraction conditions were achieved to be extraction temperature of 36 ℃, ethanol concentration of 50%, extraction pressure of 35 MPa, entrainer (absolute ethanol) amount of 1:15, entrainer amount 9% and extraction time of 40 min. Under the optimal extraction conditions, the extraction rate of total flavonoids was 23.24 mg/g. The supercritical fluid CO2extraction can be used for the extraction of total flavonoids from praecox leaves with high extraction efficiency.
praecox leaves;supercritical fluid CO2 extraction;total flavonoids;extraction
O623.54
A
1002-6630(2011)06-0142-05
2010-05-17
张珊珊(1982—),女,助教,硕士,研究方向为食品安全与检测。E-mail:zss_1982@126.com
