连续流Biohydrogenbacterium R3 sp.nov.菌株糖蜜废水发酵产氢能力分析1)
2011-03-29白羽蔡体久韩伟李永峰刘海亮
白羽 蔡体久 韩伟 李永峰 刘海亮
(东北林业大学,哈尔滨,150040)
由于温室效应等环境问题以及化石能源的日益短缺,世界范围内都在寻求无污染、可再生的替代能源[1]。氢能具有高热量(122 kJ/g)和无污染等优点而被认为是未来极具发展前景的可替代能源[2]。发酵法生物制氢技术是一种产生清洁燃料与废物处理相结合的新技术,具有能源回收和废物处理的双重功效[3-4],是解决未来能源问题的重要途径[5]。提高产氢效率以及降低制氢成本是生物制氢工艺产业化发展的关键。糖蜜是制糖业的主要副产品之一,其含有丰富的碳水化合物和氮磷物质可被微生物所利用,并且糖蜜年产量大(达到1.6×106kg)[6],因此发展以糖蜜为原料的生物制氢产业具有广阔的应用前景[7]。然而糖蜜的组成极其复杂,不仅含有对微生物生长有益的成分,同时存在多种微生物难以利用和转化的成分,并对微生物的生长代谢产生抑制作用[8]。目前在国内外报道的糖蜜生物制氢研究中,多数以混合菌种为接种物(如活性污泥等)进行糖蜜产氢研究[9],而利用纯菌糖蜜发酵制氢的研究鲜见报道。李永峰等[10]从以糖蜜为底物的生物制氢反应器中分离到产氢新菌Biohydrogenbacterium R3 sp.nov.,属于目前报道的产氢菌种产氢能力比较高的菌株之一。本文以高效产氢菌R3为研究对象,以糖蜜废水为底物,研究连续流R3菌株糖蜜废水发酵产氢能力。
1 材料与方法
1.1 试验装置
试验采用连续流搅拌槽式反应器(CSTR),为反应区与沉淀区一体化结构,模型反应器总容积18.8 L,有效容积9.6 L。反应器内部有三相分离器,使气、液、固三相很好地分离,更有利于气体的传质与释放。采用计量泵将原水从进水箱泵入反应器内,通过计量泵的流量以保证系统进水恒定。本试验通过调节进水流量控制水力停留时间为6 h。整个反应器采用外缠电热丝加热方式,将温度控制在(35±1)℃,实验系统见图1。
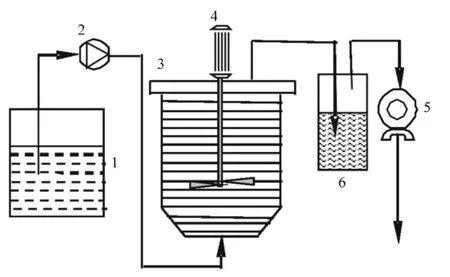
图1 连续流生物制氢系统
1.2 菌种来源和厌氧培养方法
产氢新菌Biohydrogenbacterium R3 sp.nov.菌种鉴定的国际DNA数据库登记号为AF363375,从生物制氢活性污泥中分离得到。其透射电镜照片如图2所示,R3为革兰氏阳性菌,不形成芽孢,杆菌;大小为(0.3~0.5)μm×(1.5~2.0)μm;周生鞭毛,且鞭毛较长;形成的菌落呈现白色或乳白色,20~30 d可以长成至直径为1.0~2.5 mm,菌落边缘整齐,圆形,光滑,不透明;类脂粒4~6个,异染粒2~3个;该菌为严格厌氧菌。细菌培养基的制备和全部实验操作采用改进的Hungate厌氧技术,以高纯氮气为气相,35℃常规培养。
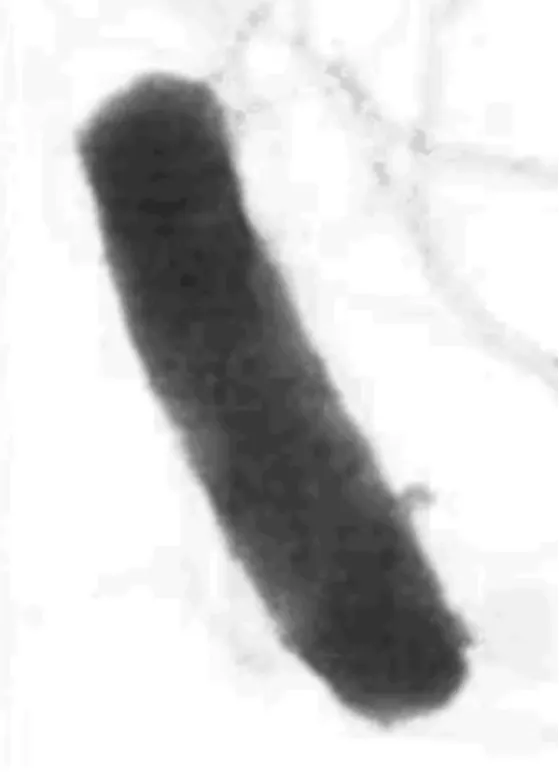
图2 菌株R3的透射电镜照片(20 000×)
1.3 试验废水
试验废水采用的是废糖蜜加水稀释而成,糖蜜废水组成成分见表1,配置时投加一定量的有机氮磷,使得底物中的m(COD)∶m(N)∶m(P)保持在(200~500)∶5∶1左右,以保证R3菌株在生长过程中对氮、磷的需求。

表1 糖蜜废水成分
1.4 培养基
基本培养基:葡萄糖20 g·L-1;胰蛋白胨4 g·L-1;牛肉膏2 g·L-1;酵母汁1 g·L-1;NaCl为4 g·L-1;K2HPO4为1.5 g·L-1;L-半胱氨酸0.5 g·L-1;发酵液10 mL;维生素液(钴铵素0.01 g·L-1;抗坏血酸0.025 g·L-1;核黄素0.025 g·L-1;柠檬酸0.02 g·L-1;吡多醛0.05 g·L-1;叶酸0.01 g·L-1;对氨基苯甲酸0.01 g·L-1;肌酸0.025 g·L-1)10 mL;微量元素液(MnSO4·7H2O为0.01 g·L-1;ZnSO4·7H2O为0.05 g·L-1;H3BO3为0.01 g·L-1;N(CH2COOH)3为4.5 g·L-1;CaCl2·2H2O为0.01 g·L-1;Na2MoO4为0.01 g·L-1;CoCl2·6H2O为0.2 g·L-1;AlK(SO4)2为0.01 g·L-1)10 mL;刃天青(0.2%),1~2 mL;pH为6.0~6.4。
1.5 分析方法
发酵气体产物及组分采用SC-II型气相色谱测定。热导检测器(TCD),不锈钢色谱填充柱长2.0 m;担体Porapak Q,50~80目。采用氮气为载气,流速为30 mL/min。
液相末端发酵产物组分及质量分数采用GC-122型气相色谱测定。氢火焰检测器,不锈钢色谱填充柱长2.0 m;担体为GDX-103型,60~80目。柱温、气化室和检测室温度分别为190、220、220℃。氮气作为载气,流速为30 mL/min。
采用国家标准方法测定COD[11],采用PHS-25型酸度计测量pH和氧化还原电位(ORP),采用LML-1型湿式气体流量计计量产气量。
2 结果与分析
2.1 底物浓度对产氢能力的影响
产气(氢)速率是衡量生物制氢反应器启动效能的一个重要指标。图2为底物质量浓度与系统产气和产氢量的变化。从试验结果中可以发现,当进水COD质量浓度在2 600~4 440 mg/L范围内变化时,进水COD质量浓度的变化对纯培养R3产氢系统的产气量和产氢量有明显的影响,产气量和产氢量随着进水COD质量浓度的下降而降低;然而,当进水COD质量浓度提高时,产气量和产氢量也有相应的增加。CSTR发酵产氢系统的最大产气量和产氢量分别为6.08 L和3 L。
2.2 pH值与COD去除率的变化
在废水进入反应系统后,废水中的物质所发生的一系列生理生化反应以及液体的稀释作用,将迅速改变系统内的pH值。如含有大量溶解性碳水化合物(糖、淀粉等)的废水进入反应器后,碳水化合物发酵产生的有机酸(特别是乙酸)的积累,将使系统内pH值下降。pH的变化不仅直接影响参与新陈代谢过程的酶活性,而且不同种类的细菌在不同pH生境条件下,生长繁殖的速率不同,发酵代谢产物的种类和数量也存在差异。图4为CSTR反应器进出水pH值与COD去除率的变化情况。在反应器运行过程中,进水pH值的波动范围很大,在3.46~6.45之间,而进水pH值与COD去除率呈现相同的变化趋势,COD去除率在4.69%~35.86%之间波动。可见高效产氢菌株R3对进水pH值的变化十分敏感,较低的pH值导致微生物的活性下降,正常的生理代谢受到抑制。
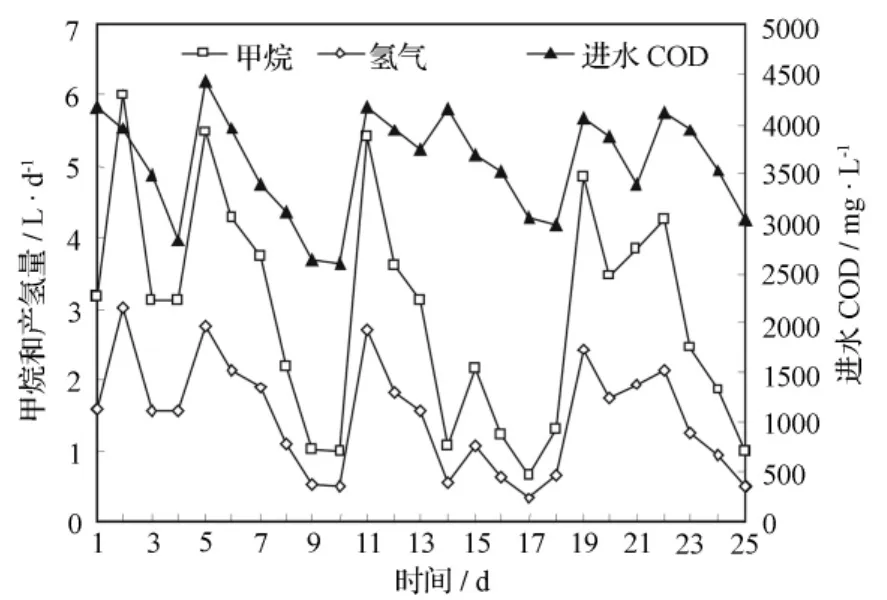
图3 底物质量浓度对产氢能力的影响
2.3 氧化还原电位的变化
氧化还原电位(ORP)对微生物生长生理、生化代谢均有明显影响。生物体细胞内的各种生物化学反应,都是在特定的氧化还原电位范围内发生的,超出特定的范围,则反应不能发生,或者改变反应途径。生境中的氧化还原电位可受多种因素影响。它与氧分压有关,氧分压高,氧化还原电位高;氧分压低,氧化还原电位低。微生物对有机物的氧化及代谢过程中所产生的氢、硫化氢等还原性物质,也会使环境中的ORP降低。

图4 进出水pH值与COD去除率的变化情况
在产氢发酵过程中,较低的氧化还原电位是产氢发酵微生物生长发育的必要条件。这是因为厌氧微生物的生存要求较低的氧化还原电位环境的原因,使它们的一些脱氢酶系包括辅酶I、铁氧还蛋白和黄素蛋白等,要求低的氧化还原电位环境才能保持活性。CSTR反应器运行过程中ORP的变化情况如图5所示。ORP基本上保持在较低水平(-445~-420 mV),有利于连续流纯菌株R3系统高效稳定产氢。观察发现,ORP与COD去除率存在着一定的线性关系(见图6),y=0.729 5x+339.66(r2=0.657 7)。
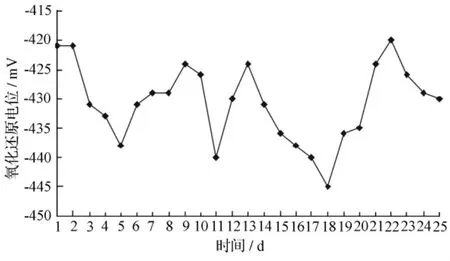
图5 CSTR反应器运行过程中ORP的变化情况
3 结论
在系统温度36℃、水力停留时间6 h、系统pH值和ORP分别在4.0~4.38和-445~-420 mV等条件下,可以实现高效产氢菌株R3在CSTR反应器中连续厌氧制氢。
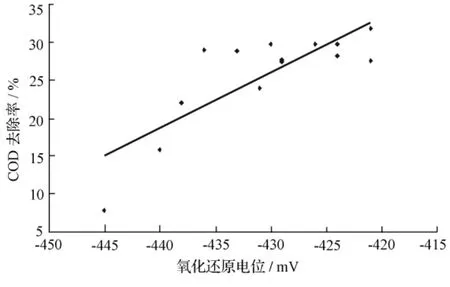
图6 ORP与COD去除率之间的线性关系
进水底物质量浓度的变化对系统的产氢效能的影响十分明显,进水COD在2 600~4 440 mg/L范围内变化,分别得到最大产气量和产氢量为6.08 L和3 L。进水pH值的降低影响系统的COD去除效率,但对出水pH值却无明显影响。可见连续流纯培养R3菌株是一个相对稳定的发酵制氢系统,ORP稳定在-445~-420 mV。ORP与COD去除率存在着一定的线性关系,y=0.729 5x+339.66(r2=0.657 7)。
[1]Hart D.Hydrogen power:the commercial future of“the ultimate fuel”[M].London:Financial Times Energy Publishing,1997.
[2]Kumar N,Das D.Continuous hydrogen production by immobilized Enterobacter cloacae IIT-BT 08 using lignocellulosic material as solid matrices[J].Enzyme Microb Technol,2001,29:280-287.
[3]任南琪.有机废水发酵法生物制氢技术:原理与方法[M].哈尔滨:黑龙江科学技术出版社,1994.
[4]Ghirardi M L,Zhang L,Lee J W,et al.Microalgae:a green source of renewable H2[J].Trends Biotechnol,2000,18:506-511.
[5]任南琪,秦智,李建政.不同产酸发酵菌群产氢能力的对比与分析[J].环境科学,2003,24(1):70-74.
[6]李永峰,韩伟,徐菁利,等.利用OLR和pH调控快速建立生物制氢反应器[J].太阳能学报,2009,30(5):708-712.
[7]王勇,任南琪,孙寓姣,等.乙醇型发酵与丁酸型发酵产氢机理及能力分析[J].太阳能学报,2002,23(3):366-373.
[8]李永峰,陈红,韩伟,等.零价铁和二价铁离子对发酵产氢效能的影响[J].太阳能学报,2009,30(4):551-557.
[9]任南琪,唐婧,宫曼丽.生物载体强化的连续流生物制氢反应器的运行特性[J].环境科学,2006,27(6):1176-1180.
[10]Chang J S,Lee K S,Lin P J.Biohydrogen production with fixedbed bioreactors[J].Int J Hydrogen Energy,2002:27(11/12):1167-1174.
[11]国家环保局《水和废水监测分析方法》编委会.水和废水监测分析方法[M].3版.北京:中国环境科学出版社,1997.
