好氧脱氮菌群的筛选驯化及PCR-DGGE分析
2011-03-29韩丽华张绍璐
韩丽华 张绍璐
(东北林业大学,哈尔滨,150040)
如何运用生物学的方法经济有效地去除水体中的氨氮是近年来废水处理研究领域的一个热点。传统生物脱氮工艺将硝化和反硝化作为两个相互独立的阶段,使二者在空间和时间上分开:硝化过程是由自养硝化细菌在好氧条件下将氨态氮通过亚硝酸盐向硝酸盐的转换,反硝化过程是由异养的反硝化细菌在严格缺氧的条件下将硝态氮或亚硝态氮还原为氮气或N2O[1],这无疑增加了运行成本和操作难度。如果能训育出在好氧条件下也能进行反硝化的微生物,并与硝化细菌混合培养,则可以将硝化反硝化过程控制在一个反应器中,并且硝化反应的产物可以直接作为反硝化反应的底物,避免对硝化反应的抑制;同时,两个反应各自产生的酸碱可以互相中和,维持系统中pH值相对稳定,从而实现同步硝化—反硝化过程(SND)[2]。
目前已知的好氧反硝化菌有Klebsiella pneumoniae[3]、Comamonas testosteroni[4]、Pseudomona sputida[5]等,研究还发现许多好氧反硝化菌(如Thiosphaera pantotropha,Pseudomonasspp.,Alcaligenesfaecalis等)同时也是异养硝化菌,能够直接地把转化为最终气态产物而逸出[6]。由于好氧反硝化菌及好氧反硝化理论的形成,才使得真正意义上的SND得以实现。
有效生物群(Effective Micro-organisms,EM)始于20世纪80年代初,是由日本琉球大学比嘉照夫教授发明研制的一种新型复合微生物活菌制剂[7]。它采用独特的发酵工艺,把好氧和厌氧微生物按一定的比例混合,培养出多种性的微生物群落,具有微生物菌群多、结构稳定、对污染物降解能力强等优势。在微生物生态学中的分子生物学方法领域,1993年Muyzer等[8]最初将变性梯度凝胶电泳DGGE技术引入微生物生态研究。DGGE技术是多态性分析技术的一种,可依据双链DNA片断熔解行为的不同,用于分离PCR产物中长度相同但序列不同的DNA标记片断。这种方法可以有效地避免在传统富集、培养、分离研究过程中造成的微生物多样性丢失、种群构成发生变化等弊病,能够更直接、可靠地反映出微生物的原始组成及演变情况。
本研究将PCR-DGGE技术运用到了好氧反硝化细菌和硝化细菌的有效生物群联合驯化培养当中,使整个驯化过程更为直观与可控,所获得菌群的脱氮性能更加稳定与高效,应用价值更高,是对微生物驯化技术与SND生物脱氮技术的有力补充。
1 材料方法
1.1 培养基
初筛培养基(1 L):NaHCO38 g、CH3COONa 8 g、(NH4)SO41 g、NaNO20.1 g、NaCl 1 g、MgSO40.25 g、K2HPO41 g、微量元素溶液2 mL,pH=7~8。
复筛培养基(1 L):NaHCO34 g、CH3COONa 4 g、(NH4)SO41 g、NaCl 1 g、MgSO40.25 g、K2HPO41 g、微量元素溶液2 mL,pH=7~8。
微量元素溶液(1 L)[9]:EDTA 50.0 g、ZnSO42.2 g、CaCl25.5 g、MnCl2·4H2O 5.06 g、FeSO4·7H2O 5.0 g、(NH4)6Mo7O2·4H2O 1.1 g、CuSO4·5H2O 1.57 g、CoCl2·6H2O 1.61 g,pH=7.0。
1.2 培养方法
整个筛选驯化过程控制在好氧条件下,过程中定时检测氨态氮(—N)、亚硝态氮—N)和硝态氮—N)的变化情况。整个过程分为:初筛、复筛及驯化。
1.2.1 初筛
初筛菌源分别取自哈尔滨文昌污水厂A/O池好氧段新鲜污泥、哈尔滨市马家沟底污泥、厕所旁土壤及东北林业大学林场土壤。采用初筛脱氮培养基,按10%接种量将新鲜污泥(菌液)10 mL接种至装有90 mL培养基的500 mL三角瓶中,θ=30℃,180 r·min-1振荡培养,并在三角瓶中装几粒玻璃珠(尽量减小厌氧微环境对试验结果的影响)。培养周期为4 d,共培养2个周期(下一驯化周期取上周期菌液作为菌源),每周期结束检测氨氮含量。
1.2.2 复筛及驯化
用初筛得到的筛选产物作为复筛的菌源,采用复筛培养基,按10%接种量将菌液10 mL接种至装有90 mL培养基的500 mL三角瓶中,θ=30℃,180 r·min-1振荡培养,并在三角瓶中装几粒玻璃珠(尽量减小厌氧微环境对试验结果的影响)。培养周期为2 d,每4个周期为1个阶段(每阶段提取一次脱氮菌群总DNA样品,保存),每周期结束检测氨氮、亚硝态氮、硝态氮含量。
1.3 分析方法
氨氮测定:纳氏试剂分光光度法。亚硝酸盐测定:N-(1-萘基)-乙二胺光度法。硝酸盐测定:紫外分光光度法[10]。
1.4 菌群总DNA提取
基于SDS的裂解法[11]。
1.5 基因组总DNA16S rDNA V3区扩增
16 S rRNA基因V3区的引物:将纯化后的基因组的DNA作为聚合酶链接反应(PCR)的模板,采用两组对大多数细菌和古细菌的16S rRNA基因V3区具有特异性的引物对[12],即组合1(F357GC和R518)和组合2(F357GC和R518)。F357,(5'-CC TAC GGG AGG CAG CAG-3'),R518,(5'-ATT ACC GCG GCT GCT GG-3'),GC发卡结构,(5'-CGC CCG CCG CGC GCG GCG GGC GGG GCG GGG GCA CGG GGG G-3')。引物组合1扩增产物片段长度约为230 bp,而组合2约为190 bp。
PCR反应条件:采用降落PCR策略,即预变性条件为94℃、3 min,前15个循环为94℃、1 min,60℃、1 min和72℃、1 min,后20个循环为94℃、1 min,50℃、1 min和72℃、1 min,最后在72℃延伸10 min。扩增产物在1%琼脂糖凝胶电泳检测。
1.6 变性梯度凝胶电泳(DGGE)分析
采用Bio-RAD公司DCodeTM的基因突变检测系统对PCR反应产物进行分离。
变性梯度胶的制备:使用梯度混合装置,制备8%的聚丙烯酰胺凝胶,变性质量分数为30%~70%(100%变性剂为7 mol·L-1尿素和40%去离子甲酰胺的混合物),其中变性剂的质量分数从胶的上方向下一次递增。
PCR样品的加样:待胶完全凝固后,将胶板放入装有电泳缓冲液的装置中,每个点样孔加20 μL PCR样品及10 μL的2倍浓度的loading Dye染料。
电泳及染色:在90~95 V电压60℃电泳14 h电泳结束后,将凝胶进行银染。
DGGE指纹图谱DNA条带分析。应用凝胶分析软件Quantity One对扫描所得DGGE图谱进行条带识别和分析。
2 结果与分析
2.1 好氧脱氮菌群的初筛结果
在长期的生存进化过程中,由于不同的生物菌群长期处于不同的生态环境中,其生理和代谢功能也不一样,致使不同生物菌群对氨氮去除能力不同。本研究初筛所得的污水厂A/O池好氧段新鲜污泥中生物菌群对氨氮去除率最高,达到76%,东北林业大学林场土壤中生物菌群对氨氮去除能力最低,仅为10%。
2.2 好氧脱氮菌群的复筛及驯化结果
所需目的菌群为脱氮菌群,只考查氨氮去除率不能符合脱氮功能的要求,故需对初筛得到的菌群复筛并加以驯化,以得到更稳定高效的好氧脱氮菌群。复筛培养基中唯一的氮源为(NH4)SO4,但随着硝化反应的进行,亚硝态氮和硝态氮应该作为硝化反应的产物出现,而事实上,反应过程中氨氮的降解率达到90.1%,但是却未检测到亚硝态氮和硝态氮的产生。这表明系统内也同时发生了反硝化反应,即硝化与反硝化反应同时在一个系统内发生,硝化反应的产物直接作为反硝化反应的底物被利用。驯化过程氨氮去除率如表1所示。

表1 复筛阶段氨氮去除率
2.3 脱氮过程中氨氮、亚硝态氮、硝态氮转化过程
为了明确在该脱氮过程中亚硝态氮和硝态氮的降解过程,对该脱氮菌群分别添加一定量的亚硝态氮和硝态氮,从它们的变化过程及氮元素的平衡推测脱氮机理。在培养基中只添加亚硝酸盐为氮源时,亚硝态氮能在短期内被降解,24 h去除率达98.1%。当在培养基中只添加硝酸盐为氮源,硝态氮仍能在短期内被降解,24 h去除率达95.2%,且亚硝态氮及硝态氮去除率曲线呈与细菌生长曲线同趋势,如表2所示。
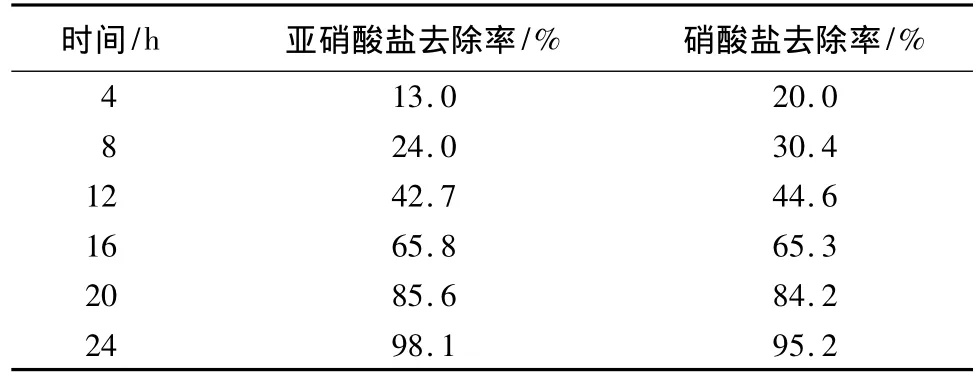
表2 亚硝酸盐及硝酸盐去除率
整个过程中NH+4-N被降解而没有NO-2-N和NO-3-N积累的现象,这说明该脱氮菌群中既含有能进行亚硝酸盐还原反应的亚硝酸盐还原菌,又具有能进行硝酸盐还原反应的硝酸盐还原菌。至于脱氮过程中该菌群是否发生短程同时硝化—反硝化还有待进一步研究。
2.4 PCR-DGGE分析
当该脱氮菌群脱氮速率达到相对稳定值时,对每阶段该脱氮菌群的种群变化进行PCR-DGGE分析(图1)。根据变性梯度凝胶电泳分离原理,PCR-DGGE带谱中的每一条带代表一个可能的细菌类群和可操作分类单位(OUT),电泳条带越多说明生物多样性丰富;条带信号越强,表示该种属的数量越多,从而可以确定不同活性污泥中所含有的微生物的种类和数量关系,得出其中微生物多样性的信息。通过该菌群各阶段的条带比较可以明显发现菌群的演变过程,第3、4阶段已无明显变化,加之第3、4阶段脱氮速率也达到相对稳定状态,说明生物群落的演变情况与氮素去除指标的变化是相吻合的,目的脱氮菌群训育成功。

图1 驯化期间各阶段微生物群落DGGE分离图谱1-4分别为驯化的第1、2、3、4阶段。
3 讨论
目前人们对于同步硝化反硝化的反应机理仍存在不同的观点。其中宏观环境理论和物理学微环境理论都还是没有摆脱传统的好氧缺氧生物脱氮模式[13]。其所说的好氧反硝化,其实质仍然是缺氧微环境下的反硝化,不能称之为真正意义上的好氧反硝化[14]。生物学微生物理论认为,SND正是在好氧反硝化菌、低DO下的硝化菌、异养硝化菌及自养反硝化菌作用的条件下才得以进行[13]。Patureau等从升流式缺氧滤池中分离出了好氧反硝化菌SGLY2,而后在好氧条件下和硝化细菌混合培养,氨氮被自养硝化细菌氧化,同时伴随硝酸盐氮被异养好氧反硝化菌还原成分子氮,将硝化和反硝化控制在同一反应器[15]。Robertson[16]等人证实了Pseudomonas Sp.,Alcaligenes faecalis,Thiosphaera Pantotropho等好氧反硝化菌也是异养硝化菌,可直接将氨转化成最终气态产物逸出,这样就实现了同时硝化反硝化。耿金菊等对好氧脱氮微生物的混合培养脱氮过程进行研究,验证可以在好氧条件下将氨氮最终转化为氮气排放[2]。本研究从同步硝化反硝化的生物学微生物理论出发,通过初筛和复筛驯化最终获得可在好氧条件下脱氮的有效微生物群。经对氮素转化过程的研究,初步判断该菌群中含有能进行硝化作用的亚硝化细菌、硝化细菌及能进行硝酸盐、亚硝酸盐还原反应的亚硝酸还原菌和硝酸盐还原菌,这也进一步解释反应过程中没有硝酸盐及亚硝酸盐积累的脱氮现象。
以往对于好氧反硝化的研究主要停留在单一菌株的分离及特性的理论研究,且存在分离操作繁琐困难、后期实际应用性不高的问题。在实际应用当中,由于外界环境多变,单株菌的抵御外界冲击能力有限,将导致氮素降解能力下降。而EM是一个强大的功能群体,各种微生物在其生长过程中产生的有用物质及分泌物,又将成为各自或相互间生长的基质和原料,通过这种相互作用、相互促进起到协同的作用,代谢出抗氧化物质,生成稳定而复杂的生态系统,抑制有害微生物的生长繁殖和含硫、氮等恶臭物质产生的臭味,,激活水中具有净化水功能的原生动物,利用微生物及水生植物的生物综合效应达到净化废水的目的[17]。
邵青等[18]专门做了EM脱除氨氮效果试验研究,结果为EM在好氧条件下能显著提高污水中氨氮(NH+4—N)的去除率,在EM投入比例为0.8%时,去除率增幅达13.31%。孟范平[19]等人对高效复合菌技术处理生活污水进行了研究,认为在好氧条件下,当菌液加入量为0.5%时,能显著或极显著提高污水氨态氮的硝化程度,增幅达37.62%。本研究应用EM理论,用定向驯化的方法获得有稳定脱氮作用的有效生物群,以驯化代替筛选,提高实验效率。实验证明,该菌群在驯化第24天开始,氨氮去除率已稳定在90%左右,具有单菌株所不及的稳定的去除氨氮且无亚硝态氮和硝态氮积累的能力。
在菌群驯化过程中,了解微生物的群落结构对驯化进程的把握和今后对菌群的鉴定和分离处理系统中的优势菌种很重要。裘湛等[20]采用PCR-DGGE技术对处理采油废水的水解酸化—缺氧法不同生物反应器中污泥样品进行研究,确定了微生物的优势菌种,并进行了多样性分析,结果显示在不同环境条件下微生物群落结构的连续动态变化过程。Curtis等[21]采用PCR-DGGE比较了不同污水处理厂的活性污泥中总微生物群落的多样性。在以往的研究中,将PCR-DGGE图谱作为菌群驯化的进程标准的并不多见,并且对菌群驯化过程的检测也只是针对一些理化指标,没有从种群构成的分子生物学高度分析监测整个驯化过程。本研究将PCR-DGGE技术与驯化各阶段氮素去除指标相结合,发现二者的变化是相吻合的,即在系统氨氮去除率保持相对稳定的情况下,种群结构也趋于稳定。这说明将PCR-DGGE方法运用到菌群驯化当中是可行且有效的,也希望此方法在今后能得到更好的运用。
[1]马放,王弘宇,周丹丹.好氧反硝化生物脱氮机理分析及研究进展[J].工业用水与废水,2005,36(2):11-14.
[2]堵国成,耿金菊,陈坚.好氧同时硝化—反硝化脱氮微生物的混合培养[J].无锡轻工大学学报,2002,21(5):515-518.
[3]Kim Y J,Yoshizawa M,Takenakas S,et al.Isolation and culture conditions of a Klebsiella pneumoniae strain that can utilize ammonium and nitrate ions simultaneously with controlled iron and molybdate ion concentrations.Bioscience[J].Biotechnology and Biochemistry,2002,66:996-1001.
[4]Wang P,Li X T,Xiang M F,et al.Characterization of efficient aerobic denitrifiers isolated from two different sequencing batch reactors by 16S-rRNA analysis[J].Journal of Bioscience and Bioengineering,2007,103:563-567.
[5]Kim M,Jeong S Y,Yoon S J,et al.Aerobic denitrification of Pseudomonas putida AD-21 at different C/N ratios[J].Journal ofBioscience and Bioengineering,2008,106:498-502.
[6]Robertson L A,van Niel E D W J,Torremans Rob A M,et al.Simul-tane-ous nitrification and denitrification in aerobic chemostatcultures of Thiosphaera antotropha[J].Appl Environ Microbiol,1988,54(11):2812-2818.
[7]李素玉.环境微生物分类与检测技术[M].3版.北京:化学工业出版社,2005:183-185.
[8]Muyzer G,De Waal E C,Uitterlinden AG.Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction amplified genes encoding for16S rRNA[J].Applied Environment Mi-crobiology,1993,59:695-700.
[9]苏俊峰,王继华,马放,等.好氧反硝化细菌的筛选鉴定及处理硝酸盐废水的研究[J].环境科学,2007,28(10):2332-2335
[10]国家环保局《水和废水监测分析方法》编委会.水和废水监测分析方法[M].4版.北京:中国科学环境出版社,2002.
[11]李鹏,毕学军,汝少国.DNA提取方法对活性污泥微生物多样性PCR-DGGE检测的影响[J].安全与环境学报,2007,7(2):53-58.
[12]Muyzer G,Ellen C W,Andre G U.Profiling of complex microbial populations by denaturing gradient gel elec-trophoresis analysis of polymerase chain reaction genes coding for 16S rRNA[J].Appl Environ Microbiol,1993,59:695-700.
[13]孙志伟,王庆年.同时硝化/反硝化生物脱氮技术的研究概况[J].甘肃科技,2010,26(2):50-53.
[14]王宏宇,马放,周丹丹.同步硝化好氧反硝化生物脱氮机理分析及其研究进展[J].四川环境,2004,23(6):62-70.
[15]Patureau D,N Berner N,Bouchez T,et al.Biological Nitrogen removal in a single aerobic reactor by association of a nitrifying ecosystem to an aerobic denitrifier,Microvirgula Aerodenitrificans[J].Journal of Molecular Catalysis,1998,5(1/4):435-439.
[16]王文斌,丁忠浩,董有.同步硝化反硝化的研究与机理分析[J].环境科学与技术,2004,27(2):38-39.
[17]乔俊婧.EM技术在污水处理中的应用[J].实验与技术,2008,24(11):968-970.
[18]邵青,庄艳峰,王洪涛,等.EM脱除氨氮效果试验研究[J].武汉大学学报:工学版,2001,34(2):77-80.
[19]孟范平.系统评价有效微生物群菌液在生活污水处理中的应用效果[J].城市环境与城市生态,1999,5(12):4-8.
[20]裘湛,闻岳,黄翔峰,等.PCR-DGGE技术在水解酸化—缺氧法处理采油废水的微生物研究中的应用[J].环境污染与防治,2006,28(6):439-442.
[21]Curtis T P,Craine N G.The comparison of the diversity of activated sludge plants[J].Water Sci Technol,1998,37:71-78.
