黑加仑花色苷的提取及抗氧化活性研究
2011-03-28孔保华张洪涛
贾 娜,孔保华*,张洪涛
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
黑加仑花色苷的提取及抗氧化活性研究
贾娜,孔保华*,张洪涛
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
采用溶剂提取法对黑加仑花色苷进行提取,通过测定花色苷提取量、2,2-二苯基-1-间三硝基苯基联肼(DPPH)自由基清除率、还原能力综合确定最佳提取条件,以获得具有较高提取量和较高抗氧化活性的黑加仑花色苷提取液,并将提取液与丁羟基茴香醚(BHA)和抗坏血酸的抗氧化能力进行比较。结果表明:黑加仑花色苷最佳提取工艺为提取溶剂乙醇盐酸溶液,其中乙醇体积分数40%、盐酸质量分数0.5%、提取料液比1∶10(g/mL)、提取时间2h,所得提取液的花色苷质量浓度为86.15mg/L,即冻果中提取量为172.29mg/100g,此时提取液的DPPH自由基清除率为71.64%,还原能力为1.64(以A700表示);花色苷质量浓度0.1mg/mL的提取液较同质量浓度的BHA和抗坏血酸具有更高的还原能力和自由基清除能力(P<0.05)。因此,黑加仑富含具有较强抗氧化能力的花色苷,具有良好的开发应用前景。
黑加仑;花色苷;提取;抗氧化能力
食品中的合成抗氧化剂对人体具有潜在的危害[1],因此,开发天然抗氧化剂尤为重要。花色苷作为植物的主要呈色物质不但具有较强的自由基清除能力和抗氧化能力,还具有潜在的营养价值和医疗价值[2]。紫黑色小浆果和葡萄中的花色苷含量丰富,黑加仑作为小浆果的一种,鲜果花色苷含量可达201mg/100g[3],黑加仑果实及其制品呈现深红色则是由于高含量的花色苷所致。水溶性花色苷主要存在于黑加仑的果皮中,总花色苷含量至少为2000mg/kg新鲜果皮[4]。早在1977年Koeppen等[5]就已经发现黑加仑含有丰富的花色苷。国外对于黑加仑花色苷的研究主要集中在黑加仑花色苷的提取[2,4]、花色苷单体的分离鉴定[6]和稳定性分析[7]。国内对黑加仑花色苷的提取、纯化和鉴定有一定的研究[8-9],但较少考虑提取条件对抗氧化能力的影响,大部分研究仅以花色苷含量作为衡量指标。本研究对不同提取条件下的花色苷提取量和抗氧化能力同时进行测定,确定黑加仑花色苷最佳提取条件,将花色苷与相同浓度的抗氧化剂丁羟基茴香醚(butylated hydroxyanisole,BHA)、抗坏血酸进行比较,探讨其抗氧化效果。
1 材料与方法
1.1材料与试剂
黑加仑冻果,购自哈尔滨高泰食品公司,-18℃保存。
2,2-二苯基-1-间三硝基苯基联肼(DPPH)、2,2'氨基-二(3-乙基-苯并噻唑啉磺酸-6)铵盐(ABTS)、2-D-脱氧核糖 美国Sigma公司;丁羟基茴香醚、抗坏血酸、邻苯三酚、Tris碱、硫代巴比妥酸(thiobarbituric acid,TBA)、三氯乙酸(trichloroacetic acid,TCA)等均为国产分析纯。
1.2仪器与设备
UT-1800型紫外-可见分光光度计 北京普析通用仪器有限公司;DK-8B型电热恒温水浴锅 上海精宏实验设备有限公司;AL-104型精密电子天平 上海梅特勒-托利多仪器设备有限公司;pHS-25型pH计 上海精科雷磁仪器厂。
1.3方法
1.3.1黑加仑花色苷的提取
取黑加仑冻果适量,室温解冻后,放入搅拌机中搅碎。称取5g破碎后的黑加仑,在一定条件下用提取溶剂于35℃浸提,真空抽滤,所得滤液用于测定各项指标。
1.3.2单因素试验
分别考察不同提取溶剂、乙醇体积分数、料液比、提取时间和盐酸质量分数对花色苷提取量和提取液的还原能力、DPPH自由基清除能力的影响,通过单因素试验确定最佳提取条件。
1.3.3花色苷提取量测定
采用pH示差法[10]。取适量提取液,分别用pH1.0的KCl-HCl缓冲液(0.025mol/L)和pH4.5的乙酸钠-HCl缓冲液(0.4mol/L)稀释至适当倍数(使pH1.0时的吸光度在0.2~0.7之间),放置15min后,于波长520nm处测定吸光度,按下式计算冻果中的花色苷提取量:
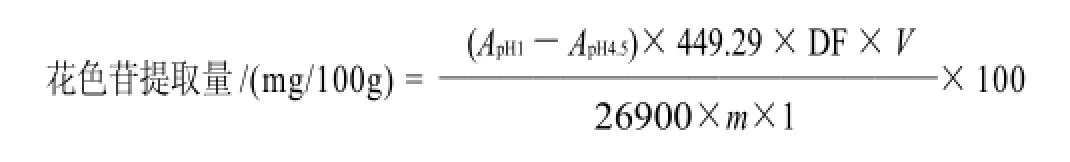
式中:449.29是矢车菊-3-葡萄糖苷的摩尔质量/ (g/mol);DF是稀释倍数;V是提取溶剂的体积/mL;26900是矢车菊-3-葡萄糖苷的摩尔消光系数/(L·mol/cm);m是黑加仑的质量/g;1是比色皿的光路长度/cm。
1.3.4还原能力的测定
采用Oyaizu等[11]的方法。0.5mL待测液与2.5mL磷酸盐缓冲液(pH6.6,0.2mol/L)和2.5mL 1%铁氰化钾混合,50℃保温20min,快速冷却后,加入10% TCA 2.5mL,3000r/min离心10min,取上清液5mL,加入5mL蒸馏水和1mL 0.1%氯化铁溶液,混匀后放置10min,于700nm测定吸光度。用吸光度A700直接表示还原力,吸光度越大还原能力越强。
1.3.5DPPH自由基清除能力的测定
参照Yang等[12]的方法。0.1mL待测液与3.0mL 0.1mmol/L的DPPH乙醇溶液混合,室温避光反应30min,波长517nm处测定吸光度,按下式计算DPPH自由基清除率。

式中:Ac为对照的吸光度;As为样品的吸光度。
1.3.6超氧阴离子自由基清除能力的测定
参照Xiang等[13]的方法并稍加修改。0.1mL待测液与2.85mL Tris-盐酸(pH8.2,50mmol/L)混合,25℃保温10min后,加入0.1mL 25℃预热的6mmol/L邻苯三酚,迅速摇匀,于波长320nm处每隔30s测定吸光度,按照下式计算超氧阴离子自由基清除率。

式中:Ac为邻苯三酚自氧化速率,即每分钟增加的吸光度;As为加入样品后,每分钟增加的吸光度。
1.3.7羟自由基清除能力的测定
参照Lee等[14]的方法。0.1mL待测液与1mL反应缓冲液混合(含0.1mmol/L FeCl3,0.104mmol/L EDTA,1.5mmol/L H2O2,2.5mmol/L脱氧核糖,0.1mmol/L 抗坏血酸,pH7.4),37℃水浴保温1h后,加入1mL 2.8% TCA溶液和1mL 0.5% TBA(0.025mol/L NaOH溶液溶解),80℃水浴保温30min。冷却后,于波长532nm处测定吸光度,按下式计算羟自由基清除率。
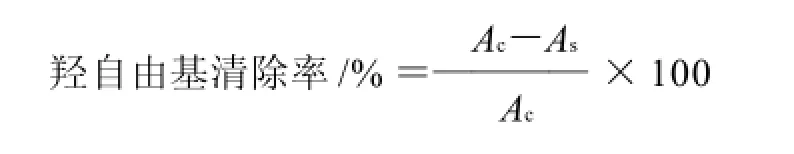
式中:Ac为对照的吸光度,As为样品的吸光度。
1.3.8ABTS自由基清除能力的测定
参照Ozgen等[15]的方法并稍加改动。7.0mmol/L ABTS·与终浓度为2.45mmol/L的过硫酸钾混合,室温避光放置12~16h。用pH4.5的乙酸钠溶液(20mmol/L)稀释至波长734nm处的吸光度为0.7±0.02。取3mL该溶液与20μL待测液混合,放置6min,于波长734nm处测定吸光度,按照下式计算ABTS自由基清除率。

式中:Ac为对照的吸光度;As为样品的吸光度。
1.4数据分析
每个实验重复3次,结果表示为“平均值±标准差”。数据统计分析采用Statistix 8.1软件包中Linear Models程序进行,差异显著性(P<0.05)分析使用Tukey HSD程序。
2 结果与分析
2.1黑加仑花色苷提取条件的确定
2.1.1提取溶剂的确定
用不同溶剂以料液比1∶20在35℃提取2h所得的花色苷提取量、还原能力和DPPH自由基清除率见表1。可以看出,乙醇盐酸溶液为提取溶剂时,花色苷提取量最高,为175.52mg/100g,还原能力和DPPH自由基清除能力最强,分别为1.38和74.56%,与其他提取溶剂相比,差异性显著(P<0.05)。因此,选择乙醇盐酸溶液为提取溶剂。

表1 提取溶剂对花色苷提取量和抗氧化能力的影响Table 1 Anthocyanin contents and antioxidant activity of different solvent extracts from blackcurrants
2.1.2乙醇体积分数的确定

图1 乙醇体积分数对花色苷提取量和抗氧化能力的影响Fig.1 Effect of ethanol concentration on extraction rate and antioxidant activity of anthocyanins
由图1可以看出,用乙醇盐酸溶液(盐酸质量分数1%)以料液比1∶20在35℃提取2h,乙醇体积分数从20%增加到40%时,提取量从165.64mg/100g显著增加到177.27mg/100g(P<0.05),随后随着乙醇体积分数的增加,提取量增加缓慢,且不显著(P>0.05),并且当乙醇体积分数80%时,花色苷提取量略有降低,这与Patil等[16]的研究结果相似。由于黑加仑中含有部分亲水性花色苷,因此没有选择100%乙醇提取。DPPH自由基清除率和还原能力在乙醇体积分数为20%和80%时较低,乙醇体积分数为40%、50%、60%时较高,但相互之间差异不显著(P>0.05)。若乙醇体积分数较高,则提取物不适合作为食品着色剂[16]。综合考虑,选择40%乙醇进行提取较好。
2.1.3料液比的确定
以40%乙醇盐酸溶液(盐酸质量分数1%)为提取溶剂,用不同料液比于35℃提取2h所得的花色苷提取量、还原能力和DPPH自由基清除率见图2,料液比为1∶5时,花色苷提取量最低,为154.14mg/100g,料液比为1∶10时,显著增加到179.55mg/100g(P<0.05),料液比为1∶30时,提取量达到最高为189.83mg/100g。还原能力和DPPH自由基清除能力变化趋势相似,料液比为1∶5时二者均最低,分别为0.87和56.50%,料液比减小到1∶10时,分别显著增加到1.05和62.44%(P<0.05),随后随着料液比的减小,二者均增加不显著(P>0.05)。综合以上情况,为了节省提取溶剂以及缩短浓缩时间,选择料液比为1∶10进行提取。

图2 料液比对花色苷提取量和抗氧化能力的影响Fig.2 Effect of material/liquid ratio on extraction rate and antioxidant activity of anthocyanins
2.1.4提取时间的确定
以40%乙醇盐酸溶液(盐酸质量分数1%)为提取溶剂,在料液比1∶10的条件下于35℃提取不同时间所得的花色苷提取量、还原能力和DPPH自由基清除率见图3,可以看出,随着提取时间的延长,花色苷提取量先增加后降低,2h时达到最高,为170.44mg/100g。提取时间延长,提取量降低,可能是由于花色苷本身不稳定,提取时间过长对花色苷造成破坏。DPPH自由基清除率也是在提取时间为2h时达到最高,为65.18%,但清除率整体趋势变化缓慢。还原能力也随着提取时间先增加后降低,在4h时达到最大值1.62,但是与2h相比,差异不显著(P<0.05)。由于4h时的花色苷提取量较低,因此选择提取时间为2h。

图3 提取时间对花色苷提取量和抗氧化能力的影响Fig.3 Effect of extraction time on extraction rate and antioxidant activity of anthocyanins
2.1.5盐酸质量分数的确定
分别以0.1%、0.5%、1%、1.5%、2%的盐酸与40%乙醇溶液混合作为提取溶剂,以料液比1∶10于35℃提取2h所得的花色苷提取量和抗氧化效果如图4所示,盐酸对花色苷提取量的影响差异性不显著(P>0.05)。DPPH自由基清除能力随着盐酸质量分数的增加而逐渐增加,盐酸质量分数为0.1%时,清除率最低,为62.07%,与其他质量分数的清除率相比,差异性显著(P<0.05);盐酸质量分数0.5%时,清除率为71.64%,与1%和1.5%时的清除率相比,差异性不显著(P>0.05);盐酸质量分数2%时,清除率最高,为77.30%。还原能力随着pH值的增加,先增加后降低,盐酸质量分数1%时,还原能力最强,但与0.5%和1%时相比,差异不显著(P>0.05)。综合考虑花色苷提取量、DPPH自由基清除率和还原能力,选择盐酸为0.5%进行提取,此时的花色苷提取量为172.29mg/100g,DPPH自由基清除率为71.64%,还原能力为1.64。

图4 盐酸质量分数对花色苷提取量和抗氧化能力的影响Fig.4 Effect of HCl concentration on extraction rate and antioxidant activity of anthocyanins
2.2黑加仑花色苷的抗氧化性
花色苷含量为0.01%的提取液与质量分数0.01% BHA和抗坏血酸两种抗氧化剂的抗氧化能力比较见表2,可以看出,提取物的还原能力、超氧阴离子自由基清除率、ABTS自由基清除率显著高于抗坏血酸和BHA(P<0.05),而抗坏血酸和BHA二者之间差异不显著(P>0.05);提取物的羟自由基清除率显著高于抗坏血酸(P<0.05),但与BHA差异不显著(P<0.05);提取物的DPPH自由基清除率显著高于BHA和抗坏血酸(P<0.05),抗坏血酸的DPPH自由基清除率显著高于BHA(P<0.05)。由以上结果可以看出黑加仑花色苷提取物的抗氧化效果明显高于BHA和抗坏血酸。

表2 黑加仑提取物与抗坏血酸、BHA抗氧化能力的比较Table 2 Comparison of antioxidant activities among blackcurrant anthocyanins, ascorbic acid and BHA
3 讨论与结论
由于花色苷是极性分子,因此常用乙醇、甲醇或丙酮做为提取溶剂[17]。Bridgers等[18]以甲醇、酸化甲醇、乙醇和酸化乙醇提取紫红薯中的花色苷时发现,酸化甲醇的提取效果最好。Awika等[19]用丙酮和酸化甲醇对黑高粱花色苷进行提取,发现酸化甲醇的提取效果优于丙酮,经过反相高效液相色谱分析,丙酮提取的花色苷分子的结构被修饰,因此丙酮不适合提取高粱属的花色苷。尽管很多报道表明甲醇的提取效果最好,但是考虑到甲醇的毒性,选择乙醇为提取溶剂。此外,花色苷在中性或碱性条件下不稳定,通常采用酸化的有机溶剂进行提取,而且已有研究证实了酸化有机溶剂的提取效果优于单独使用有机溶剂的提取效果,本研究选择柠檬酸、乙酸和盐酸进行提取实验。
在确定乙醇体积分数时,发现随着乙醇体积分数的升高,花色苷提取量增加缓慢,乙醇为80%时,花色苷提取量略有降低,这与Patil等[16]的研究结果相似,Patil在提取红萝卜花色苷时,发现乙醇体积分数从20%增加到80%的过程中,花色苷提取量先增加,在50%达到最大值,随后花色苷提取量降低。Vatai等[20]用50%、70%、100%丙酮提取葡萄残渣中花色苷,发现丙酮浓度为50%时,花色苷提取量最高。这可能是由于有机溶剂浓度增加降低了亲水性花色苷的提取率,从而导致了总花色苷提取量降低。
Revilla等[21]在提取红葡萄花色苷时发现,使用质量分数高于1%的盐酸进行提取时,非乙酰化花色苷和香豆酰化花色苷的含量增加,但会导致乙酰化花色苷糖基部分水解,含量降低,因此尽管总花色苷含量增加,但为了防止乙酰化花色苷水解,也应避免使用质量分数高于1%的盐酸。这也是本实验选择0.5%盐酸进行提取的原因。
Koponen等[3]用甲醇盐酸提取黑加仑花色苷,鲜果花色苷提取量为201mg/100g,但并未对提取液的抗氧化能力进行测定。由于本实验选用的是黑加仑冻果,因此略低于该提取量。
将0.01%的黑加仑花色苷与相同质量浓度的BHA、抗坏血酸进行比较,发现花色苷提取物具有较高的抗氧化能力,除了羟自由基清除能力略低于BHA以外,其他抗氧化指标均高于BHA和抗坏血酸,说明黑加仑花色苷是一种理想的抗氧化剂。
通过单因素试验确定黑加仑花色苷最佳提取工艺为提取溶剂乙醇盐酸溶液、其中乙醇体积分数40%、盐酸质量分数0.5%、提取料液比1∶10(g/mL)、提取时间2h,所得提取液的花色苷质量浓度86.15mg/L,即提取量172.29mg/100g,此时提取液的DPPH自由基清除率为71.64%,还原能力为1.64;花色苷质量浓度0.1mg/mL的提取液较同质量浓度的BHA和抗坏血酸具有更高的还原能力和自由基清除能力(P<0.05)。这些研究结果表明,黑加仑果实中花色苷含量丰富且具有较强的抗氧化能力,作为一种天然抗氧化剂,黑加仑花色苷具有良好的开发和应用前景。
[1]乔凤云, 陈欣, 余柳青. 抗氧化因子与天然抗氧化剂研究综述[J]. 科技通报, 2006, 22(3)∶ 332-336.
[2]LAPORNIK B, PROSEK M, WONDRA A G. Comparison of extracts prepared from plant by-products using different solvents and extraction time[J]. Journal of Food Engineering, 2005, 71(2)∶ 214-222.
[3]KOPONEN J M, HAPPONEN A M, MATTILA P H, et al. Contents of anthocyanins and ellagintannins in selected foods consumed in Finland [J]. Journal of Agricultural and Food Chemistry, 2007, 55(4)∶ 1612-1619.
[4]LANDBO A K, MEYER A S. Effects of different enzymatic maceration treatments on enhancement of anthocyanins and other phenolics in black currant juice[J]. Innovative Food Science and Emerging Technologies, 2004(5)∶ 503-513.
[5]KOEPPEN B H, HERRMANN K. Flavonoid glycosides and hydroxycinnamic acid esters of blackcurrants (Ribes nigrum)[J]. Z Lebensm Unters Forsch, 1974, 164(4)∶ 263-268.
[6]COSTA C T, NELSON B C, MARGOLIS S A, et al. Separation of blackcurrant anthocyanins by capillary zone electrophoresis[J]. Journal of Chromatography A, 1998, 799(1/2)∶ 321-327.
[7]HABOURNE N, JACPUIER J C, MORGAN D J, et al. Determination of the degradation kinetics of anthocyanins in a model juice system using isothermal and non-isothermal methods[J]. Food Chemistry, 2008, 111 (1)∶ 204-208.
[8]王萍, 苗雨. 酶法提取黑加仑果渣花色苷的研究[J]. 林产化学与工业, 2008, 28(1)∶ 113-118.
[9]咸漠, 李华, 任玉林. 黑加仑色素的分离及组成初步鉴定[J]. 吉林大学自然科学学报, 1998(4)∶ 91-93.
[10]唐琳, 李子江, 赵磊, 等. 两种pH值法测定玫瑰花花色苷含量的比较[J]. 食品科学, 2009, 30(18)∶ 310-313.
[11]OYAIZU M. Studies on products of browning reaction∶ antioxidative activity of products of browning reaction prepared from glucosamine[J]. Journal of Nutrition, 1986, 44(6)∶ 307-315.
[12]YANG Zhendong, ZHAI Weiwei. Identification and antioxidant activity of anthocyanins extracted from the seed and cob of purple corn (Zea mays L.)[J]. Innovative Food Science and Emerging Technologies, 2010, 11 (1)∶ 169-176.
[13]XIANG Zhinan, NING Zhengxiang. Scavenging and antioxidant properties of compound derived from chlorogenic acid in South-China honeysuckle[J]. LWT- Food Science and Technology, 2008, 41(7)∶ 1189-1203.
[14]LEE J C, KIM H R, KIM J, et al. Antioxidant property of an ethanol extract of the stem of Opuntia ficus-indica var. saboten[J]. Journal of Agriculture and Food Chemistry, 2002, 50(22)∶ 6490-6496.
[15]OZGEN M, REESE R N, TULIO A Z, et al. Modified 2,2-azino-bis-3-ethylbenzothiazoline-6-sulfonic acid (ABTS) method to measure antioxidant capacity of selected small fruits and comparison to ferric reducing antioxidant power (FRAP) and 2,2'-diphenyl-1-picrylhydrazyl (DPPH) methods[J]. Journal of Agriculture and Food Chemistry, 2006, 54(4)∶1151-1157.
[16]PATIL G, MADHUSUDHAN M C, BABU B R, et al. Extraction, dealcoholization and concentration of anthocyanin from red radish[J]. Chemical Engineering and Processing∶ Process Intensification, 2009, 48 (1)∶ 364-369.
[18]BRIDGERS E N, CHINN M S, TRUONG V D. Extraction of anthocyanins from industrial purple-fleshed sweetpotatoes and enzymatic hydrolysis of residues for ferm entable sugars[J]. Industrial Crops and Products, 2010, 32(3)∶ 613-620.
[19]AWIKA J M, ROONEY L W, WANISKA R D. Anthocyanins from black sorghum and their antioxidant properties[J]. Food Chemistry, 2004, 90(1/2)∶ 293-301.
[20]VATAI T, SKERGET M, KNEZ Z, et al. Extraction and formulation of anthocyanin-concentrates from grape residues[J]. Journal of Supercritical Fluids, 2008, 45(1)∶ 32-36.
[21]REVILLA E, RYAN J M, MARTIN-ORTEGA G. Comparison of several procedures used for the extraction of anthocyanins from red grapes[J]. Journal of Agriculture and Food Chemistry, 1998, 46(11)∶ 4592-4597.
Extraction and Antioxidant Activity of Anthocyanins from Blackcurrants
JIA Na,KONG Bao-hua*,ZHANG Hong-tao
(College of Food Science, Northeast Agricultural University, Harbin 150030, China)
In order to optimize the extraction of anthocyanins from blackcurrants, the effects of solvent type, ethanol concentration, material/liquid ratio, extraction time, HCl concentration on the extraction yield of anthocyanins and the DPPH free radical scavenging rate and reducing power of blackcurrant extracts were explored. Extraction for 2 h at a material/liquid ratio of 1∶10 (g/mL) using acidified aqueous ethanol (containing 40% ethanol and 0.5% HCl) as the extraction solvent provided optimum extraction of anthocyanins from blackcurrants. The resultant extraction yield of anthocyanins and the anthocyanin content, DPPH free radical scavenging rate and reducing power of the obtained blackcurrant extract were 172.29 mg/100 g of fruit, 86.15 mg/L, 71.64% and 1.64 (A700), respectively. Blackcurrant anthocyanins at the concentration of 0.1 mg/mL revealed stronger DPPH free radical scavenging rate and reducing power than BHA and ascorbic acid of the same concentration (P < 0.05). Thus, blackcurrant, rich in highly antioxidant anthocyanins, has a promising prospect for development and application.
blackcurrant;anthocyanins;extraction;antioxidant activity
TS202.3
A
1002-6630(2011)16-0162-05
2010-11-12
国家公益性行业(农业)科研专项(200903012-02)
贾娜(1982—),女,博士研究生,研究方向为农产品加工与贮藏工程。E-mail:jiana_2010@163.com
*通信作者:孔保华(1963—),女,教授,博士,研究方向为畜产品加工。E-mail:kongbh@163.com
