不同育龄三角帆蚌血细胞吞噬率和血浆抗菌活力的比较
2011-03-20许巧情郝立平
许巧情,郝立平
(1.长江大学长江中游湿地农业教育部工程研究中心,湖北荆州434025;2.湖北信息工程学校,湖北荆门448124)
不同育龄三角帆蚌血细胞吞噬率和血浆抗菌活力的比较
许巧情1,郝立平2
(1.长江大学长江中游湿地农业教育部工程研究中心,湖北荆州434025;2.湖北信息工程学校,湖北荆门448124)
以2~5育龄三角帆蚌Hyriopsis cumingii为对象,研究了三角帆蚌血浆对大肠杆菌、金黄色葡萄球菌、溶壁微球菌、嗜水气单胞菌的抗菌活力和血细胞对金黄色葡萄球菌的吞噬率。结果表明:4种育龄的育珠蚌血浆对金黄色葡萄球菌的抗菌活力最强,其次为溶壁微球菌、大肠杆菌和嗜水气单胞菌,其中3龄育珠蚌对4种细菌的抗菌活力最强;4龄育珠蚌对金黄色葡萄球菌的吞噬率最高,达到36.6%,吞噬指数达到3.75,其次为5龄育珠蚌,2龄育珠蚌对金黄色葡萄球菌的吞噬率最低,仅为25.2%,吞噬指数为2.95。本研究结果证实:在2~5育龄内,3~4育龄的三角帆蚌育珠蚌的吞噬率和抗菌活力最强,抵抗外来病原菌的能力最高;但随着育珠年龄的增长,三角帆蚌免疫能力不断下降,因而养蚌育珠过程中要加强对高龄蚌抗病防病能力的管理。
三角帆蚌;抗菌活力;吞噬率
中国养殖三角帆蚌Hyriopsis cumingii的历史悠久,是淡水珍珠生产大国。自20世纪80年代末以来,淡水珍珠产量不断提高,2004年珍珠产出量约1 250 t,占世界珍珠产量的90%以上[1]。近年来,中国主要的淡水育珠蚌——三角帆蚌暴发了大规模的病害,造成了巨大的经济损失,因而三角帆蚌的免疫防御机制研究显得尤为重要。软体动物血清中含有的抗菌因子,在抵御水体中病原微生物的入侵、抑制和消灭已入侵的病原微生物等方面起着积极作用,是机体免疫防御的重要屏障之一[2-3]。有关软体动物血清/血浆抗菌作用的研究报道较少,国外仅见关于牡蛎[4]、紫贻贝[5]、双瓣类免疫因子[6]的报道,国内有关于栉孔扇贝[7]、毛蚶[8]的报道,但尚未见对三角帆蚌血清/血浆抗菌作用的报道。本研究中,作者研究了不同育龄三角帆蚌血细胞的吞噬活性,并对其血浆的抗菌活力进行了比较,旨在为三角帆蚌免疫机能的研究提供参考。
1 材料与方法
1.1 材料
于2009年11月5日在荆州市公安县一珍珠养殖场采集不同育龄的三角帆蚌100多只,在实验室暂养5 d后用于试验。三角帆蚌尺寸的测定结果见表1。
1.2 方法
1.2.1 血清和血细胞的分离 活体解剖,小心切断三角帆蚌的闭壳肌,在贝壳最高处找到正在跳动的心脏,用1 mL注射器从心脏中抽取血液。对于4~5龄蚌每3只蚌的血液混合收集在一管,对于2~3龄小蚌每6~8只蚌的血液混合收集在一管,这两种三角帆蚌血液分别收集3管。4℃下以1 500 r/min离心15 min,收集上层的血浆和下层的血细胞,向血细胞中加入等体积的抗凝剂。
1.2.2 细菌悬液的制备 分别取少量大肠杆菌、金黄色葡萄球菌、嗜水气单胞菌、溶壁微球菌在LB固体培养基上用接种环划线接种,在37℃下培养16~18 h后,分别挑取4种细菌的单克隆接种到LB液体培养基中,37℃下振荡培养16~18 h,离心,收集底部的菌液即为细菌悬液。用磷酸缓冲液将细菌悬液调至试验所需的细菌浓度。
1.2.3 抗菌活力的测定 取大肠杆菌Escherichia
coli悬液50 μL与等体积的三角帆蚌血清置于同一离心管中,22℃下水浴中振荡培养2 h;取50 μL培养液与300 μL磷酸缓冲溶液混匀,得到稀释溶液;取稀释溶液300 μL均匀涂布于3个LB固体培养平板上,每个平板上涂布100 μL。取大肠杆菌悬液50 μL与等体积的磷酸缓冲液按照上述方法试验,作为对照组。将所有LB固体平板置于37℃下恒温培养箱中培养16~18 h,统计试验平板上的细菌个数,取其平均值。抗菌活力的计算公式为
抗菌率=(对照组细菌数量-试验组细菌数量)/对照组细菌数量×100%。
以同样的方法测定三角帆蚌血清对金黄色葡萄球菌Staphyloccocus aureus、溶壁微球菌Micrococcus lysodeikticus和嗜水气单胞菌Aeromonas hydrophila的抗菌活力。
1.2.4 吞噬率的测定 分别取50 μL不同育龄的三角帆蚌育珠蚌血细胞和等体积的金黄色葡萄球菌菌液加入同一离心管中,25℃下水浴中作用45 min后立即涂片(每组做3个重复),用吉姆萨染色,油镜下观察,并依据以下公式计算吞噬活性:

1.3 统计分析
不同育龄三角帆蚌血浆的抗菌活力和血细胞的吞噬活力的比较均采用Duncan's多重比较分析,以P<0.05表示差异显著。
2 结果与分析
2.1 三角帆蚌血浆的抗菌活力
由图1可见:2~5育龄的三角帆蚌血浆对金黄色葡萄球菌、溶壁微球菌、大肠杆菌、嗜水气单胞菌均表现出一定程度的抗菌活性,而且对两种革兰氏阳性菌(金黄色葡萄球菌和溶壁微球菌)的抗菌活性要高于对革兰氏阴性菌(大肠杆菌和嗜水气单胞菌)。3育龄的三角帆蚌对金黄色葡萄球菌的抗菌活力要明显地高于其它育龄的三角帆蚌(P<0.05),其抗菌率达到68.7%,2、4、5育龄的三角帆蚌对金黄色葡萄球菌的抗菌活力差异不明显(P>0.05);4种育龄的三角帆蚌对金黄色葡萄球菌的平均抗菌率为56.1%。3、4、5育龄的三角帆蚌对溶壁微球菌的抗菌活力存在明显差异(P<0.05),其中3育龄的三角帆蚌对溶壁微球菌的抗菌活力最高,抗菌率达59.2%;4种育龄的三角帆蚌对溶壁微球菌的平均抗菌率为47%。3、4育龄的三角帆蚌对大肠杆菌的抗菌活力要明显高于2、5育龄的三角帆蚌(P<0.05),但3、4育龄之间, 2、5育龄之间差异不显著(P>0.05);4种育龄的三角帆蚌对大肠杆菌的平均抗菌率为41.7%。类似地,3、4育龄三角帆蚌对嗜水气单胞菌的抗菌活性比5育龄的三角帆蚌要高(P<0.05),但2育龄三角帆蚌与5育龄三角帆蚌之间差异不显著(P>0.05);不同育龄的三角帆蚌对嗜水气单胞菌的抗菌活力最低,平均抗菌率为30.4%。
2.2 三角帆蚌血细胞的吞噬活性
从图2可见:2育龄三角帆蚌血细胞的吞噬率很低,仅为25.2%,明显低于4育龄和5育龄的三角帆蚌(P<0.05);4育龄三角帆蚌的吞噬率最高,达到37.5%,但3、4、5育龄三角帆蚌的吞噬率差异不明显(P>0.05)。吞噬指数也存在同样的趋势,2、3育龄三角帆蚌血细胞的吞噬指数明显低于4、5育龄的三角帆蚌(P<0.05),4育龄三角帆蚌的吞噬指数最高,达3.7。这表明低育龄三角帆蚌的吞噬活性比高育龄三角帆蚌要低。
3 讨论
3、4育龄的三角帆蚌抗菌活力明显比2、5育龄的三角帆蚌要高,说明随着三角帆蚌的生长其抗菌活力越来越强,但育龄达到5龄时其抗菌活力又有所下降。三角帆蚌免疫能力的变化趋势与其培育的珍珠质量是一致的[9]。
本研究表明:三角帆蚌血浆对革兰氏阳性菌的抗菌活力明显高于对革兰氏阴性菌。类似的结果在对栉孔扇贝Chlamys farreri的研究中也有发现,即栉孔扇贝的血清能够抑制金黄色葡萄球菌、四联微球菌Micrococcus tetragenus、枯草杆菌Bacillus subti lis等革兰氏阳性菌的生长,而不能抑制哈维氏弧
菌Vibrio harveyi、嗜水气单胞菌等革兰氏阴性菌的生长[7]。在贝类养殖过程中,贝类经常容易感染弧菌、气单胞菌、假单胞菌、大肠杆菌等革兰氏阴性菌而导致患病,这与贝类血清或血浆中对这些细菌的抑菌活性较低有一定关系。
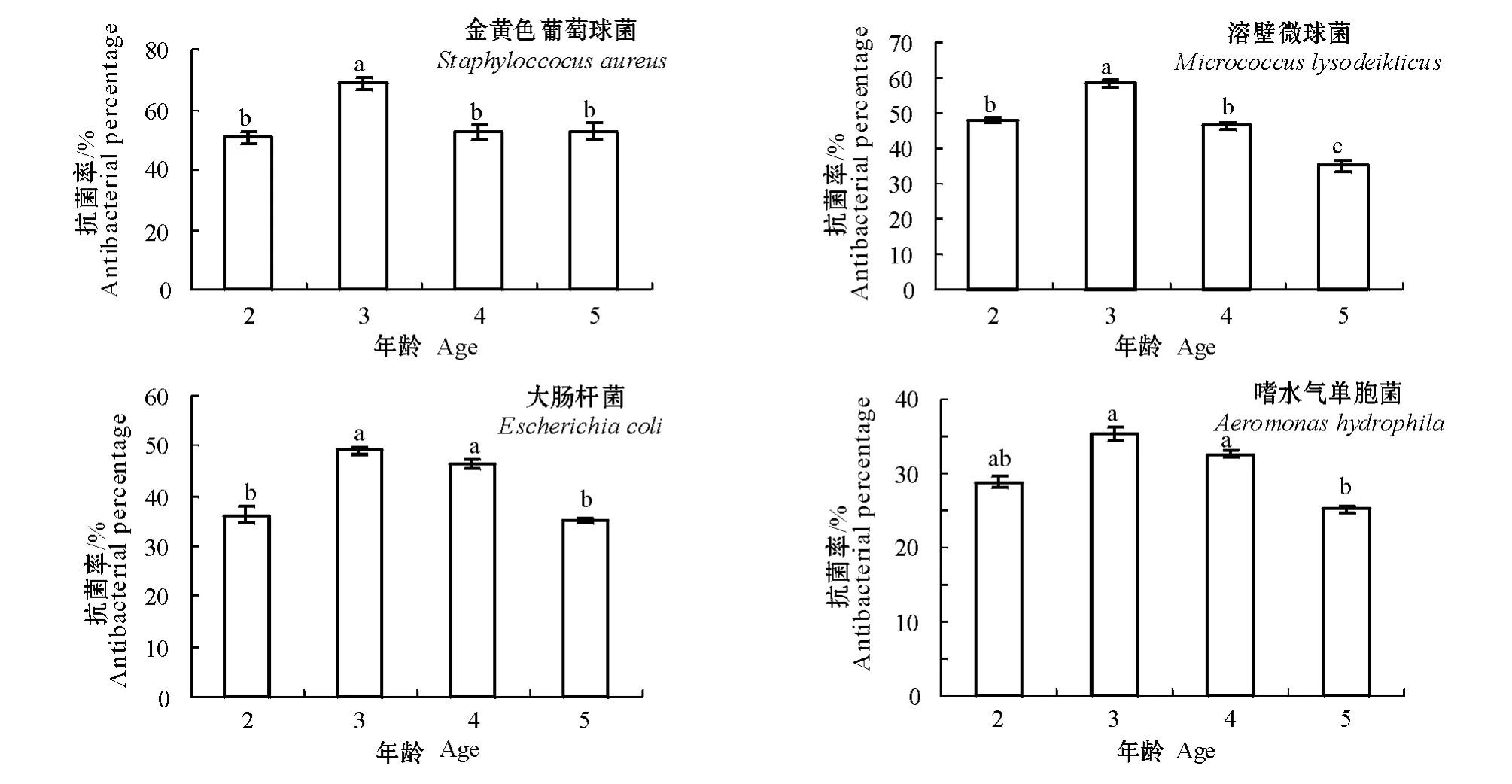
图1 不同育龄三角帆蚌血浆的抗菌活力(平均数±标准差)Fig.1 Plasma antibacterial activities in freshwater mussels with different ages(Mean±S.E.)
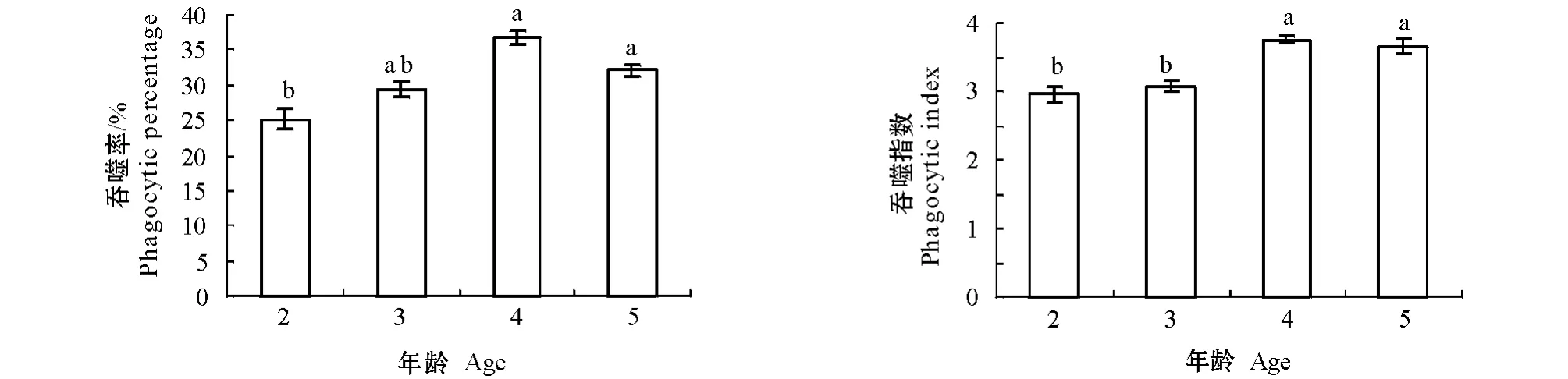
图2 不同育龄的三角帆蚌吞噬活性(平均数±标准差)Fig.2 Haemocytes phagocytic activities of freshwater mussels with different ages(Mean±S.E.)
不同育龄的三角帆蚌对4种细菌的抗菌百分率为30.4%~56.1%,说明三角帆蚌血浆对这4种细菌均存在一定的抑菌效果。但中国对虾Penaeus chinensis的血淋巴与溶藻胶弧菌Vibrio alginolyticus、哈维氏弧菌、副溶血弧菌V.parahaemolyticus、嗜水气单胞菌等菌悬液在孵育1~4 h后,均能抑制这些细菌的生长,但细菌生长却呈现两种不同的趋势。1~4 h内随着孵育时间的延长,溶藻胶弧菌、哈维氏弧菌、副溶血弧菌的生长菌落数量越来越多,而嗜水气单胞菌的生长菌落数量越来越少[10]。这种现象在对栉孔扇贝和牡蛎Crassostrea virginica的研究中也出现过,即栉孔扇贝和牡蛎的血清不但不能直接抑制或杀死细菌和真菌,反而为细菌的生长提供营养,从而造成细菌生长的菌落数比对照组还要高,杀灭和清除细菌最终还要依赖于机体的其它免疫作用,如吞噬和溶解[7,11]。
血细胞的吞噬活性是机体免疫防御的重要功能[12],很多因素均能影响吞噬活性。本研究中低育龄三角帆蚌吞噬活性低于高育龄的三角帆蚌,这与Dikkeboom等[13]的研究结果基本一致,即4~5月龄静水椎实螺Lymnaea stagnalis的吞噬活性明显低于12~13月龄。但在栉孔扇贝和紫贻贝Mytilus galloprovincialis中却均发现4月龄贝和9月龄贝其
吞噬活性差异不明显[5,14]。这说明同种贝中只有月龄或年龄差异比较大时吞噬活性才有显著差异。外界环境条件如温度也是影响贝类吞噬活性的另一主要因素。在一定温度范围内吞噬率与温度呈正相关[8],但当温度超过临界范围,如高温将会抑制血细胞的吞噬活性[4,15];相对于低温来说,高温对贝类吞噬活性的影响更大[14]。除了温度以外,盐度、受细菌感染程度也影响贝类的吞噬活性[8,14]。此外,水环境中的金属离子也能影响贝类的吞噬活性,如Cu2+、Ca2+、Mg2+和EDTA均能抑制背角无齿蚌的吞噬活性[16-17]。
[1] 戴银根,罗洁.中国淡水珍珠产业现状与对策研究[J].中国水产,2006(7):12-13.
[2] 杜丽,张巍,陆逵,等.贝类免疫机制研究进展[J].动物医学进展,2008,29(3):77-81.
[3] 王江勇,郭志勋,冯娟,等.病毒感染后杂色鲍部分血清免疫因子的变化[J].中国水产科学,2005,12(3):344-347.
[4] Alvarez M R,Fried1 F E,Johnson J,et al.Factors affecting in vitro phagocytosis by oyster hemocytes[J].J Inver Pat,1989,54:233.
[5] Carballal M J,Lopez C,Azevedo C,et al.In vitro study of phagocytic ability of Mytilus galloprovincialis Lmk haemocytes[J].Fish &Shellfish Immunol,1997,7:403-416.
[6] Carballal M J,Lopez C,Azevedo C,et al.Enzymes involved in defence functions of hemocytes of mussel Mytilus alloprovincialis[J]. J Invert Pathol,1997,70:96.
[7] 牟海津,江晓路,管华诗,等.栉孔扇贝血淋巴中的免疫因子的研究[J].中国水产科学,1999,6(2):33-36.
[8] 刘志鸿,张士璀,杨爱国,等.毛蚶血细胞的形态观察及吞噬性能研究[J].高技术通讯,2003(10):94-96.
[9] 许巧情,李景胐.三角帆蚌年龄与培育珍珠产量和质量比较[J].科学养鱼,2010(8):46-47.
[10] 李春猛,战文斌,马甡,等.中国对虾血淋巴抗菌活力的测定[J].青岛海洋大学学报,1999,29(4):599-603.
[11] Tamplin M L,Fisher W S.Occurrence and characteristics of agglutination of Vibrio cholerae by serum from the eastern oyster, Crassostrea virginica[J].Appl Environ Microbiol,1989,55:2882-2887.
[12] Fisher W S.Structure and functions of oyster hemocytes[C]// Brehelin M.Immunity in Invertebrates.Berlin:Springer verlag, 1986:25-35.
[13] Dikkeboom R,Van der Knaap W P W,Meuleman E A,et al.A comparative study on the internal defence system of juvenile and adult Lymnaea stagnalis[J].Immunology,1985,55:547-553.
[14] 张维翥,吴信忠,李登峰,等.栉孔扇贝血液细胞的免疫功能[J].动物学报,2005,51(4):669-677.
[15] Chu F L E,La Peyre J F.Development of disease caused by the parasite Perkinsus marinusand defense-related hemolymph factors in three populations of oysters from the Chesapeake Bay,USA[J]. J Shellfish Research,1993,12:21-27.
[16] 李静,石安静,李强.圆背角无齿蚌损伤后血细胞的吞噬活性[J].水产学报,2000,24(5):399-402.
[17] 杨军,石安静.不同条件下圆背角无齿蚌血细胞吞噬作用的研究[J].四川大学学报:自然科学版,2000,39:73-77.
Comparison of antibacterial activities and phagocytosis in freshwater mussel Hyriopsis cumingii with different pearl-cultivation age
XU Qiao-qing1,HAO Li-ping2
(1.Engineering Research Center of Wetland Agriculture in the Middle Reaches of the Yangtze River,Ministry of Education,Yangtze University, Jingzhou 434025,China;2.Hubei Information Engineering School,Jingmen 448124,China)
Plasma antibacterial activities to Staphyloccocus aureus,Micrococcus lysodeikticus,Aeromonas hydrophilia,and Escherichia coli and haemocyte phagocytosis to Staphyloccocus aureus were studied in freshwater mussel Hyriopsis cumingii with different ages.The result showed that there were higher antibacterial activities to Gram-positive bacilli(Micrococcus lysodeikticus and Staphylococcus aureus)than those to two Gram-negative bacilli(Escherichia coli and Aeromonas hydrophilia)in the 2-5 age mussels,the maximal antibacterial activity in 3-age mussel. The maximal haemocytes phagocytosis to Staphyloccocus aureus was observed in the 4-age mussels with the phagocytic rate of 36.6%and phagocytic index of 3.75 and the minimal in 2-age mussels with the phagocytic rate of 25. 2%and phagocytic index of 2.95.Those were attributed to the highest antibacterial activities and phagocytosis in 3 -4 age mussel and the highest capacity against external pathogens.However,the immune capacity was found to be declined with the increase in period of the pearl cultivation.
Hyriopsis cumingii;antibacterial activity;phagocytosis
Q959.215
A
2095-1388(2011)05-0442-04
2010-12-16
湖北省科技计划自然科学基金项目资助(ZRY2010)
许巧情(1976-),女,副教授。E-mail:xuqiaoqing@163.com
