单纯疱疹病毒1型US12基因siRNA筛选及其对病毒增殖的影响*
2011-03-17王巧利向阳飞王一飞胡巢凤戚仁斌陆大祥张庶民张佩琢
李 深, 任 哲,, 王巧利, 向阳飞, 王一飞△,胡巢凤, 戚仁斌, 陆大祥△, 张庶民, 张佩琢
(暨南大学1生物医药研究开发基地,2医学院病理生理学系,广东广州510632; 3中国药品生物制品检定所,北京100050;4上海吉玛制药技术有限公司,上海201203)
单纯疱疹病毒I型(herpes simplex virus 1,HSV-1)是一种双链DNA病毒,可引起口唇疱疹和疱疹型角膜结膜炎、单纯疱疹病毒性脑炎等许多感染性疾病[1]。病毒感染后可长期潜伏于人体的中枢神经系统,反复发作,给病人造成极大的痛苦与困扰[2]。虽然临床上抗HSV病毒药物种类繁多,但多为核苷类似物,毒副作用大,且存在停药后易反弹、易产生耐药突变株、不能完全抑制和清除潜伏的病毒等缺点。因此,寻找新的抗病毒治疗策略,已成为当今HSV感染后治疗的研究热点[3]。US12基因表达的立即早期蛋白ICP47所针对的是主要组织相容性复合体-I(major histocompatibility complexⅠ,MHC-Ⅰ)抗原呈递过程中决定抗原呈递效率的重要蛋白之一抗原肽转运蛋白(transporter of antigen peptides,TAP)。ICP47可以削弱TAP的肽转运功能,导致抗原递呈细胞表面MHC-I的表达量显著下降,直接干扰了MHC-I途径对细胞毒T细胞的激活,使感染的细胞逃脱了宿主的免疫清除,在病毒感染中起着重要作用[4]。
RNA干扰(RNAi)是一种古老的生物抗病毒机制,是由双链RNA(dsRNA)介导的、由特定酶参与的特异性基因沉默现象,它在转录水平、转录后水平和翻译水平上阻断基因的表达[5]。RNAi技术已经广泛应用于抗SARS、HIV、HBV病毒等的研究中,RNAi对RNA病毒或逆转录病毒能通过发挥降解病毒基因组及降解靶基因表达的mRNA产生双重抑制作用[6-9]。本实验以HSV-1病毒US12基因为研究对象,筛选有效沉默的siRNA,体外研究其对HSV-1感染的作用,为进一步应用RNAi技术在抗病毒方面的研究奠定基础。
材料和方法
1 材料
1.1 试剂 转染试剂LipofectamineTM2000、Trizol试剂、M-MLV First Strand Kit逆转录酶试剂盒(Invitrogen);SYBR Green PCR Master Mix、KOD-Plus高保真酶(Toyobo);限制性内切酶Pst I和HindⅢ、T4DNA连接酶(TaKaRa);US12克隆及检测引物、GAPDH检测引物(上海生工);其余试剂均为国产或进口。
US12克隆引物:上游引物5'-TATAAGCTTCCATGGTGATGTCGTGGGC-3',下游引物5'-TACCTGCAGTGTACAACGGGTTACCGGA-3'。US12检测引物:上游引物5'-TGGAAATGGCGGACACCT-3',下游引物5'-GTTACCGGATTACGGGGACT-3'。
1.2 细胞、病毒、质粒、菌种与培养基 pEGFP-N1质粒、DH5α菌株、HSV-1(F株,ATCC VR733)、Vero细胞(ATCC CCL81)均为本实验室保存;转染培养基为OPTI-MEM无血清培养基(Invitrogen);细胞生长液为含10%胎牛血清(四季青)的DMEM(Gibco)培养基;细胞维持液为含2%胎牛血清的DMEM培养基。
1.3 siRNA设计与合成 从GenBank中获取HSV-1F株US12基因mRNA序列,采用麻省理工学院在线siRNA设计工具搜寻潜在靶序列,并通过NCBI的BLAST Research考察潜在靶序列的二级结构以及同源性,最终得到3对siRNA。另设随机的不靶向任何基因的siN.C作为阴性对照。序列(表1)提交上海吉玛公司合成。siRNA干粉用DEPC水溶解后,得到浓度为40μmol/L的siRNA溶液。

表1 siRNA序列Table 1 .siRNA sequences
2 方法
2.1 pEGFP-N1-US12融合蛋白表达质粒构建HSV-1感染Vero细胞48 h后,Trizol抽提总RNA,逆转录合成cDNA第1链。以cDNA为模板,PCR扩增US12目的基因。反应体系含10×KOD-Plus buffer 5 μL,2 mmol/L dNTP 5 μL,2.5 mmol/L MgSO42.5 μL,10 μmol/L US12克隆引物上、下游引物各1.5 μL,cDNA 1μL,KOD-Plus 1 μL,DMSO 2.5 μL,无菌三蒸水30 μL。电泳检测PCR产物并回收US12片段。US12片段Pst I和HindⅢ双酶切后连接至pEGFP-N1质粒,转化DH5α感受态菌,挑选阳性克隆,重组质粒经菌液PCR和双酶切鉴定后,由Invitrogen公司测序。
2.2 pEGFP-N1-US12与siRNA共转染 Vero细胞以1×106cells/well密度植入6孔板,37℃、5% CO2培养箱内培养至细胞密度达到70% -80%,将pEGFP-N1-US12质粒(4 μg/well)与siRNA(100 pmol/well)用LipofectamineTM2000按照产品说明书混匀并加入转染培养液,同时设siN.C作阴性对照组;37℃、5%CO2培养箱处理4h后,吸弃转染培养液,PBS洗3遍后,加入DMEM生长液。24 h后荧光倒置显微镜(Olympus CKX41)观察融合蛋白表达情况,并用流式细胞仪(Bio-Rad)检测每孔平均荧光强度(MFI)和荧光表达平均阳性细胞率α,计算细胞总荧光强度(TFI),即TFI=10 000×MFI×α。与单转质粒对照孔细胞相比,定量分析每孔细胞US12-EGFP荧光相对表达强度(relative fluorescence intensity,RFI),确定siRNA对目的基因表达的抑制效率。
2.3 实时荧光定量PCR检测siRNA对感染细胞内US12 mRNA表达水平的影响 Vero细胞以2×105cells/well的密度植入12孔板,37℃、5%CO2培养箱内培养至细胞密度达到90%,转染siRNA 80 pmol/ well,接种HSV-1病毒(1MOI),12 h后,Trizol(Invitrogen)抽提总RNA,采用1μg总RNA进行逆转录。以US12检测片段作为标准模板,从1010-103拷贝范围作8个梯度稀释,用于绘制标准曲线。每个样品4个复孔。Choromo 4荧光定量PCR仪进行PCR扩增,使用SYBR Green I检测。
2.4 空斑减数实验 Vero细胞以1.5×105cells/ well的密度植入24孔板,37℃、5%CO2培养箱内培养至细胞密度达到90%,转染siRNA 80 pmol/well,转染方法如上。4 h后,将25-30PFU/well的病毒感染细胞,37℃吸附;1.5 h后,弃病毒液,每孔加入1mL空斑覆盖液(含有0.5%羧甲基纤维素的维持液)。37℃、5%CO2培养箱培养72 h后,吸弃培养基,10%甲醛溶液固定 20 min,1%结晶紫染色30 min,清水漂洗后,晾干,空斑计数。
结果
1 融合表达质粒pEGFP-N1-US12的鉴定
将PCR扩增的US12基因片段连接在pEGFPN1载体上,构建成重组质粒pEGFP-N1-US12,对pEGFP-N1-US12质粒和pEGFP-N1进行双酶切鉴定,双酶切鉴定结果如图1,pEGFP-N1-US12有2条电泳带约在4.7 kD和200 kD处,pEGFP-N1只有4.7 kD处1条条带,这与预期结果一致。测序结果证实目标序列与US12 cDNA序列一致。重组质粒转染Vero细胞,荧光正常表达,说明pEGFP-N1-US12重组质粒构建成功。
2 有效抑制HSV-1 US12基因siRNA筛选
共转染24 h后,荧光倒置显微镜观察(图2),siRNAS121和siRNAS122明显抑制了荧光的表达; siRNAS123一定程度抑制了荧光的表达;阴性对照siN.C对荧光表达无可见影响。
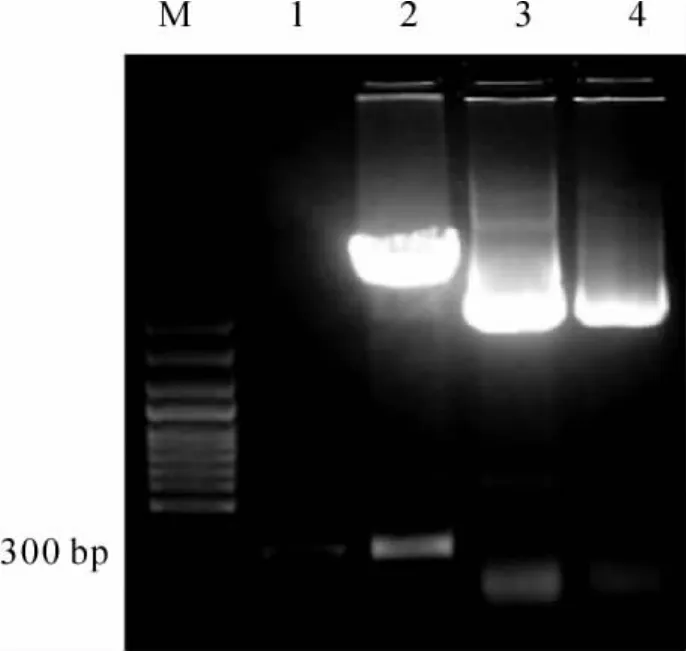
Figure 1.Restriction enzyme digestion analysis for pEGFP-N1-US12.M:100bp Plus marker;lane 1:US12 fragment;lane 2:pEGFP-N1-US12 digested by Pst I and HindⅢ;lane 3:pEGFP-N1-US12 plasmid; lane 4:pEGFP-N1 digested by Pst I and HindⅢ.图1 pEGFP-N1-US12双酶切鉴定
流式细胞仪检测,计算细胞总荧光强度。与单独转染p-EGFP-N1-US12质粒相比,siN.C阴性对照组无显著差异,见图3;siRNAS121、siRNAS122和siRNAS123实验组与p-EGFP-N1-US12组荧光强度有显著差异(P<0.01)。siRNAS121、siRNAS122和siRNAS123对US12基因的沉默效率分别为65.46%、66.26%和49.64%。
3 Real-time PCR检测siRNA抑制感染细胞内US12基因的表达
抽提病毒总RNA、逆转录获得cDNA,荧光定量PCR检测siRNA对感染细胞内US12基因表达的影响。US12检测引物与GAPDH检测引物分别对cDNA样品进行PCR扩增,SYBR Green I掺入法实时监测反应的产物量。Opticon Monitor 3软件生成标准曲线。各标准曲线的相关系数R2与斜率k符合理论值范围,线性关系良好,可以作为准确定量的依据。利用Opticon Monitor 3软件计算起始模板量,siRNAS121、siRNAS122和siRNAS123对细胞内US12基因表达抑制率分别为47.11%、67.47%和77.92%,与病毒对照组有显著差异(P<0.01),见图4。
4 siRNA对HSV-1在细胞内复制的影响
siRNA转染4 h后,感染病毒72 h后甲醛固定,结晶紫染色后观察空斑大小并计数,结果显示各实验组的空斑形成数与病毒对照均无显著差异(P>0.05),见图5。这表明所设计的siRNA对病毒胞间复制没有明显影响。
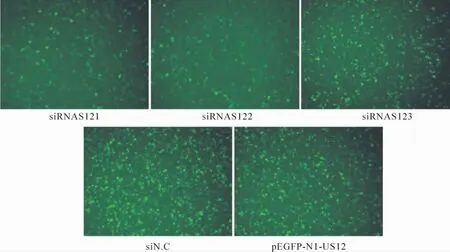
Figure 2.Specific down-regulation of US12-EGFP expression by different siRNAs(×40).图2 siRNA特异抑制US12-EGFP融合蛋白的表达

Figure 3.The relative expression of US12-EGFP protein after treatment with different siRNAs.±s.n=3.**P<0.01 vs pEGFP-N1-US12.图3 流式细胞仪检测US12-EGFP融合蛋白相对表达强度
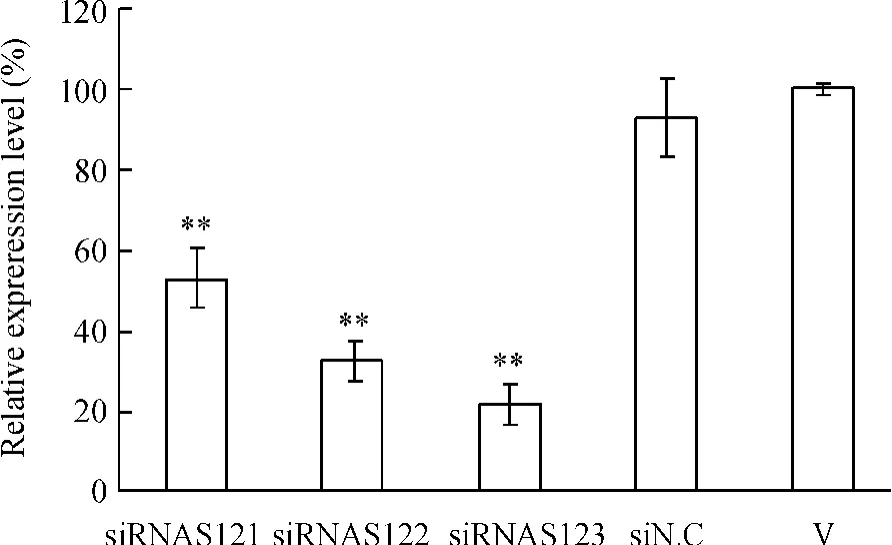
Figure 4.The change of US12 gene expression after different treatment analyzed by real-time PCR.±s.n=3.**P<0.01 vs V.V:virus control.图4 实时荧光定量PCR分析siRNA对细胞内US12基因表达的影响
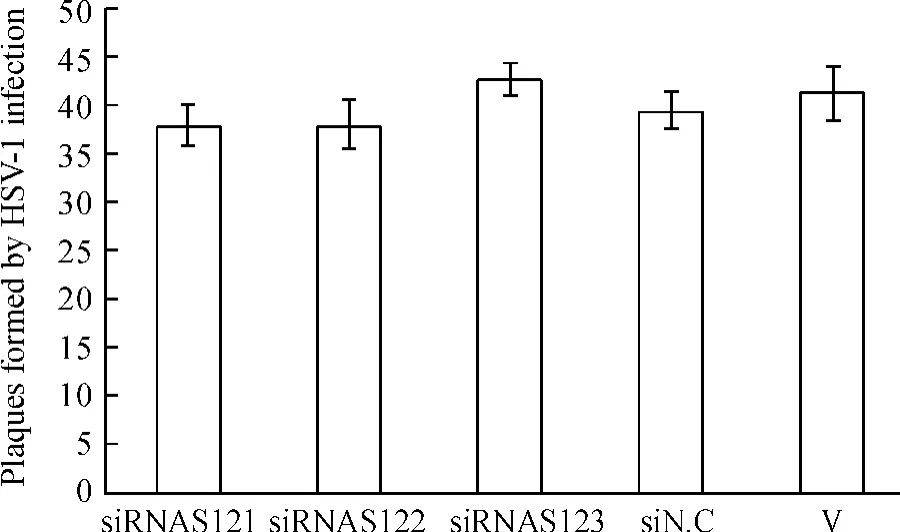
Figure 5.Plaques formed by HSV-1 in Vero cells treated with different siRNAs.±s.n=3.V:virus control.图5 siRNA对HSV-1空斑形成数的影响
讨论
HSV-1属α疱疹病毒亚科,为双链DNA病毒,基因组至少编码70多个蛋白,按表达时序可分为α、β和γ 3类;可引起严重疾病如口唇疱疹、疱疹性脑炎、结膜炎、脑膜炎等,出现高热、头痛、呕吐、意识障碍等临床症状、甚至造成死亡。立即早期基因US12编码ICP47蛋白,由88个氨基酸组成。ICP47蛋白结构中没有构成二级结构的元件,且在水溶液中无特有的折叠构象;但是ICP47自身具有膜结合能力,尽管该结合力比TAP存在时要弱约300倍,但是这种膜结合能力的存在很可能有利于ICP47局部浓度的提高,并且折叠成能有效结合TAP的构象,成为ICP47与TAP高亲和力结合的必要条件[11]。ICP47可以与TAP结合,削弱TAP的肽转运功能,导致空载MHC-I分子出现,干扰了MHC-I途径对细胞毒T淋巴细胞的激活,使感染细胞逃脱了宿主的免疫清除,甚至成为病毒在体内的储备库及传播者。
RNA干扰技术已经广泛应用于抗病毒研究中,对许多病毒尤其是RNA病毒或逆转录病毒有较好的抗病毒效果,而对DNA病毒RNA干扰的相关研究较少。本实验室任哲等[10]构建了人 HSV-1 UL40基因融合表达载体pEGFP-N1-UL40,并成功筛选出高效沉默人HSV-1 UL40基因的siRNA。朱钦昌等[12]利用所构建的pEGFP-N1-gD融合表达载体筛选出高效沉默HSV-gD蛋白基因的siRNA并进一步运用于抗HSV-1的研究中。本文在任哲等工作的基础上,针对HSV-1 UL12基因设计siRNA,研究干扰UL12基因对HSV-1病毒的影响。我们的结果显示,所设计的3对靶向UL12基因的siRNAs均能特异性沉默US12 mRNA的表达,但对HSV-1病毒空斑的形成没有明显影响。我们的结果表明,UL12基因与HSV-1病毒的体外增殖可能没有直接的相关性。推测UL12作为HSV-1病毒免疫逃逸的关键基因,其编码的ICP47蛋白主要通过参与体内免疫应答反应而影响病毒增殖。本研究针对特异性沉默UL12基因的siRNAs的成功筛选,为进一步进行干扰UL12基因体内抗病毒研究提供了新的思路和有效的工具。
(致谢:感谢上海吉玛制药技术有限公司对本研究的大力支持。)
[1] Arduino PG,Porter SR.Simplex virus type 1 infection:overview on relevant clinic-pathological feature herpes[J].J Oral Pathol Med,2008,37(2):107-121.
[2] Yarom N,Buchner A,Dayan D.Herpes simplex virus infection:part I-Biology,clinical presentation and latency[J].Refuat Hapeh Vehashinayim,2005,22(1):7-15,84.
[3] Brady RC,Bernstein DI.Treatment of herpes simplex virus infections[J].Antiviral Res,2004,61(2):73-81.
[4] 洪 敏,李卫中,李琦涵.单纯疱疹病毒Ⅰ型免疫逃避机制—ICP47抑制抗原加工相关转运蛋白[J].病毒学报,2007,23(1):72-75.
[5] Elbashir SM,Harborth J,Lendeckel W,et al.Duplexes of 21-nucleotide RNAs mediated RNA interference in cultured mammalian cells[J].Nature,2001,411(6836): 494-498.
[6] Capodici J,Kariko K,Weissman D.Inhibition of HIV-1 infection by small interfering RNA-mediated RNA interference[J].J Immunol,2002,169(9):5196-5201.
[7] Boden D,Pusch O,Ramratnam B.HIV-1-specific RNA interference[J].Curr Opin Mol Ther,2004,6 (4):373-380.
[8] Zhang XN,Xiong W,Wang JD,et al.siRNA-mediated inhibition of HBV replication and expression[J].World J Gastroenterol,2004,10(20):2967-2971.
[9] Zhao P,Qin ZL,Ke JS,et al.Small interfering RNA inhibits SARS-CoV nucleocapsid gene expression in cultured cells and mouse muscles[J].FEBS Lett,2005,579 (11):2404-2410.
[10] 任 哲,张美英,王一飞,等.人HSV-1 UL40基因重组质粒的构建及其在siRNA筛选中的应用[J].中国病理生理杂志,2007,23(12):2444-2447.
[11] Ahn K,Meyer TH,Uebel S,et al.Molecular mechanism and species specificity of TAP inhibition by herpes simplex virus ICP47[J].EMBO J,1996,15(13):3247-3255.
[12] 朱钦昌,任 哲,张春龙,等.siRNA干扰HSV-1 gD糖蛋白基因的研究[J].病毒学报,2007,23(1):22-27.
