光照及营养盐对3种赤潮甲藻吞噬营养行为的影响
2011-03-14
(暨南大学 赤潮与水环境研究中心,广东 广州 510632)
近年来,越来越多过去被认为完全依赖光合自养的甲藻被证实具有吞噬功能而成为混合营养生物[1-2]。吞噬营养可能是甲藻一项重要的生理生态适应策略,有利于甲藻在不断变化的环境条件下保持营养竞争优势,尤其是在藻类受到光强或营养盐限制无法光合自养时,吞噬营养可作为获取有机碳或主要限制性营养盐的补充途径[3-5]。混合营养策略在甲藻赤潮的形成及发展过程中可能发挥重要作用,开展赤潮甲藻吞噬营养行为的研究有助于深入了解赤潮甲藻的营养竞争策略机制,解释某些甲藻赤潮在低营养盐浓度下爆发和长时间维持的机制[4-6]。
东海原甲藻(Prorocentrum donghaiense)、米氏凯伦藻(Karenia mikimotoi)和链状亚历山大藻(Alexandrium catenella)是中国东海主要的赤潮原因种[7]。本论文以人工培养的活体藻类和荧光标记藻类(FLA)为饵料,研究实验室不同光照及营养盐条件下3种目标甲藻的吞噬营养行为,并与东海原甲藻赤潮发生现场围隔实验中获得的东海原甲藻的吞噬营养数据进行比较,分析3种赤潮甲藻的营养模式,初步探讨吞噬营养模式对 3种赤潮甲藻获取营养的重要性。
1 材料和方法
1.1 实验材料及培养条件
米氏凯伦藻、链状亚历山大藻、东海原甲藻及饵料藻球等鞭金藻(Isochrysis galbana)、骨条藻(Skeletonemasp.)、旋转海链藻(Thalassiosira curviseriata)、亚心形四爿藻(Platymonas subcordiformis)、赤潮异弯藻(Heterosigma akashiwo)、微小原甲藻(Prorocentrum minimum)来自暨南大学赤潮与水环境研究中心藻种库。按照低/富营养盐条件设计将目标甲藻长期用灭菌f/8或f/2培养基培养,饵料藻则都用灭菌 f/2培养基培养,在藻类培养至指数生长期时加入抗生素抑菌。培养条件为:光暗周期 L :D= 12 :12,光照 60 μE/(m2·s),温度 20℃ ± 1 ℃。采用Retiga 4000R图像分析系统,按照细胞的宽度和深度相等的原则[8],根据 Hillebrand[9]建立的公式计算细胞体积,并将体积转换成单位细胞碳含量[10]。
按Rublee &Gallegos的方法制备FLA[11]。包括有荧光标记的球等鞭金藻(FLIg)、骨条藻(FLS)及旋转海链藻(FLTc),冷冻保存备用。
1.2 有/无光照及低/富营养盐条件下3种赤潮甲藻对活体饵料藻的摄食
将3种目标甲藻分别接种至f/2(富营养)及f/8(低营养)培养基中,待目标甲藻生长至指数生长期,取10mL目标甲藻到50 mL的锥形瓶,根据碳生物量相当的原则,分别加入一定数量处于指数生长期的 3种饵料藻进行混合培养,若未发现甲藻吞噬行为,则相对提高添加的饵料藻浓度(表1)。其中一组实验在正常光照条件下进行,另一组则采用黑暗培养,每组两个平行,4~6 h后,取一定体积的藻液,在正置荧光显微镜(Olympus BX61)的明场模式下观察甲藻是否有摄食现象,并计算摄食入细胞内的饵料藻的数目,每个样品观察细胞数>200个。采用图像分析系统拍摄有吞噬营养行为的目标甲藻。实验中,采用 DAPI(4’ 6’- diamidino- 2- phenylindole)染色样品,在荧光显微镜紫外激发光波段(Ex= 306~370 nm,Em>420 nm)下观察,基本排除细菌的影响。
1.3 有/无光照及低/富营养盐条件下3种赤潮甲藻对FLA的摄食
取10 mL上述f/2和f/8培养基中培养的目标甲藻到 50 mL的锥形瓶(目标甲藻的起始浓度如表1),分别向实验瓶中添加FLIg、FLS和FLTc(f/2培养条件下饵料藻的终密度分别为2×106,0.8×106和1×106个/ mL,f/8低营养条件下FLA的添加量减半),同样设置两组实验,一组是在正常光照下培养,另一组实验黑暗培养,每组设两个平行。4~6 h后,分别取一定体积的藻液,在荧光显微镜的明场及蓝光波段(Ex= 460~495 nm,Em>510 nm)下切换观察目标甲藻是否具有摄食行为,并计算摄食入甲藻细胞里的FLA个数,观测细胞数>200个。实验中,采用DAPI染色样品,在荧光显微镜紫外激发光波段下观察,基本排除细菌的影响。

表1 实验藻种的体积、碳含量及起始密度Tab.1 Volume,carbon biomass,and initial concentrations of species tested
1.4 东海赤潮高发区现场船基围隔实验中东海原甲藻对荧光标记藻类的摄食
2010年春季,在东海长江口邻近海域发生了大面积的东海原甲藻赤潮。5月11日,取东海原甲藻赤潮中心区域 Rb16 测站(123°17.95′ E,30°1′ N)的表层海水进行现场船基围隔实验,实验周期为10天。共设 6个围隔袋(M1~M6),每个围隔袋水体积大约为700 L,其中M1为对照袋,M2、M3及M6在实验起始时一次性加入不同浓度的硝酸盐(NO3- N)、磷酸盐(PO4- P)和尿素,M4和M5则是每天早上8:30分次加入营养盐(如表2所示)。实验期间,利用水泵将现场海水抽入帆布袋内作为循环水,以保持围隔袋内水温与现场海水一致。在现场每天测定围隔袋中的 Chla值,分别在实验进行的第2、5和 8天(分别代表东海原甲藻藻华的指数生长期、平稳期、衰亡期)进行东海原甲藻对FLA的摄食实验。
取500 mL水样,经120 μm筛绢过滤后分装到3个300 mL的聚乙烯瓶中,置于现场表层海水的水浴中培养 30 min,使瓶中温度接近于表层海水水温,分别在瓶中加入 FLIg和 FLTc(终密度约为 2.0×104个/mL),另外一组不加 FLA作对照,黑暗中培养4 h。取20 mL样品,依次加入鲁格试剂(终浓度0.5%)、福尔马林(终浓度 3 %)及硫代硫酸钠溶液(终浓度0.1 %)进行固定[12]。放在4 ℃冰箱保存4 h使细胞变硬。
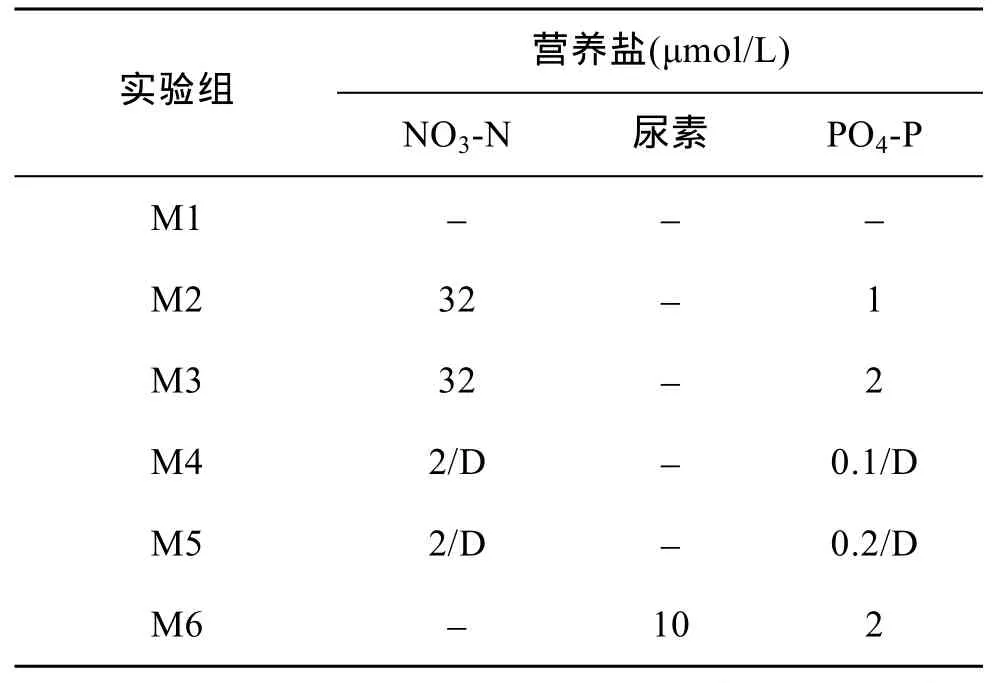
表2 围隔实验中添加的营养盐量Tab.2 Concentrations of nutrients added in mesocosms
在低负压条件下将样品过滤至8 μm孔径的黑膜上。在样品快过滤完时,加入1 mL的DAPI,终浓度为25 mg/L,摇匀,黑暗培养10 min,将藻液滤干。滤膜在-20 ℃冷冻保存,带回实验室镜检。观察时先在荧光显微镜的紫外波段下确定为东海原甲藻,在蓝光激发波段下观测原甲藻是否存在吞噬FLA的现象。
2 结果与分析
2.1 有/无光照及低/富营养盐条件下3种赤潮甲藻对活体饵料藻的摄食
无论是在富营养的 f/2培养基还是低营养的 f/8培养基,也无论是正常光照条件还是黑暗条件,在添加入活体饵料藻的4~6 h后,在显微镜下观测到3种目标甲藻的生理活性良好,在显微镜视野下快速游动。
在不同培养条件的实验组中,分别跟踪观测混合培养的 3种目标甲藻的摄食行为。但仅在富营养的f/2及正常光照条件下,观测到1个游动中的米氏凯伦藻细胞内部摄食有 2个球等鞭金藻,在黑暗及低营养条件下未发现目标甲藻有吞噬营养行为,表明米氏凯伦藻具有吞噬营养行为,但发生摄食的概率极低,是一偶然现象。增大饵料藻的密度,未观测到3种目标甲藻的吞噬营养行为。
2.2 有/无光照及低/富营养盐条件下3种赤潮甲藻对FLA的摄食
无论是何种培养条件,添加入 FLIg、FLS和FLTc的4~6 h后,在显微镜下观测到东海原甲藻、链状亚历山大藻和米氏凯伦藻在视野下快速游动,表明生理状态良好。
研究结果发现,富营养的 f/2培养基条件下,链状亚历山大藻在正常光照及黑暗下均有摄食FLTc的现象,观察>200个细胞,仅各观测到1个游动的链状亚历山大藻细胞摄食2~3个FLTc,表明摄食概率低。实验中未观测到链状亚历山大藻对FLIg和FLS的摄食,也未观测到东海原甲藻或米氏凯伦藻对FLA的任何摄食。
低营养的 f/8培养基中,无论是正常光照还是黑暗条件下,均未观测到3种目标甲藻对FLA的摄食。
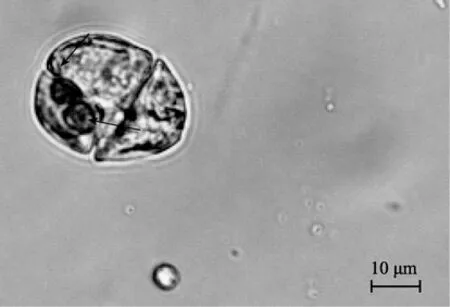
图1 游动中的米氏凯伦藻摄食活体球等鞭金藻Fig.1 A swarming Karenia mikimotoi ingested two live Isochrysis galbana

图2 荧光显微镜下链状亚历山大藻对荧光标记海链藻的摄食Fig.2 The ingestion of fluorescent labeled Thalassiosira curviseriata by Alexandrium catenella under epifluorescence microscopy
2.3 东海赤潮高发区现场船基围隔实验中东海原甲藻对FLA的摄食
实验早期,6个围隔袋中均发现东海原甲藻对FLIg的摄食;而仅在未添加营养盐的 M1和每天仅添加微量营养盐的 M4中,发现东海原甲藻对 FLS具有摄食(表3)。东海原甲藻摄食FLIg的数量为1~4个,而一般只摄食1个FLS(图3),这可能与多数骨条藻为长链结构,较难吞噬有关。在观测的500个细胞中,仅 2~7个东海原甲藻细胞具有摄食行为,摄食概率0.4%~1.4 %。
而在实验的中后期,即东海原甲藻藻华的发展及衰亡阶段,各围隔袋中均未观测到东海原甲藻的摄食行为。

表3 围隔实验中东海原甲藻对荧光标记藻类的摄食Tab.3 Feeding occurrences of Prorocentrum donghaiense on fluorescent labeled Isochrysis galbana (FLIg) and Skeletonema sp.(FLS)

图3 荧光显微镜下东海原甲藻对荧光标记金藻(a)和骨条藻(b)的摄食Fig.3 The ingestion of fluorescent labeled Isochrysis gallbana (a) and Skeletonema sp.(b) by Prorocentrum donghaiense under epifluorescence microscopy
3 讨论
在室内实验中,首次发现米氏凯伦藻对球等鞭金藻,链状亚历山大藻对旋转海链藻具有摄食行为;且通过现场船基围隔实验,发现东海原甲藻在赤潮发生时,对荧光标记的球等鞭金藻和骨条藻具有摄食行为,这一结果丰富了赤潮甲藻的吞噬营养行为的研究。此前,尚未见米氏凯伦藻吞噬营养行为方面的任何报道。有研究认为链状亚历山大藻具有食物泡结构且能摄食细菌、蓝细菌等原核生物,为混合营养生物[13-14],但报道链状亚历山大藻摄食真核生物尚属首次。东海原甲藻和中肋骨条藻是东海海区的两个重要的赤潮藻种[15-16],Yoo等[17]在实验室内发现,东海原甲藻能摄食中肋骨条藻(Skeletonema costatum)。本文首次在东海原甲藻赤潮发生现场,观测到东海原甲藻对球等鞭金藻和骨条藻的摄食。
Jeong的研究团队认为,多数自养甲藻都可能具有吞噬营养的行为和能力,且这种吞噬行为非常普遍[17-18]。其研究结果表明,处于指数生长期的东海原甲藻、海洋原甲藻在富营养的f/2条件下对中肋骨条藻的摄食率可分别达到 0.5和 3.1 cells/(dinoflagellate·d)[17]。然而,从本室内研究发现,无论是在黑暗或是在营养盐胁迫的条件下,3种目标甲藻的摄食概率都非常低。虽然不排除目标甲藻对饵料藻的种类及粒径的选择性问题[19-20](本文选取不同门类、易被摄食的较小粒径及海区常见种类),本研究结果认为目标甲藻虽具有吞噬营养的行为及能力,但主要还是依赖光合自养方式获取营养盐。也可能存在一种解释就是,在室内长期富营养和光照充足的培养条件下,目标甲藻的吞噬营养能力已经减弱甚至丧失,造成实验中对甲藻吞噬行为及其重要性的低估。
围隔实验中东海原甲藻摄食概率数据支持了室内研究的结果。实验前期,东海原甲藻可以摄食FLIg和 FLS,但是发生摄食的概率仅达到 0.4%~1.4 %,表明即使在营养盐胁迫的条件下,光合自养仍然是东海原甲藻主要获取营养盐的方式。有趣的是,在围隔实验的中后期,东海原甲藻在营养盐胁迫加重的情况下,却未发生摄食行为,该原因是否与不同生长时期东海原甲藻具有不同的营养竞争模式及策略,或一旦进入人工培养状态甲藻即丧失吞噬营养行为有关,尚有待进一步研究。
4 结论
在富营养的正常光照条件下,观测到 1个米氏凯伦藻摄食球等鞭金藻;在富营养培养的正常光照及黑暗条件下,各观测到 1个链状亚历山大藻摄食旋转海链藻。2010年5月,在东海原甲藻赤潮发生现场的船基围隔实验中,前期发现东海原甲藻能摄食球等鞭金藻及骨条藻,但发生摄食的概率也仅为0.4%~1.4%,且随着培养时间的延长吞噬行为消失。该研究结果表明,虽然东海原甲藻、米氏凯伦藻和链状亚历山大藻具有吞噬营养行为,为混合营养生物。但无论是在黑暗或是营养饥饿的条件下,3种目标藻发生吞噬营养的概率都非常低,是属于主要依赖光合自养获取营养的种类。
致谢:现场围隔实验获得国家海洋局第一海洋研究所孙萍老师的大力帮助,在此表示诚挚感谢。
[1]Glibert P M,Burkholder J M,Kana T M,et al.Grazing byKarenia brevisonSynechococcusenhances its growth rate and may help to sustain blooms [J].Aquatic Microbial Ecology,2009,55:17-30.
[2]Jeong H J,Yoo Y D,Kim J S,et al.Growth,Feeding and ecological roles of the mixotrophic and heterotrophic dinoflagellates in marine planktonic food webs [J].Ocean Science Journal,2010,45(2):65-91.
[3]Skovgaard A,Hansen P J,Stoecker D K.Physiology of the mixotrophic dinoflagellateFragilidium subglobosum.I.Effects of phagotrophy and irradiance on photosynthesis and carbon content [J].Marine Ecology Progress Series,2000,201:129-136.
[4]Stoecker D,Tillmann U,Granéli E.Phagotrophy in harmful algae [C]// Granéli E,Turner J T.Ecology of Harmful Algae.Berlin:Springer-Verlag,2006:189:177-187.
[5]Burkholder J M,Glibert P M,Skelton H M.Mixotrophy,a major mode of nutrition for harmful algal species in eutrophic waters [J].Harmful Algae,2008,8:77-93.
[6]Smayda T J,Reynolds C S.Strategies of marine dinoflagellate survival and some rules of assembly [J].Journal of Sea Research,2003,49:95-106.
[7]周名江,朱明远.我国近海有害赤潮发生的生态学、海洋学机制及预测防治研究进展 [J].地球科学进展,2006,21(7):673-679.
[8]Verity P G,Robertson C Y,Tronzo C R,et al.Relationships between cell volume and the carbon and nitrogen content of marine photosynthetic nanoplankton [J].Limnology and Oceanography,1992,37:1434-1446.
[9]Hillebrand H,Duerslen D,Kirschtel U,et al.Biovolume calculation for pelagic and benthic microalgae[J].Journal of Phycology,1999,35:403-424.
[10]Deuer M S,Lessard E J.Carbon to volume relationships for dinoflagellates,diatoms,and other protist plankton [J].Limnology and Oceanography,2000,45(3):569-579.
[11]Rublee P A,Gallegos C L.Use of fluorescently labelled algae(FLA) to estimate microzooplankton grazing [J].Marine Ecology Progress Series,1989,51:221-227.
[12]Sherr F B,Sherr E B,PedrosAlio C.Simultaneous measurement of bacterioplankton production and protozoan bacterivory in estuarine water [J].Marine Ecology Progess Series,1989,54:209-219.
[13]Jeong H J,Park J Y,Nho J H,et al.Feeding by red-tide dinoflagellates on the cyanobacteriumSynechococcus[J].Aquatic Microbial Ecology,2005,41:131-143.
[14]Jeong H J,Yoo Y D,Park J Y,et al.Feeding by phototrophic red-tide dinoflagellates:five species newly revealed and six species previously known to be mixotrophic [J].Aquatic Microbial Ecology,2005,40:133-150.
[15]赵冉,孙军,白洁.2006年秋季长江口及其邻近水域浮游植物群集 [J].海洋科学,2010,34(4):32-39.
[16]邓光,耿亚洪,胡鸿钧,等.几种环境因子对高生物量赤潮甲藻—东海原甲藻光合作用的影响 [J].海洋科学,2009,33(12):34-39.
[17]Yoo Y D,Jeong H J,Kim M S,et al.Feeding by Phototrophic red-tide dinoflagellates on the ubiquitous marine diatomSkeletonema costatum[J].Journal of Eukaryotic Microbiology,2009,56(5):413-420.
[18]Jeong H J,Park J Y,Nho H J,et al.Feeding by red-tide dinoflagellates on the cyanobacteriumSynechococcus[J].Aquatic Microbial Ecology,2005,41:131-143.
[19]Jeong H J,Yoo Y D,Seong K A,et al.Feeding by the mixotrophic red-tide dinoflagellateGonyaulax polygramma:mechanisms,prey species,effects of prey concentration,and grazing impact [J].Aquatic Microbial Ecology,2005,38:249-257.
[20]Sheng J,Malkiel E,Katz J,et al.A dinoflagellate exploits toxins to immobilize prey prior to ingestion [J].PNAS,2010,107(5):2082-2087.
