木糖发酵产乙醇丝状真菌的鉴定及发酵特性
2011-03-12范金霞
范金霞,杨 谦,姚 琳,陈 刚
(哈尔滨工业大学生命科学与工程系,150001哈尔滨,yangq@hit.edu.cn)
燃料乙醇因其污染小、具有环境友好型的特点,成为新型燃料资源有望取代日益减少的化石能源(如石油和煤炭)[1].传统乙醇发酵原料为玉米、淀粉等粮食作物,粮食短缺的今天这一生产方式受到很大的限制.木质纤维素物质(如农作物废弃物、木屑、薯渣等)是世界上最为丰富的生物质资源[2],由纤维素、半纤维素和木质素组成,其水解产物主要是葡萄糖和木糖.酿酒酵母(Saccharomyces cerevisiae)能发酵葡萄糖但不能发酵木糖产生乙醇.80年代以来,众多的学者进行了木糖菌种的筛选以及菌种遗传工程改造研究,木糖发酵微生物主要集中在毕氏酵母(Pichia),假丝酵母(Candida)和管囊酵母(Pachyso1en)3个属[3],构建基因重组菌常用的宿主菌种有酿酒酵母(S.cerevisiae)、运动发酵单胞菌(Zymomonas mobilis)和大肠杆菌(E. coli)[4-6],对丝状真菌的木糖发酵研究的很少.本试验从自然界中筛选到一株丝状真菌发酵木糖产乙醇的菌株,对其进行了形态学和分子生物学鉴定,同时对其发酵特性进行了研究.
1 试验
1.1 试验材料
1.1.1 试验菌种
cs-28由本试验室分离,现已送至中国典型微生物研究所保存.E.coli Top10为本实验室保存.树干毕赤酵母(Pichia stipitis)来自中科院微生物研究所.
1.1.2 试剂
Taq DNA聚合酶、dNTP、pMD-18T载体、DNAMarker(DL2000)购自宝生物工程(大连)有限公司;胶回收试剂盒购自上海华舜生物公司,引物合成和测序由上海生工生物技术有限公司完成;木糖购自美国Sigma公司;其他试剂均为国产分析纯试剂.
1.1.3 培养基
初筛培养基(PXA):马铃薯200 g·L-1,木糖20 g·L-1,琼脂20 g·L-1,pH值自然.
复筛培养基:木糖2%,酵母粉0.4%,蛋白胨0.2%,(NH4)2SO40.6%,KH2PO40.2%,MgSO4·7H2O 0.2‰,CaCl20.1‰.
发酵培养基:KH2PO40.2%,MgSO4·7H2O 0.2‰,CaCl20.1‰,碳源2%,氮源1.2%.
种子培养基(PX培养基):马铃薯200 g· L-1,木糖20 g·L-1,pH值自然.
PDA培养基:马铃薯200 g·L-1,葡萄糖20 g ·L-1,琼脂20 g·L-1.
1.2 试验方法
1.2.1 菌种分离,纯化和筛选
取1 g采集的土样溶于10 mL无菌水中30℃振荡1 h,经适当稀释后,涂布于PXA平板上,30℃恒温培养48 h;挑取生长较快菌落,经多次分离纯化,将获得的丝状真菌纯培养物保存.纯化后的单菌落经复筛培养基进行杜氏管发酵试验进一步筛选,最后利用发酵培养基进行乙醇质量浓度的测定,挑选出乙醇产量最高的菌株作为下一步研究对象.
1.2.2 菌种鉴定
形态学鉴定参考文献[7].分子生物学鉴定根据18S rRNA ITS序列引物:T1:5'-TCC GTA GGT GAA CCT GCG G-3',T2:5'-TCC TCC GCT TAT TGA TAT GC-3'.基因组DNA提取参见文献[8]方法进行.PCR反应体系:所有PCR反应均在20 μL标准反应体系中进行,其中含2 μL Buffer缓冲液,1.6 μL 2.5 mmol/L dNTPs,每一引物均1 μL(10 mmol/L),0.125 μL Taq酶,1 μL模板DNA,加无菌超纯水至20 μL,于PCR仪上按94℃预变性5 min,然后按94℃、30 s,56℃、30 s,72℃、1 min,循环32次,最后72℃延伸10 min.PCR产物的克隆测序:按照胶回收试剂盒说明回收目的片段,连接克隆载体,转化大肠杆菌感受态细胞Top10,提取质粒DNA,双酶切鉴定后,挑取阳性克隆子送至上海生工生物技术有限公司进行测序.测序结果利用NCBI网站的Blastn和DNASTAR进行序列比较分析.
1.3 分析方法
乙醇产量测定采用重铬酸钾比色法[9].木糖质量浓度测定采用DNS比色法[10].
1.4 发酵特性研究
1)不同碳源对乙醇产量的影响.选取12种不同的碳源,按质量比2%加入到发酵培养基中.
2)不同氮源对乙醇产量的影响.选择12种不同的氮源,按质量比1.2%加入到培养基中,以2%的木糖作为碳源,获得最佳氮源.
3)初始pH值对乙醇产量的影响.用盐酸调节发酵培养基的初始pH值,分别为5.0、5.2、5.4、5.8、6.0、6.2,确定最佳的发酵酸碱条件.
4)不同温度对乙醇产量的影响.将接种后的液体培养基分别放在20、24、26、28、30、32、34、36℃的培养箱中静止培养,比较温度对产乙醇的影响.
5)不同初始木糖质量浓度对乙醇产量的影响:在发酵培养基中加入质量比分别为2%、3%、4%、5%、6%、7%、8%、9%、10%的木糖进行发酵,比较乙醇产量.
2 结果与分析
2.1 菌种的分离,筛选和鉴定
2.1.1 菌种的分离与筛选
通过对30份土样中筛选得到能在PXA培养基上生长的菌株58株,利用杜氏管发酵检测到16种菌株能产气,对其进行发酵试验,测定乙醇产量,得到一株产乙醇量最高的菌株cs-28.通过cs-28与树干毕赤酵母乙醇产量的比较可以看出,cs-28最高乙醇产量在发酵的第144小时,而树干毕赤酵母在第96小时,cs-28产乙醇的周期比树干毕赤酵母长,但乙醇产量高于毕赤酵母(图1).
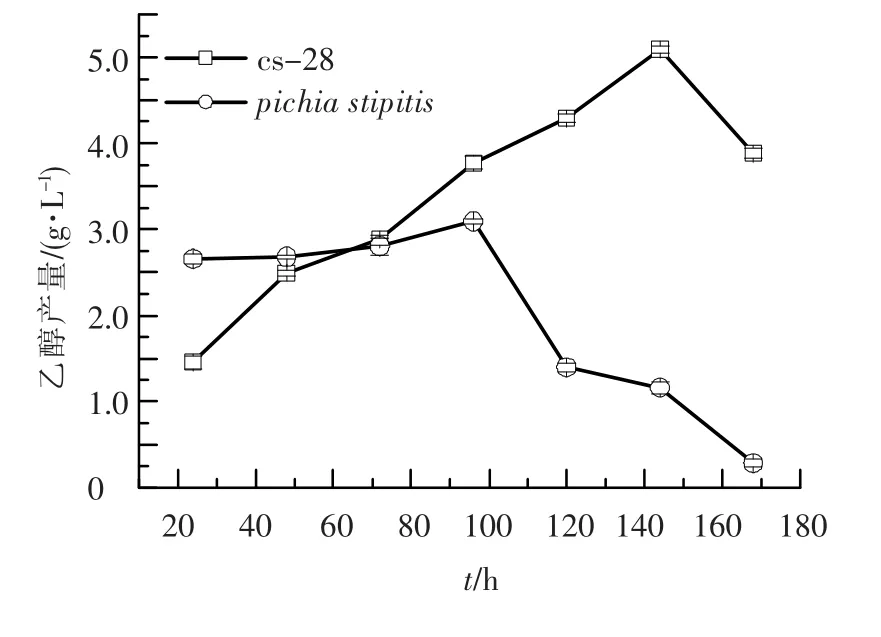
图1 cs-28与树干毕赤酵母乙醇产量的比较
2.1.2 形态学鉴定
将cs-28放在PDA培养基上培养.该菌株在培养2 d后菌落直径超过2.5 cm,7 d达8~9 cm;在室温(25℃)下,菌丝生长良好,棉絮状至绒毛状,最初白色,逐渐中央粉色,后期转变为紫色,培养基反面深紫色(图2).菌丝经棉兰染色后显微镜观察结果:菌丝有隔,分枝,透明;有大小两种类型分生孢子(图3(a)),小型分生孢子数量较多,从菌丝的侧生而单出的瓶状小梗上长出或从分生孢子梗上长出,不呈链生而是假头状着生,椭圆形、纺锤形、卵形、逗点形;大型分生孢子时常较少,产于粘孢团中或从分孢子梗上长出;镰刀形、纺锤形;顶端细胞窄细;有隔,3~6个分隔(图3(b)).

图2 cs-28在PDA培养基中生长7 d的菌落形态
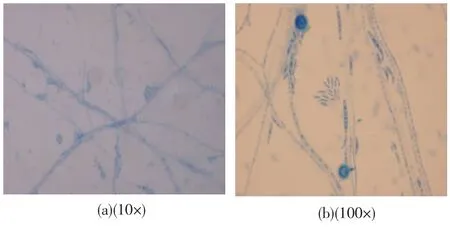
图3 cs-28孢子的显微观察
2.1.3 分子生物学鉴定
以cs-28基因组DNA为模板,应用真菌通用的18s rRNA引物进行PCR扩增,得到大约500 bp片段(图4),将目的片段连接克隆载体pMD-18T后进行测序.利用DNASTAR软件队测序结果进行处理后,获得了535 bp核苷酸序列.通过NCBI网站上Blastn(http://blast.ncbi.nlm. nih.gov/Blast.cgi)进行相似性搜索,结果显示与Fusarium oxysporum的相似性为100%,结合形态学观察结果可以确定该菌株为尖孢镰刀菌(Fusarium oxysporum).
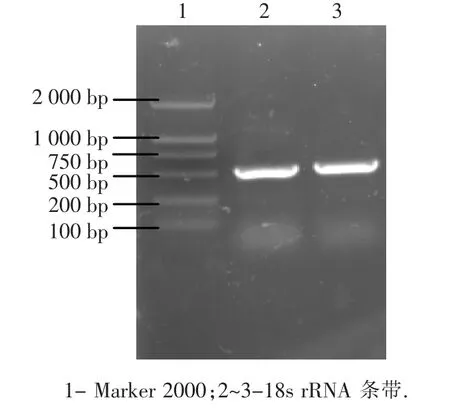
图4 cs-28 18s rRNA片段扩增结果
2.2 发酵特性
2.2.1 不同碳源对乙醇发酵的影响
选取12种不同的碳源进行发酵试验,结果见图5,cs-28对蔗糖、葡萄糖发酵产乙醇能力最强,对乳糖的发酵能力最弱.对12种碳源均有不同程度的乙醇发酵能力,其碳源应用谱广泛,有望成为工业发酵待选菌种.
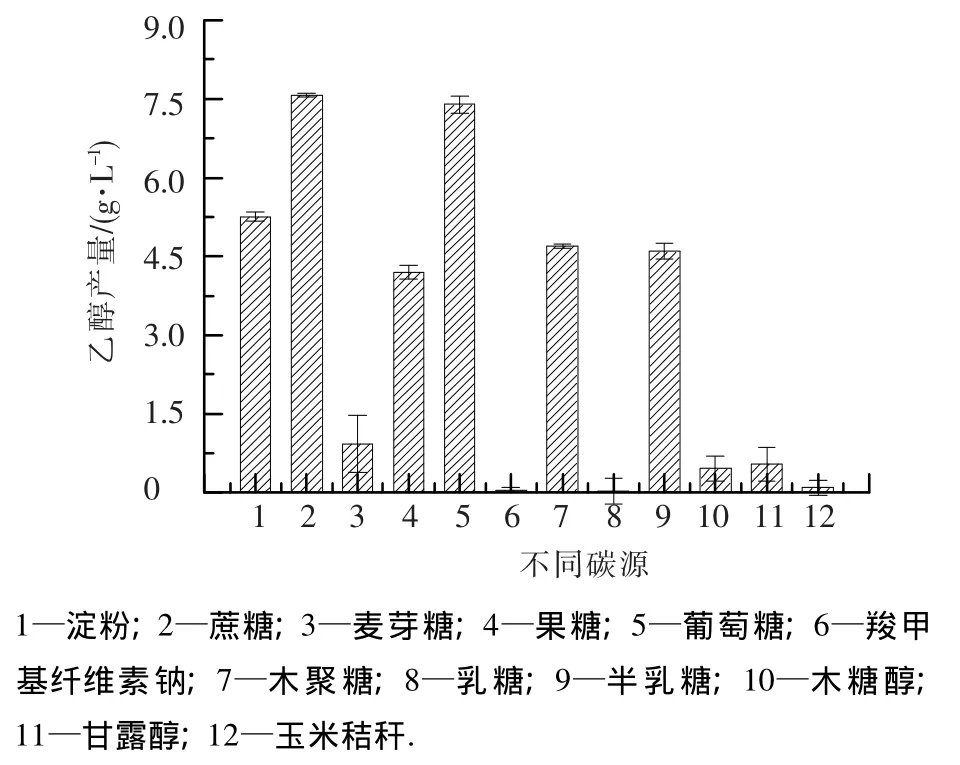
图5 不同碳源对cs-28乙醇产量的影响
2.2.2 不同氮源对乙醇发酵的影响
不同氮源对cs-28发酵产乙醇的试验结果见图6.可以看出,有机氮源比无机氮源产乙醇的量高.在有机氮源中yeast extract的产乙醇量最高,达4.28 g·L-1,与黄豆面发酵效果持平,考虑到发酵成本,以下的发酵试验中采用黄豆面作为氮源.在无机氮源中,硝态氮比铵态氮效果好.其中NaNO3的发酵效率最高,达2.61 g·L-1.
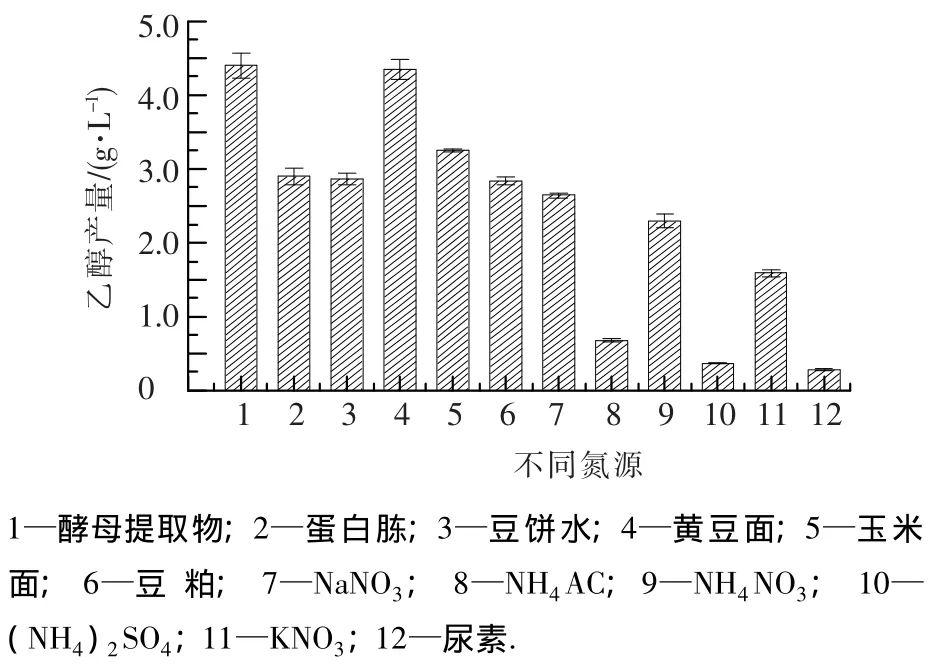
图6 不同氮源对cs-28乙醇产量的影响
2.2.3 不同温度对乙醇发酵的影响
温度对乙醇发酵的影响很大,温度过高会增加乙醇的蒸发,温度过低影响菌体生长,从而影响乙醇产量.试验结果(图7)表明:随着温度的升高,乙醇产量逐渐升高,温度为30℃时乙醇产量最高,随后逐渐下降.

图7 不同温度对cs-28乙醇产量的影响
2.2.4 初始pH值对乙醇发酵的影响
初始pH值分别设为5.4、5.6、5.8、6.0、6.2,随着pH值的升高乙醇产量呈上升趋势,pH为6.0时乙醇产量最高,为5.51 g·L-1,随后又急剧下降(图8).
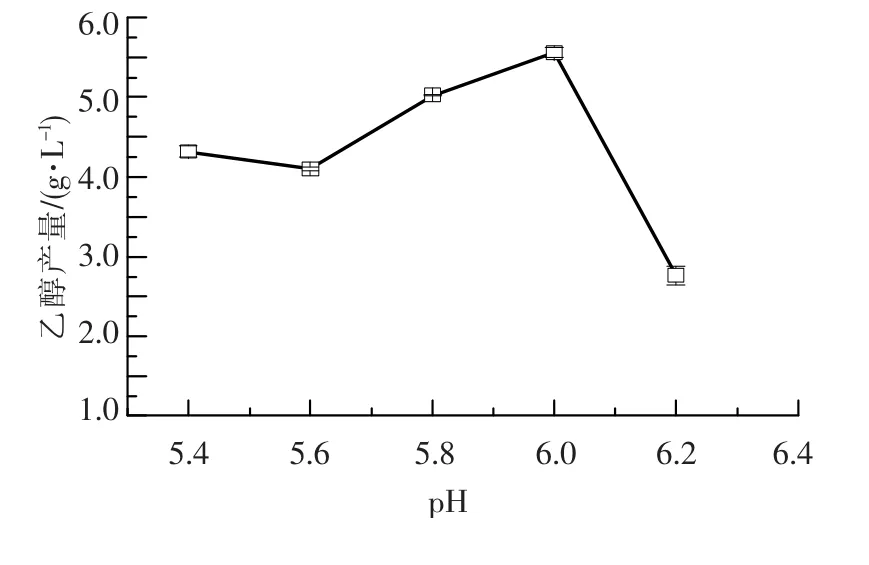
图8 不同pH对cs-28乙醇产量的影响
2.2.5 初始木糖质量浓度对乙醇发酵的影响
初始木糖质量浓度对乙醇产量的影响极大,随着木糖质量浓度的增加,乙醇产量也逐渐增加,但是乙醇产率却逐渐下降(图9),初始木糖质量浓度为20 g·L-1,乙醇产率最高,即木糖转化率最高.

图9 初始木糖质量浓度对cs-28乙醇产量的影响
3 讨论
本试验筛选到的发酵木糖产乙醇的菌种为尖孢镰刀菌,据文献[11-12]报道,尖孢镰刀菌不仅能产生多种纤维素酶系和半纤维素酶系,同时还具有降解多环芳烃蒽和苯酚的能力[13-14],这为环境固体废弃物和多环芳烃物质的降解提供了优良菌种.Panagiotou G等[15]利用尖刀镰刀菌F3实现纤维素的同时糖化和发酵.尖孢镰刀菌利用硝态氮的能力优于铵态氮,这与Naim M S等[16]研究的结果一致.同样是丝状真菌,最适的发酵初始pH值不近相同,虽然都在微酸性条件下,尖孢镰刀菌最适pH为6.0,而粗糙脉孢霉的最适pH为5.0[17].不同菌种对糖质量浓度的适应能力不一样,酿酒酵母在高糖溶液(300 g·L-1)中仍然可以进行发酵,而尖孢镰刀菌的最适木糖质量浓度(20 g·L-1),比Pachysolen tannophilus的最适木糖质量浓度[18]低,这可能与细胞膜透性和渗透压有关[19].
4 结论
1)筛选到一株发酵木糖产乙醇的菌种cs-28,经过形态学和生物学鉴定为尖孢镰刀菌(Fusarium oxysporum).
2)最适的发酵条件温度为30℃;pH值为6.0;最适有机碳源为酵母提取物,无机碳源为NaNO3.
3)尖孢镰刀菌(F.oxysporum)具有发酵多种碳源的特性,为秸秆的资源化利用和能源的生产提供了新的菌种资源.
[1] OLESKOWICZ-POPIEL P,LISIECKI P,HOLMNIELSEN J B,et al.Ethanol production from maize silage as lignocellulosic biomass in anaerobically di-gested and wet-oxidized manure[J].Bioresource Technology,2008,99(13):5327-5334.
[2] CARDONA ALZATE C A,SANCHEZ TORO O J. Energy consumption analysis of integrated flowsheets for production of fuel ethanol from ligocellulosic biomass[J].Energy,2006,31(13):2447-2459.
[3] 牟建楼,王颉,张伟,等.木糖发酵微生物的研究进展[J].纤维素科学与术,2004,12(2):35-40.
[4] CHU B C H,LEE H.Genetic improvement of Saccharomyces cerevisiae for xylose fermentation[J].Biotechnology Advances,2007,25(5):425-441.
[5] ZHANG Xiaomei,CHEN Guanjun,LIU Weifeng.Reduction of xylose to xylitol catalyzed by glucose-fructose oxidoreductase from Zymomonas mobilis[J]. FEMS Microbiology Letters,2009,293(2):214-219.
[6] WANG Zhanchao,CHEN Ming,XU Yuquan,et al. An ethanol-tolerant recombinant Escherichia coli expressing Zymomonas mobilis pdc and adhB genes for enhanced ethanol production from xylose[J].Biotechnology Letters,2008,30(3):657-663.
[7] 魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979:487-642.
[8] J.萨姆布鲁克,D.W.拉赛尔.分子克隆实验指南[M].3版.北京:科学出版社,2002:492-499.
[9] 牟建楼,王颉,张伟,等.乙醇的测定方法综述[J].酿酒,2006,33(2):45-48.
[10] ZHAO Lei,ZHANG Xu,TAN Tianwei.Influence of various glucose/xylose mixtures on ethanol production by Pachysolen tannophilus[J].Biomass and Bioenergy, 2008, doi: 10.1016/j. biombioe. 2008.02.011.
[11] CALERO-NIETO F,HERA C,DI PIETRO A,et al.Regulatory elements mediating expression of xylanase genes in Fusarium oxysporum[J].Fungal Genetics and Biology,2008,45(1):28-34.
[12] XIROS C,KATAPODIS P,CHRISTAKOPOULOS P. Evaluation of Fusarium oxysporum cellulolytic system for an efficient hydrolysis of hydrothermally treated wheat straw[J].Bioresoure Technology,2009,100 (21):5362-5365.
[13] 陈芳艳,毛莉,唐玉斌,等.外加碳源对尖镰孢菌降解蒽的影响[J].水处理技术,2007,33(8):54 -58.
[14] PARK J Y,HONG J W,GADD G M.Phenol degradation by Fusarium oxysporum GJ4 is affected by toxic catalytic polymerization mediated by copper oxide[J].Chemosphere,2009,75(6):765-771.
[15] PANAGIOTOU G,CHRISTAKOPOULOS P,OLSSON L.Simultaneous saccharification and fermentation of cellulose by Fusarium oxysporum F3-growth characteristics and metabolite profiling[J].Enzyme and Microbial Technology,2005,36(5/6):693-699.
[16] NAIM M S,SHAROUBEEM H H.Carbon and nitrogen requirements of Fusarium oxysporum causing cotton wilt[J].Mycopathologia,1964,22(1):59-64.
[17] ZHANG Xiao,ZHU Dongqing,WANG Dan,et al. Study on xylose fermentation by Neurospora crassa[J].Acta Microbiologica Sinica,2003,43(4):466 -472.
[18] BRAVO V,CCMACHO F,SANCHEZ S,et al.Influence of the concentrations of D-xylose and yeast extract on ethanol production by Pachysolen tannophilus[J].Journal of Fermentation and Bioengineering,1995,79(6):566-571.
[19] 郑美娟,余华顺.酵母菌耐高渗机理研究[J].酿酒科技,2008,172(10):37-40.
