基于DT-MRI数据的三维心室组织分层方法
2011-03-12肖立邦王宽全袁永峰
肖立邦,王宽全,袁永峰
(哈尔滨工业大学计算机科学与技术学院,150001哈尔滨,xiaolibang@gmail.com)
在过去的几十年中,研究者先后采用了多种方法来对心室组织进行分层,进而构建心室解剖结构.喻德旷等[1]给出了结果,但是其采用的数据并不是心室组织的解剖数据,而且其三维分层结构中细胞的排列存在间断性;Gulrajani等[2]也给出了心室组织结构中3种细胞的分布结果,但是其采用的方法没有给予介绍.因此,本文提出一种方法来构建心室组织三维解剖结构.首先对三维心室组织进行切片处理,然后对各个切片分别进行边界检测、边界匹配、区域填充和融合后处理,最后将所有切片整合组建形成三维解剖结构.本文基于构建的三维心室组织模型进行建模和伪心电图仿真,并与临床心电图做比较研究,以验证此分层结果的合理性.
1 心脏电生理基础与分层依据
1.1 心室肌细胞电生理异质性
1991年,Sciouri等[3]发现了心室肌细胞存在电生理异质性,即不同部位心室肌细胞动作电位的形态、间期存在差异,这种差异形成了特定形态的心电图(Electrical Cardiac Graphics,ECG).人们对于心室肌细胞的动作电位差异进行的大量研究发现心室去极化的方向总体上是自心内膜向心外膜扩布,而复极过程在心外膜开始较早,依次是心内膜和中间层,如图1(a)所示.从图1(a)中可以看出心外膜复极最早,中间层细胞复极最晚,且其时程较心内膜细胞和心外膜细胞要长.由于不同心室肌细胞的动作电位间期和去极、复极时间先后差异,形成了ECG的QRS波群和T波.
1.2 线性分层方法依据
在心室组织中,心肌细胞处于细胞液的包围中,水分子在细胞中的扩散运动在心肌细胞纤维方向较垂直纤维方向要明显得多,DT-MRI[4]即磁共振扩散张量成像技术就是利用扩张向量场中的各向异性扩散的方向追踪心肌细胞纤维的走向.本文使用的是由约翰霍普金斯大学的心血管生物信息建模中心所提供的高分辨率DT-MRI人类心脏成像数据集[5].如图1(b)所示,心室透壁的心肌纤维旋转角从心外膜至心内膜成线性变化,而不同的纤维走向旋转角对应着不同的心室细胞,因此,心室细胞的层间划分从心外膜至心内膜具有线性划分规律.
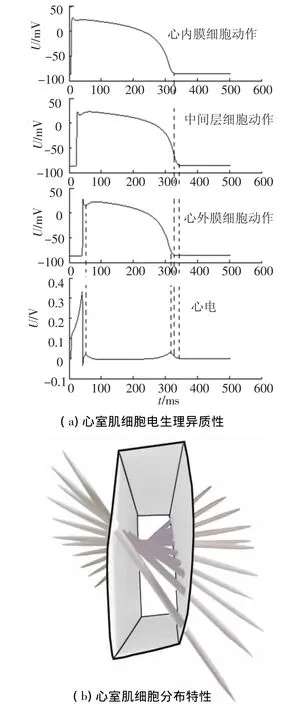
图1 心室肌细胞电生理特性和组织特性
2 心室组织分层方法
由于生物实验的局限性和心脏结构的复杂性,心内膜、中间层、心外膜在心室组织中的精确构成比例尚不明确.本文根据文献[6]仿真研究的结果,将心室壁细胞中心内膜细胞、中间层细胞和心外膜细胞的构成比例设定为25∶35∶40;室间隔细胞中右心室心内膜细胞、中间层细胞和左心室心内膜细胞的构成比例设定为1∶1∶1.由于心室壁和室间隔的细胞种类及构成比例的不一致,本文分类的基本过程是,先将心室壁切片和室间隔切片分别进行细胞分类,然后融合成心室组织切片,最后将所有心室组织切片整合组建,构建三维心室解剖结构.
2.1 边界检测
本文对心室组织切片逐片进行细胞分层,对某特定心室组织切片中心内膜线和心外膜线的确定采用八叉树搜索法,以心外膜线为例,具体步骤为:
1)利用Canny边缘检测算法[7]检测心室组织切片中的心外膜线.
2)确定心外膜线中位于心室组织切片最上端的点为搜索起点,用数组记录.
3)以起点为当前点,搜索位于当前点右方向的边缘点,数组记录,并以此点为当前点.
4)沿当前点的上、下、左、右、左上、左下、右上、右下8个方向搜索边缘点,若边缘点全部已经记录在数组中,则结束;否则,将该边缘点记录入数组中,以此点作为当前点,转步骤4).
记录到数组中的点的顺序为顺时针方向.对于心内膜线,除了搜索起点需要满足“与外边缘线搜索起点位于同一垂直方向”的条件外,方法完全相同.
2.2 边界匹配
为实现心室壁细胞的分类,需要明确心内膜线与心外膜线的对应情况.本文提出2种方法来解决这个问题:圆心散射法、等比匹配法.
2.2.1 圆心散射法
心内膜线和心外膜线之间的区域为心室壁,心室壁形似一个圆环区域,心内膜线为内圆,心外膜线为外圆.设其共同的圆心为O,内圆的半径为r,外圆的半径为R.采用极坐标系,内圆上的任意一点可表示为(r,θ),其中0≤θ≤2π;外圆上的任意一个点可表示为(R,θ),其中0≤θ≤2π.
设外圆上的A点坐标为(R,θ1),内圆上的B点坐标为(r,θ2),若θ1=θ2,本文定义A点和B点即为一对匹配点,如图2(a)所示.
2.2.2 等比匹配法
在边界检测方法中,已经按顺时针顺序确定了心内膜线和心外膜线,设心内膜线的起始点为A1,心外膜线的起始点为B1,心内膜线的顺时针点序列为A1,A2,A3,…,Ai,…,An,心外膜线的顺时针点序列为B1,B2,B3,…,Bj,…,Bm,则AiBj相对应的充要条件是i∶j=n∶m,如图2(b)所示.因为心外膜线的长度大于心内膜线,很显然,相邻的多个心外膜线上的点可能会匹配同一个心内膜线上的点.
对于室间隔,其边界检测结果只是一条封闭边缘线,形似矩形.本文依据矩形四角处内积最小的特点来对其4个“顶点”进行空间定位[8],如图2(c)所示.根据4个“顶点”,确定上、下边缘,然后采用等比匹配法匹配边缘线,室间隔边缘线匹配情况,如图2(d)所示.

图2 轮廓匹配
2.3 填充
以心室壁为例,设AiBj为心内膜线和心外膜线的一对匹配点,那么AiBj间的0.40分点和0.75分点分别为Bj+(Ai-Bj)×0.40和Bj+(Ai-Bj)× 0.75,据此可以得到心室壁区域中的0.40分线和0.75分线.这2条分线将心室壁划分为中间层区域、心内膜区域和心外膜区域.对区域的填充,本文采用扫描线算法.
算法的基本过程为:当给定种子点(x,y)时,首先填充种子点所在扫描线上的位于给定区域的一个区段,然后确定与这一区段相连通的上、下两条扫描线上位于给定区域内的区段,并依次保存下来.反复这个过程,直到填充结束.
将从心外膜至心内膜的4条边缘线分别采用扫描线填充法,结果如图3所示.

图3 心室壁分层及填充
2.4 融合及后处理
分层后的心室壁和室间隔,可以简单地融合在一起,但是简单融合后,仍然存在一个问题:在心室壁的中间层细胞区域和室间隔的中间层细胞区域间是心室壁的心内膜细胞区域.在生物学上对该区域并没有明确的说明.但是从视觉感官和心肌细胞分布的连续性来看,可以推测出该区域应该是中间层细胞区域.因此,本文采用区域生长法[9],以室间隔的中间层细胞区域为种子,以斜率为特征,增长该区域使其与心室壁的中间层细胞区域连接,如图4所示.

图4 区域增长前后
区域生长算法可由下列几个步骤实现:
1)计算室间隔区域边缘线两端的斜率.
2)根据斜率使室间隔边缘线端点向前延伸.
3)判断室间隔边缘线的当前端点是否处于心室壁的中间层区域,若是,则转步骤4),否则,返回步骤1).
4)将新增加的区域填充为该区域颜色.
3 结果及评价
3.1 分层结果
本文对所有心室组织切片进行分层,然后将所有切片进行三维解剖结构重建,得到心室组织三维解剖结构模型.在三维结构重建过程中,本方法对于相邻切片的分层参数数值设置相近,故相邻切片的分层情况差异很小,可以从图5的3个切面视图上看出.从图5中还可以看出心室壁中心内膜细胞、中间层细胞和心外膜细胞是按照25∶ 35∶40的比例分布,室间隔中右心室心内膜细胞、中间层细胞、左心室心内膜细胞按照1∶1∶1的比例分布,而且在室间隔和心室壁的交界处,细胞分布渐变性良好.

图5 三维及多切面视图
3.2 评价
不同类型的心室组织细胞动作电位不同,而心电图的形成正是多种心室组织细胞不同的动作电位的相互作用.因此心室组织的细胞分层会直接影响心电图的形态、波形和间期的长短.本文将心室组织分割成460×482×487的三维阵列,整个心室组织共近亿个心肌细胞单元.本文采用文献[1]中提出的心室组织的电生理模型,基于前面建立的心室细胞分层结构,构建了具有特异性的心室三维计算模型,并进行了伪心电图仿真.图6所示为该模型仿真的伪心电图,每个导联心电图都有完整的QRS和T波波形,符合正常心电图的波形特征.各导联的QRS波走向与临床观测都一致,其T波的方向、QRS波宽和QT间期与临床数据[10]比较如表1所示.

图6 仿真心电图与临床心电图比较

表1 伪心电图与临床心电图比较 ms
4 结论
1)采用线性分层填充法来处理DT-MRI心室组织切片数据并用于三维心室组织解剖结构的重建,然后基于心室细胞计算模型,构建了具有特异性和解剖结构的心室三维计算模型.
2)根据建立的三维计算模型进行伪心电图仿真.结果表明:伪心电图与临床心电图不仅在形态上颇为相似,其T波的方向,ST段的变化,QRS波宽和QT间期与临床数据也十分吻合.
3)本文所模拟的心室组织结构不仅为生物学上心室组织细胞的分类提供了参考依据,而且为研究心室组织在正常及病理条件下的电生理活动仿真提供了有力的假设研究手段.
[1]喻德旷.心室三维可视化及心电仿真建模[D].广州:第一军医大学,2005.
[2]TRUDEL M C,DUBE B,POTSE M,et al.Simulation of QRST integral maps with a membrane-based computer heart model employing parallel processing[J].IEEE Trans Biomed Eng,2004,5l(8):1319-1329.
[3]SICOURI S,ANZTELEVICTH C.A subpopulation of cells with unique electrophysiological properties in the deep subepicardium of the canine ventricle:The M cell[J].Circulation Research,1991,68(6):1729-1741.
[4]江贵平,刘哲星,冯前进,等.基于DT-MRI的纤维跟踪及可视化研究[J].中国医学物理学杂志,2005,22(3):514-518.
[5]KELLER D.Detailed Anatomical and Electrophysiological Modeling of the Human Ventricles based on Diffusion Tensor MRI data[D].Germany:University of Karlsruhe,2006.
[6]ZHANG H,KHARCHE S,HOLDEN A V,et al.Repolarisation and vulnerability to re-entry in the human heart with short QT syndrome arising from KCNQ1 mutation-A simulation study[J].Progress in Biophysics&Molecular Biology,2008,96(1/3):112-131.
[7]CANNY J.A computational approach to edge detection[J]. Pattern Analysis and Machine Intelligence,1986,8(6): 679-698.
[8]李明,王甲卓,李玲玲,等.曲率统计角点检测方法[J].心智与计算,2009,3(3):209-214.
[9]苗语,王艳春,郭乃珠,等.基于边缘检测终止条件的区域生长算法[J].长春理工大学学报,2009,32(4): 680-682.
[10]龚淑华.基于二维心室模型的心电图仿真研究[D].哈尔滨:哈尔滨工业大学,2007.
