纳米多孔玻璃的制备与孔径影响因素的研究
2011-03-10侯胜利周艳艳刘小亮黄岗赵卫星孙中辉
侯胜利,周艳艳,刘小亮,黄岗,赵卫星,孙中辉
(长春理工大学 材料科学与工程学院,长春 130022)
多孔玻璃具有大的比表面积、良好的耐高温性、热稳定性、耐腐蚀性和相对较高的强度等特点,作为催化剂、吸附剂、精制剂、药物缓释剂和异种杂交的理想载体,可广泛应用于食品、环保、化学化工、医药医疗、生物、基因工程等领域。
常利用钠硼硅酸盐玻璃的分相现象制备纳米多孔玻璃。分相结构决定着最终玻璃产品的质量,如何对其孔径结构进行控制一直是该玻璃品种制备的关键问题。因此,研究钠硼硅酸盐玻璃的孔径与工艺的关系有着重要的意义[1-4]。本实验在采用分相法制备多孔玻璃的基础上,着重研究了掺杂、分相温度和分相时间以及酸溶工艺对多孔玻璃孔径的影响。
1 实验
1.1 基体玻璃配方设计原理
Na2O-B2O3-SiO2系统玻璃可看作是由SiO2相和Na2O-B2O3相两相组成,它们之间具有不混溶倾向,从而产生一个亚稳的不混溶区域。如图1所示的区域,Na2O-SiO2-B2O3系统玻璃都有发生分相的现象,一般是分成互不相溶的富 SiO2相和富 Na2O-B2O3相;B2O3的含量越高,通过一定的热处理后分相现象就愈加强烈。由于 Na2O-B2O3相易溶于酸,将分相后的玻璃经酸溶处理,大部分Na2O-B2O3相被溶出,剩下的SiO2相形成相互连通的近似纯硅氧骨架的玻璃,即是多孔玻璃[5]。
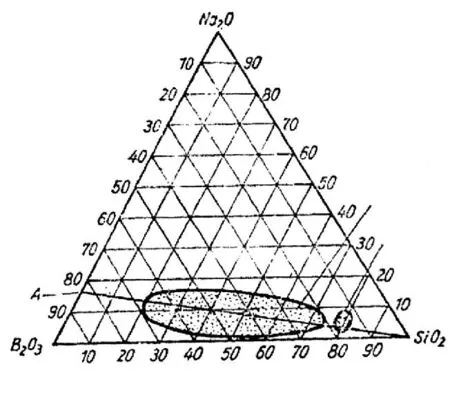
图1 钠硼硅系统玻璃的不混溶区域图Fig.1 Immiscibility region of Na2O-B2O3-SiO2 glass system
1.2 试样制备
1.2.1 玻璃熔制
使用刚玉坩埚熔制玻璃,熔制温度选择在1450℃,熔制时间为 6h,将熔制好的玻璃液在1000℃时浇入盛有冷水的不锈钢容器中,并不断搅拌,获得碎玻璃。借鉴前期实验的数据和文献资料拟定玻璃配方如表1。
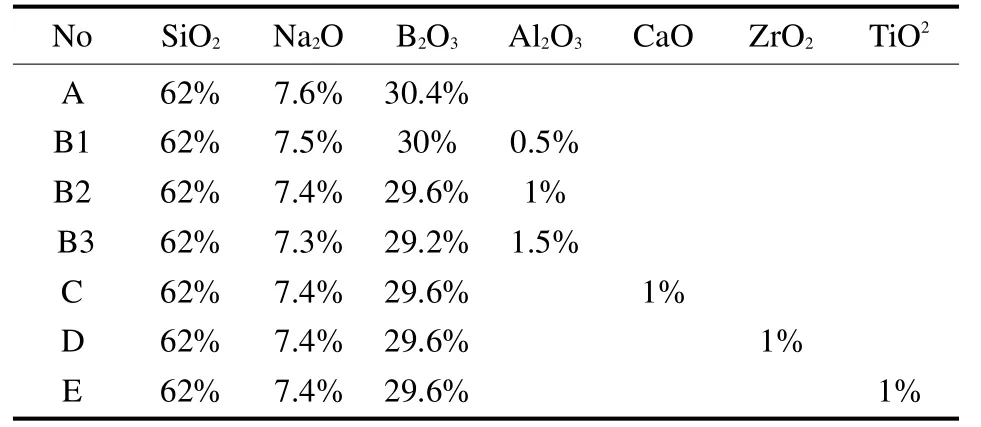
表1 玻璃化学组成Tab.1 Composition of the raw glasses
1.2.2 分相对比实验
取A样做分相对比试验:一组分别在540℃、560℃、580℃、600℃下保温24h;另一组在580℃下分别保温12、24、48h,两组均用2mol/LHCl溶液在90℃恒温水浴中处理24h。
1.2.3 样品预处理
经过分相处理的玻璃,在表面部分会因为氧化钠和氧化硼的挥发而在玻璃的表面形成富含SiO2的玻璃薄层,影响酸溶过程。因此在酸溶前,用200ml的聚氟乙烯溶液、100ml的去离子水、3ml的氢氟酸和2ml浓度为98%的硫酸溶液配制酸溶液,把玻璃放入上述已配制好的酸溶液中,在 25℃时处理5min。
1.2.4 酸溶对比试验
取 A 样(热处理温度为560℃,热处理时间为24h)在不同浓度的盐酸溶液中,90℃恒温水浴中处理24h。
1.2.5 掺杂对比实验
取各组掺杂样品在 560℃下分相 24h,并用 2 mol/L HCl溶液在90℃恒温水浴中处理24h。接着将处理后的玻璃用去离子水清洗,洗去玻璃上的酸液备用。
2 结果与讨论
2.1 分相条件的影响

图2 A样分别在560℃和580℃下热处理24h并酸溶后的扫描电镜图片Fig.2 SEM images of samples after heat treatment at 560℃and 580℃ and acid leaching
图2为样品A在560℃、580℃下热处理24h的SEM照片,表2为在580℃不同分相时间下样品的酸溶失重率和孔径大小。从图表中可以看出随着热处理温度的升高以及分相时间的延长,孔径大小和孔径分布范围均有所增大。这是因为随着分相温度的升高或分相时间的延长,玻璃的不混溶区域的大小和数量均增加,从而使得酸处理后,孔径的大小和范围有所增大。但随着分相时间的延长富硼相中溶入了较多的氧化硅,酸溶过程中又不能完全溶出,导致孔径又减小。

表2 不同热处理时间下多孔玻璃的性质Tab.2 Properties of porous glass in different heat treatment time
2.2 酸浓度的影响
将分相后的玻璃浸入热的盐酸溶液中,Na2O会水解成NaCl,B2O3会水解成HBO3,因而酸溶过程可以理解为钠硼相在盐酸中的溶解与扩散过程[5],因此在一定的范围内,酸溶液的浓度越大,侵析过程和反应速度越快,但随着侵蚀过程的不断深入,孔洞中会逐渐残留一些 SiO2胶体,此胶体是酸性的,在较浓的酸溶液中,孔洞中的SiO2胶体溶解的量减少,使得残留的SiO2的量增多,玻璃的孔径大小和孔体积有所减小。因此,同一酸溶温度、相同酸溶时间,在一定浓度范围内,随着酸浓度的增大,浸出量增加,浸析速度加快,因而孔径越大;但酸浓度高于某一值时孔径有所减小,实验结果见图3和表3。

图3 不同酸浓度条件下多孔玻璃的的失重率Fig.3 The weight loss of porous glass after treatment in different concentrations of HCl solution
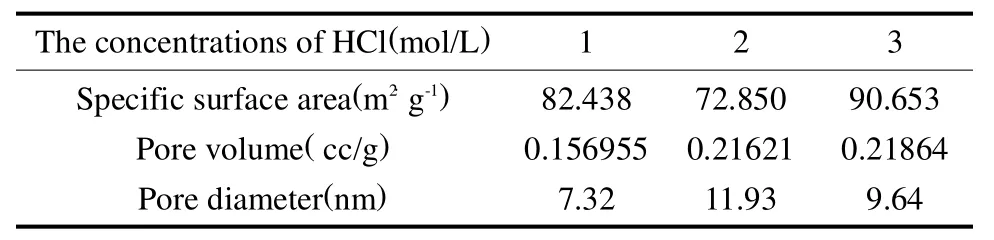
表3 不同酸浓度条件下多孔玻璃性质Tab.3 Properties of porous glass after treatment in different concentrations of HCl solution
2.3 组分掺杂对孔径的影响
本次试验在玻璃中引入了四种掺杂剂,表4和图4分别为在玻璃成分中加入Al2O3、CaO、ZrO2、TiO2后多孔玻璃的性质。
可见随着在玻璃成分中掺入 Al2O3量的增加,多孔玻璃的孔径大小和孔体积逐渐减小;而掺入等量的CaO则可明显增加玻璃的孔径大小和孔体积。这是因为在钠硼硅酸盐中 Al2O3有两种配位状态即[AlO4]和[AlO6],由于掺入的Al2O3含量较少,Na2O/Al2O3>1,加入Al2O3后,Al3+全部处于四配位[6]状态,而以[AlO4]状态存在时带负电,从而吸引部分网络外阳离子,使得积聚程度降低和析晶能力下降,对玻璃的分相起抑制作用;而CaO是电场强度较大的网络外体,容易在玻璃结构中产生局部积聚作用,使近程有序的范围增加,因而增强了玻璃的分相倾向[4],进而使酸溶后失重较多,孔径大小和孔体积增加较大。
TiO2和ZrO2均为四价氧化物,由于Zr4+离子半径大,ZrO2在玻璃中只有一种配位状态,即[ZrO8][7],处于网络之外,有促进分相的作用;TiO2在硅酸盐玻璃中主要位于八面体中,随碱金属氧化物含量的增加,Ti4+有可能进入结构网络,但在本配方中,Na2O/B2O3<1,Ti4+只能位于网络之外,形成[TiO6][6],对分相有起促进作用。所以加入这两种氧化物后孔径均增加。
由以上实验结果可见,玻璃组分中掺杂少量的Al2O3、CaO、ZrO2或 TiO2均可对多孔玻璃的孔径大小均有较为明显的影响。

图4 样品B2、D、E的扫描电镜图片Fig.4 SEM images of samples B2、D、E

表4 掺杂后多孔玻璃的性能Tab.4 The pore diameter after adulterating different compositions
3 结论
影响纳米多孔玻璃孔径的因素有很多,酸溶工艺、分相温度与分相时间以及玻璃的组分掺杂等都会对玻璃的孔径产生影响,而在SiO2含量及Na2O/B2O3保持不变的条件下,玻璃的组分掺杂对孔径的影响最大。从实验结果可以看出,玻璃中少量掺杂可以对多孔玻璃孔径的大小有较大的影响,其中Al2O3可以降低玻璃的孔径,CaO、ZrO2、TiO2均可增大玻璃的孔径。因此,我们认为通过组分掺杂控制纳米多孔玻璃的孔径是较为有效和方便的途径之一。
[1]曹志峰,张希艳.多孔玻璃微珠的研制及其吸附性能的研究[J].硅酸盐学报,2002(3):402-406.
[2]韩建军,阮健,刘建党,等.孔径可控纳米多孔玻璃的制备及性能分析[J].材料学与工程学报,2006(4):571-573.
[3]黄光锋,卢安贤.多孔玻璃应用研究新进展[J].玻璃与搪瓷学报,2006(4):49-52.
[4]胥焕岩,王升高.多孔玻璃的性质、用途及制备[J].武汉工业学院学报,2000(3):40-43.
[5]王承遇,陈敏,陈建华.玻璃制造工艺[M].北京:化学工业出版社,2006.
[6]西北轻工学院.玻璃工艺学[M].北京:轻工业出版社,1991.
[7]赵彦钊殷海荣.玻璃工艺学[M].北京:化学工业出版社,2006.
[8]周艳艳,朱婵媛,李岳.热处理对多孔玻璃孔径的影响[J].长理理工大学学报,2009,32(2):97-99.
