3种亚群PCV-2感染性克隆的构建及体内外感染性
2011-03-08李薇罗维余兴龙李润成白霞葛猛王亚向卫军李晶
李薇,罗维,余兴龙,李润成,白霞,葛猛,王亚,向卫军,李晶
(湖南农业大学 动物医学院,湖南 长沙 410128)
猪圆环病毒(Porcine Circovirus,PCV)为小型、环状双义单链DNA病毒,属于圆环病毒科,圆环病毒属,PCV包括圆环病毒 1(PCV-1)和圆环病毒2(PCV-2)2种病毒,其中PCV-1对猪无致病力,而PCV-2与猪的多种疾病有关,如断奶仔猪多系统衰竭综合症(PMWS)和皮炎肾病综合症(PDNS)及PCV-2相关性猪呼吸道疾病综合症、繁殖障碍、增生性肠炎等,这些病统称为猪圆环病毒病(PCVD)。根据基因组的同源性分析,PCV-2可分成2个基因群,即1群(1 767 bp)和2群(1 768 bp)。1群PCV2又可分为1A、1B、1C共3个亚群(以上简称“三个亚群”);2群PCV2又可分为2A、2B、2C、2D、2E共5个亚群[1-2]。2004年,加拿大东部地区猪群中 PCVD危害明显加重,这与当地出现了 1群PCV-2的毒株有关[2],类似的情况也见于美国和欧洲[3]。Grau-Roma等[4]发现所有的1群PCV-2毒株全部来自发生PMWS的猪场,而从无PMWS的猪场中只能分离到2群PCV-2,也表明1群PCV-2比2群PCV-2致病性可能更强。Opriessnig等[5]发现不同PCV-2分离株间也存在毒力差异,这可能是感染PCV-2的猪不发病现象普遍存在的原因,提示应从不同基因群内各亚群上来研究毒株与毒力的关系。临床上,同一猪体内可以同时感染多种不同基因群或基因亚群的PCV-2毒株[1,4,6],从而使研究毒株与毒力之间的关系变得更加复杂。笔者构建了 1群PCV-2共3种基因亚群1A、1B和1C的感染性克隆,以便更好地研究1群PCV-2不同毒株与毒力的关系。
1 材料与方法
1.1 材 料
1.1.1 病料和细胞及小鼠
含1B PCV-2的病料来源于湖南邵阳某猪场疑似PMWS样品;含1A和1C PCV-2的病料从疑似PMWS病料在小鼠上传代获得;无PCV-1的PK-15细胞由中国农业大学杨汉春教授惠赠[7];20 g左右的昆明小鼠购自湖南省疾病控制中心。
1.1.2 主要试剂及培养基
Taqplus DNA聚合酶、Taq酶、琼脂糖凝胶回收试剂盒、质粒提取试剂盒分别购自天为时代生物有限公司;DL2000 DNA Marker、T4连接酶、限制酶SacⅡ、pMD-18T试剂盒为TaKaRa公司产品;其他化学试剂均为国产分析纯。
MEM 培养基、新生犊牛血清、谷氨酰胺为GIBCO产品;羊抗鼠荧光二抗产品均购自 Sigma公司;Lipofectamine2000购自Invitrogen公司。
1.2 方 法
1.2.1 引物的设计与合成
借助DNAStar,将GenBank上已登录的PCV-2基因组序列作同源性比较后,设计并合成PCV-2引物(表1),表1中Fp1及Rp1引物均包含基因组中491 nt处唯一的SacⅡ限制酶切序列,用下划线标示。

表1 PCV-2引物Table 1 Primers of PCV-2
1.2.2 3个亚群PCV-2全基因组的PCR扩增
适量含1A、1B、1C共3种亚群毒株的病料匀浆后,按蛋白酶K、酚、氯仿抽提方法提取基因组,用PCV-2基因组全长引物Fp1和Rp1扩增PCV-2全长基因组,PCR反应程序为:94℃预变性5 min,94 ℃变性30 s,68℃退火30 s,72 ℃延伸90 s,30个循环,72 ℃延伸7 min,最后用1%的琼脂糖凝胶电泳鉴定。
1.2.3 PCR扩增产物的克隆与鉴定
PCR 产物用琼脂糖凝胶回收试剂盒回收后,与pMD-18T载体连接,转化DH5α感受态细胞。用PCR方法鉴定重组菌落,并将阳性菌落接种到LB液体培养基培养过夜,菌液送英韦创津公司进行基因测序。
1.2.4 3个亚群PCV-2基因组转染PK-15细胞
用碱裂解法大量提取测序正确的阳性重组质粒,用SacⅡ限制酶切出PCV-2全长基因序列,将此序列回收后再用T4连接酶16 ℃连接过夜,让其自身连接,回收连接产物,并用核酸蛋白定量仪测定其核酸含量,连接产物分别命名为icRP8(1A)、icP0 (1B)、icP4-1 (1C)。待PK-15细胞生长至90%满度,采用Invitrogen公司的Lipofectamine2000 将上述3种连接物分别转染PK-15细胞,转染过程参照其产品说明书。
1.2.5 感染性克隆在 PK-15细胞上传代及体外感染性的测定
转染的1A、1B、1C亚群感染性克隆分别在PK-15细胞上盲传至第5代,按常规法提取基因组后,用PCV-2全长引物Fp1和Rp1扩增PCV-2,并直接取PCR产物送英韦创津公司测序分析。用胰酶消化培养72 h第5代的细胞,滴加到带圆孔镀膜载玻片上的圆孔中,并在5% CO2、37 ℃条件下继续培养4~5 h,待其贴壁,之后甩掉培养液,用PBS洗涤,80%的冷丙酮4 ℃固定30 min,甩掉固定液,风干干燥,后加1∶20稀释的抗PCV-2的鼠高免血清[8],37℃作用1 h,PBS泡洗后,再滴加0.01%伊文斯兰1∶64倍稀释的羊抗鼠荧光抗体,37 ℃作用1 h,PBS泡洗3次,干燥后滴加50%甘油磷酸缓冲液,置OLYMPUS BX51荧光显微镜下观察。
1.2.6 PCV-2 感染性克隆体内感染性的测定
取20 g左右的昆明小鼠,分4组,每组6只。第1组至第3组分别接种1A、1B、1C亚群感染性克隆的第5代细胞培养物。第4组接种正常的PK-15细胞培养物。接种方式均为腹腔注射结合滴鼻。在接种后第5天分别尾静脉取血,提取血液中的总DNA,用PCV-2检测性引物检测PCV-2,用PCV2 1A、1B、1C亚型的特异性引物进一步检测3种亚型。
2 结果与分析
2.1 3个亚群PCV-2全长基因组的克隆
由琼脂糖凝胶电泳结果可以看出,用 PCR方法,从病料中扩增出了预期大小的 1.8 kb左右的DNA片段。此片段与pMD-18T载体连接后,经PCR鉴定后获得的重组质粒分别命名为RP8、P0和P4-1 (GenBank登录号分别为 FJ716704、EU095020、FJ667588)。同源性分析表明,RP8代表的 PCV-2序列属于PCV-2中的1A亚群序列,P0为PCV-2 1B亚群,P4-1为PCV-2 1C亚群序列。
2.2 3个亚群感染性克隆的构建
1A、1B、1C亚群的重组质粒用SacⅡ限制酶均能成功切出1 800 bp的PCV-2基因片段,构建的感染性克隆转染的细胞分别连续盲传 5次后,经PCR检测,用引物Fp1和Rp 1分别扩增出了1 800 bp的PCV-2目的片段。用间接免疫荧光检测转染的第5代细胞(图 1),可见荧光主要分布在细胞质中,没有PCV-2感染的细胞呈红色。PCR结果和免疫荧光结果表明感染性克隆构建成功,已经产生出子代PCV-2。
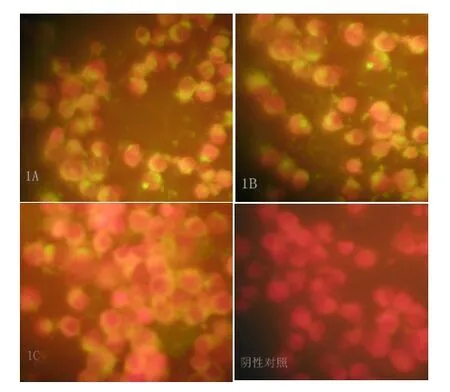
图1 3个亚群PCV-2感染性克隆免疫荧光结果(40×0.75)Fig.1 ⅠFA results of an infectious molecular clones of three subgroups of PCV-2 (40×0.75)
2.3 3个亚群感染性克隆的体内感染性
将1A、1B、1C感染性克隆的细胞培养物分别接种3组小鼠后,用引物Fp2和Rp2进行 PCR扩增,分别能从3组小鼠中检测到500 bp左右的PCV-2特异性片段,而对照组没有。用PCV-2亚型特异引物扩增,接种PCV-2 RP8第1组老鼠只能用1A型引物扩增出140 bp左右的特异条带,接种P0的第2组老鼠只能用1B型引物扩增出230 bp左右的特异条带,接种P4-1的第3组老鼠只能用1C型引物扩增出560 bp左右的特异条带(图2),但是接种小鼠不表现任何临床症状。PCR结果表明,构建的1A、1B、1C亚群的感染性克隆,即RP8、P0和P4-1毒株在小鼠体内都具有感染能力。
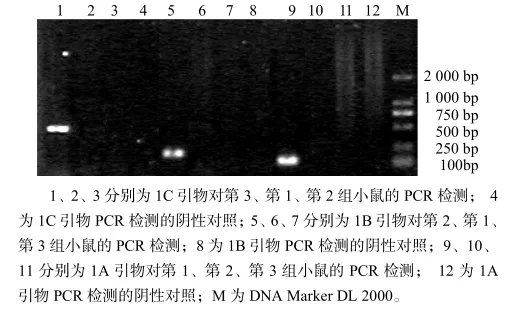
图2 PCV-2的3个亚群特异性引物小鼠内PCR检测结果Fig.2 PCR amplication result of three subgroups of PCV-2 in mice using specific subgroup primers
3 结论与讨论
将获得的1A、1B、1C亚群毒株的基因组通过酶切自身连接环化的方法分别构建成不同的感染性克隆,转染PK-15细胞并传代,PCR与IFA检测均证明构建的1A、1B、1C感染性克隆在体外均具有感染性。为进一步研究1A、1B、1C感染性克隆在体外的感染性,分别将1A、1B、1C感染性克隆的细胞培养物接种小鼠,并采取滴鼻与腹腔注射结合的接种方式,以确保病毒能接到小鼠体内。PCR检测证明1A、1B、1C感染性克隆在小鼠体内也具有感染性。
越来越多的资料支持1群PCV-2是毒力更强的毒株[3,4,9-12]的观点。1群PCV-2的不同亚群间是否存在着毒力的差异,还有待研究。从病猪体内分离的病毒,往往是多种PCV-2毒株的混合物,不利于弄清不同类型PCV-2与毒力的关系。2000年Fenaux等[13]首次报道利用感染性分子克隆接种SPF猪,并复制出 PCV-2典型的临床症状和病理变化。Opriessnig等[1]构建了 2个可引起感染猪不同临床症状的PCV-2毒株的感染性克隆,因此,可构建不同类型毒株的感染性克隆来研究其与毒力的关系。
从病料中克隆的3个PCV-2全基因经测序分析,分别属于PCV-2的1A、1B、1C亚群,其中1B亚群分离自湖南邵阳某猪场疑似PMWS猪淋巴组织,1A、1C亚群则是将该疑似PMWS猪病料接种小鼠并在小鼠体内传代获得的,将在小鼠内获得的毒株序列与GenBank收录的所有PCV-2序列进行同源性比较,发现很多PCV-2序列与本试验小鼠内获得序列的同源性在99%以上,表明在传代小鼠体内获得的毒株也普遍存在于猪群中,后来经检测,在原始病料中即含有同样的1A与1C亚型病毒。
[1] Opriessnig T, McKeown N E, Zhou E M, et al. Genetic and experimental comparison of porcine circovirus type 2 (PCV-2) isolates from cases with and without PCV-2-associated lesions provides evidence for differences in virulence[J]. J Gen Virol , 2006, 87: 2923-2932.
[2] Delay J, McEwen B, Carman S, et al. Porcine circovirus type 2-associated disease is increasing[J]. AHL Newsletter, 2005(9): 22.
[3] Dupont K, Nielsen E O, Baekbo P, et al. Genomic analysis of PCV-2 isolates from Danish archives and a current PMWS case-control study supports a shift in genotypes with time[J]. Veterinary Microbiology , 2008, 128: 56-64.
[4] Grau-Roma L, Crisci E, Sibila M, et al. A proposal on porcine circovirus type 2 (PCV2) genotype definition and their relation with postweaning multisystemic wasting syndrome (PMWS) occurrence[J]. Vet Microbiol, 2008, 128: 23-35.
[5] Opriessnig T, Ramamoorthy S, Madson DM, et al. Differences in virulence among porcine circovirus type 2 isolates are unrelated to cluster type 2a or 2b and prior infection provides heterologous protection[J]. Journal of General Virology , 2008, 89: 2482-2491.
[6] Lefebvre D J, Costers S, Van Doorsselaere J, et al. Antigenic differences among porcine circovirus type 2 strains, as demonstrated by the use of monoclonal antibodies [J]. Journal of General Virology, 2008, 89: 177-187.
[7] 王芳, 盖新娜, 郭鑫. 猪圆环病毒2型BF株感染性分子克隆系列突变株的构建[J]. 中国兽医杂志, 2007, 43(12 ): 17-19.
[8] 侯强红, 余兴龙, 李薇. 猪圆环病毒2群Cap蛋白部分基因序列与大肠杆菌LTB成熟肽基因的融合表达及免疫原性研究[J]. 中国预防兽医学报, 2007, 29(11): 847-851.
[9] Carman S, Cai H Y, Delay J, et al. The emergence of a new strain of porcine circovirus-2 in Ontario and Quebec swine and its association with severe porcine circovirus associated disease-2004-2006[J]. Canadian Journal of Veterinary Research , 2008, 72: 259-268.
[10] Olvera A, Cortey M. Molecular evolution of porcine circovirus type 2 genomes: Phylogeny and clonality[J]. Virology , 2007, 357: 175-185.
[11] Cheung A K, Bolin S R. Kinetics of porcine circovirus type 2 replication[J]. Arch Virol, 2002, 147: 43-58.
[12] Meerts P, Misinzo G, McNeilly F, et al. Replication kinetics of different porcine circovirus 2 strains in PK-15 cells, fetal cardiomyocytes and macrophages[J]. Arch Virol, 2005, 150: 427-441.
[13] Fenaux M, Halbur P G, Haqshenas G, et al. Cloned genomic DNA of type 2 porcine circovirus is infectious when injected directly into the liver and lymph nodes of pigs: Characterization of clinical disease, virus distribution, and pathologic lesions[J]. Journal of Virology, 2002 (6): 541-551.
英文编辑:罗文翠
