柑橘中冷胁迫相关的m iRNA的RT-PCR鉴定
2011-03-07张金梅汪启明饶力群
张金梅,李 煌,汪启明,饶力群
(湖南农业大学生物化学与分子生物学研究室,湖南长沙 410128)
MiRNA是一类长约 21~22 nt的内源单链RNA,不具有开放阅读框。成熟的miRNA 5′端有磷酸基团,3′端有羟基。miRNA本身不编码蛋白质,但能协调许多基因的表达,通过切割靶基因的或抑制其翻译[1],调节植物的激素分泌和信号转导,增强植物对恶劣环境的适应能力[2-5]。此外,植物miRNA还具有保守性、时序性和组织特异性[6-7],在个体发育的不同时期或不同组织中有不同的表达模式。
利用微阵列技术从水稻中识别了18个冷胁迫反应miRNAs,大多数的表达是下调。其中miRNA167和miRNA319的表达模式相似,miRNA171家族的不同成员表达模式各不相同,呈现出多样性[8]。采用全基因组分析和高通量测序技术,鉴定了短柄草中多个miRNAs,其中28个miRNAs对冷胁迫反应明显,所有的27个保守的miRNAs都受冷胁迫表达上调[9]。但关于柑橘中miRNAs的功能尤其是与冷胁迫的相关性却是空白,尽管已在柑橘中发现27个miRNAs[10]。本研究以柑橘为材料,4℃冷胁迫处理不同时间,提取叶片中总RNA,进行逆转录合成cDNA,再用半定量RT-PCR扩增,以确定这几个miRNAs在柑橘中是否存在及经冷胁迫处理不同时间后的差异表达情况。
1 材料与方法
1.1 材料
1.1.1 供试材料 供试柑橘品种为金橘,种植于湖南农业大学日光温室中,常规栽培管理。将金橘置4℃条件下光照培养箱中冷处理,于 0、0.5、4、8 h 和14 d分别取其幼嫩叶片,-80℃中保存。
1.1.2 仪器与试剂 (1)仪器:高速冷冻离心机、微型离心机、研钵 、烘箱、制冰机、高压蒸汽灭菌锅、移液器、电泳仪、凝胶成像分析仪、紫外分光光度计、PCR仪、梯度PCR仪;(2)主要试剂:Trizol(In-vitrogen)、氯仿、异丙醇、DEPC 灭菌水、70%乙醇、逆转录酶 M-MLV;RNasin(40 U/μL)、dNTP(2.5 mM/L)、Taq DNA 聚合酶(5 U/μL)、pGM-T 克隆试剂盒、重组菌落PCR鉴定试剂盒。
1.2 方法
1.2.1 引物合成 引物采用PrimerPremier 5.0软件设计,由上海生工生物技术有限公司合成。所用引物序列如下表1。

表1 所用引物序列
1.2.2 总RNA的提取与质量检测 提取不同时间处理过的金橘叶片中总RNA。先将离心机预冷至4℃,研钵和离心管用液氮预冷,迅速将叶片于研钵中液氮研磨成粉,加到1.5 mL的离心管中,向每个离心管中加入lmL Trizol,振荡混匀,室温静置5 min,12 000 r/min离心10 min。取上清液到另一干净离心管中,每个离心管中加入200μL氯仿剧烈振荡,冰上静置5 min,12 000 r/min离心10min。取上清液到另一干净离心管中,加入等体积的异丙醇沉淀10 min,13 000 r/min离心12 min。去上清,用70%乙醇洗涤沉淀,12 000 r/min离心2 min。去上清,沉淀,室温中晾干,加入DEPC水中于-80°C保存。
取5μL DEPC灭菌水溶解RNA后点样,1.5%琼脂糖凝胶在80V/稳压下电泳30 min,进行RNA完整性检测。再用紫外分光光度计测得OD260/OD280为1.93,说明此RNA纯度很高;浓度为340μg/mL,含量高,适合做RT-PCR。
1.2.3 半定量RT-PCR对不同时间冷胁迫下柑橘中m iRNA的差异表达鉴定 (1)PCR循环数的确定:PCR反应中,产物最初为指数增加,当Taq DNA酶活力不足或反应试剂有限时,扩增产物量会达到饱和。此时,不同浓度的cDNA做模板,产物量会相同。故只有产物量未到平台期的循环数,才能有效检测扩增前各基因的起始浓度。在22~30个范围内设置了4种不同的循环数,以确定目的基因的最佳PCR反应循环数,最后确定为miRNA156、miRNA166a、miRNA167d 为 25,miRNA166 为 22,miRNA171为28。
(2)PCR体系的优化:为了提高PCR的特异性,又能获得较多的产物,需优化PCR体系的引物量。将预先配好的12.5 mM的引物,分别取不同的量,梯度设置为:0.5、0.8、1、1.2 、1.5 μL,然后根据 PCR产物电泳结果选用合适的引物量,实验选定为1 μL。为了取得最佳效果,对退火温度进行优化。以引物合成报告单上的退火温度低5℃为参照,上下2°设置4个温度梯度,根据PCR产物电泳结果,确定最佳退火温度为56℃。
(3)逆转录:miRNA 前体带有 poly(A)尾,可用Oligd(T)进行逆转录。对 miRNA167a、miRNA167d和miRNA171采用此法。取纯化后的总RNA按下列步骤进行:反转录反应体系(20μL):在RNasefree 0.2 mL离心管中配制下列反应液Total RNA 1~5 μg,Oligo(dT15)Primer(12.5 μM)2 μL,加RNase free H2O到10μL,简短离心混匀,70℃温育5 min,冰上急冷3 min。上述反应液10μL中加RNase Inhibitor(40 U/μL)1 μL,5×PrimerScriptTM Buffer 4 μL,M-MLV(200 U/μL)1 μL,dNTPMixture(2.5 mM)4μL总体积 20μL。混匀,42℃,60 min,70℃,15min,-20℃保存备用。
miRNA成熟体由于序列长度太短,极易降解,在细胞内含量又极其低微,以Oligd(T)为引物很难检测到。故设计基因特异性的茎环引物做逆转录,再进行PCR扩增。
Stem-loop RT-PCR是一种高效、灵敏特异的小分子miRNA的检测方法[11-12],已在多种植物的miRNA检测中获得成功[13-14]。对miRNA156和miRNA166采用Stem-loop RT法,纯化后的总RNA反转录合成cDNA。反应步骤:总RNA 1~5μg,特异茎环引物(12.5 μM)2 μL,dNTP Mixture(2.5 mM)4μL,RNase free H2O 4μL。用枪轻轻吹打混匀,70℃温育5min,冰上急冷5min。在上述反应管中配制下列反转录反应液。加入RNase Inhibitor(40 U/μL)1 μL,5 ×First strand Buffer 4 μL,M-MLV(200 U/μL)1 μL,dNTPs 4 μL,总反应体系 20 μL。混匀,16°C 30min;30℃ 30 s,42℃ 30 s,50℃ 1 s;85℃10min完成逆转录反应,-20℃保存。
(4)PCR反应:以上述合成的cDNA为模板,PCR反应扩增目的基因,分别以EF和U6为内参基因平衡cDNA模板浓度。20μL的PCR反应体系中含 cDNA 2μL,上下游引物(12.5μM)各 1μL,dNTP Mixture(2.5 mM)4 μL,PCR Buffer 2 μL,DNA polymerase 0.35 μL,补 ddH2O 至 20 μL,混匀,按照以下程序进行扩增:94℃变性5min;94℃变性 30 s,56℃退火 30 s,72℃延伸 1min,25 个循环;然后72℃保持5min。将上述RT-PCR产物在1.5%的琼脂糖凝胶中点样,在电压80 V的TAE缓冲液中电泳20min,取出凝胶,紫外成像后,比较条带强弱,确定miRNA基因在不同时间冷处理时的表达情况。
1.2.4 序列测定 扩增的目的基因产物经1.2%琼脂糖凝胶电泳检测后,按说明书进行回收。用10 μL无菌ddH2O溶解已纯化的回收片段,通过紫外分光光度计测定浓度,确定DNA与PGM-T载体的连接比例。将TOP10感受态细胞放置冰上,完全溶解后,轻轻将细胞混匀。吸取5μL的重组反应产物加入到50μL感受态细胞中,轻轻混匀,冰上放置30min。42℃热激90 s,冰上放置3min。加入450 mL 37℃的LB液体培养基,37℃振荡培养1 h。将大肠杆菌涂布在含有氨苄青霉素和IPTG和XGal的LB平板上,37℃倒置培养过夜。挑选圆且亮的白色菌落,加LB液体培养基做菌落扩大培养后,保存在1.5 mL EP管中,EP管中预先加入1 mL的LB液体培养基和15%的甘油和适量的氨苄青霉素混匀,送上海生工测序。
2 结果与分析
2.1 RNA提取结果
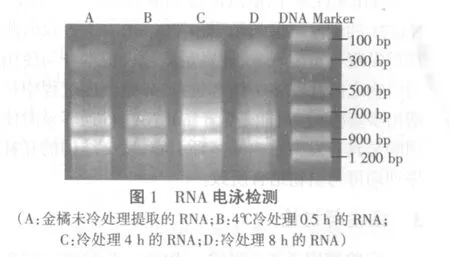
如图1所示,出现三条主带(28SrRNA、18Sr-RNA、5SrRNA),且 28SrRNA条带的亮度约为18SrRNA条带亮度的2倍,表明所提取的RNA较完整。
2.2 半定量RT-PCR对miRNAs的差异表达鉴定结果
如图2、图3所示,3种miRNAs前体(miRNAs167a、miRNAs167d、miRNAs171) 和 2 种 miRNAs的成熟体均被检测到,说明了半定量RT-PCR对柑橘中miRNAs鉴定的可行性及stem loop RTPCT对小分子miRNAs的检测具有高效性和灵敏性。实验鉴定了5种柑橘miRNA在不同时间冷胁迫处理后的差异表达情况,随着冷处理时间的延长,miRNA156和 miRNA171的表达量逐渐增加,而miRNA166的表达量在8 h内几乎没什么变化,经过14 d的冷驯化后,略有减弱。miRNA167a和miRNA167d的变化趋势一致,先是表达量下降,8 h时出现回升,长期冷驯化后,呈下调趋势。除miRNA166外,其余4个被检测的miRNAs均在4℃冷胁迫0.5 h后反应明显。

2.3 测序结果
miRNA156、miRNA167a、miRNA167d 及 miRNA171的测序结果与预测相符,miRNA166双向测序后发现有重叠现象,怀疑是质粒模板本身与使用的引物之间存在多个结合位点,导致测序过程中扩增出多套模板。可能是由于miRNA166逆转录时使用的是具有发夹结构的茎环引物,发夹结构的互补序列均可与引物结合所致。
3 结论与讨论
实验鉴定了5个柑橘miRNA,并发现它们在4℃冷处理不同时间时各个miRNA的差异表达情况及其表达模式。关于冷胁迫的研究多在模式植物拟南芥中进行,这种抗寒性miRNA在植物中保守存在[15]。本研究也表明miRNA在拟南芥和柑橘中具有保守性。不仅在序列结构上是保守的,而且在功能上也是高度保守的。不同的miRNA在植物体内的表达差异显著,在冷胁迫下参与基因表达调控,以应对逆境刺激。不同的miRNA对基因表达的调控模式不同,并随时间变化。
以前对植物冷胁迫后miRNAs的表达研究时间很少有超过24 h,本研究设计了2周的冷驯化处理并观察了处理后的miRNAs的表达量的变化。但对这些miRNAs是如何感受温度变化,又是如何通过其靶基因来将信号整合进低温调节网络并提高柑橘的冷适应能力还不清楚。本研究以冷胁迫为切入点,其研究策略对于其他的胁迫反应如干旱、盐碱等胁迫环境中miRNA的研究具有一定的指导意义。
[1] Chen P Y,Manninga H,Slanehev K,et al.The developmental miRNA profiles of zebrafish as determined by small RNA cloning[J].Genes Dev,2005,19(11):1288-1293.
[2]Park W,Li J J,Song R T,et al.CARPEL FACTORY,a Dicer homolog and HEN1,a novel protein,actin microRNA metabolism in Arabidopsis thaliana[J].Curr Biol,2002,12(17):1484-1495.
[3] Aukerman M J,Sakai H.Regulation of fiowering time and floral organ identity by a MicroRNA and its APEI人LAZ-like target genes[J].Plant Cell,2003,15:2730-2741.
[4] Palatnik JF,Allen E,Wu X,et al.Control of leafmorphogenesis bymicroRNAs[J].Nature,2003,425:257-263.
[5] Sunkar R,Zhu JK.Novel and stress-regulated microRNA and other small RNA from Arabidopsis[J].Plant Cell,2004,16(8):2001-2019.
[6]Reinhart B J,Weinstern E G,Rhoades MW,et al.MicroRNAs in Plants[J].Genes Dev,2002,16(13):1616-1626.
[7] Unkar R,Jagadeeswaran G.In silico ideniification of conserved microRNAs in large number of diverse plant species[J].BMC Plant Biol,2008,8:37-42.
[8] De K L,Xi B,Yong L,et al.Profiling of cold-stress-responsive miRNAs in rice bymicroarrays[J].Gene,2010,(10):39-47.
[9]Zhang JY,Xu Y Y,Huan Q,et al.Deep sequencing of Brachypodium small RNA at the global genome level identifiesmicroRNAs involved in cold stress response[J].BMD Genomics,2009,10:449.
[10]Song C N,Fang JG,Li X Y,et al.Identification and characterization of 27 conserved microRNAs in citrus[J].Planta,2009,230:671-685.
[11]Erika V G,Rong M W,Marion W,et al.Protocol:a highly sensitive RT-PCR method for detection and quantification of microRNAs[J].Plant Methods,2007,(3):12.
[12]李 贺,张志宏.草莓microRNA的RT-PCR鉴定[J].中国农业科学,2009,42(4):1465-1472.
[13]刘永鑫,韩英鹏,常 玮,等.一种适合大豆MicroRNA鉴定的RT—PCR 方法[J].大豆科学,2009,28(4):601-604.
[14]黄飞飞,李 货,张志宏,等.苹果MicroRNA的茎环RT2PCR检测及离体试管苗与田间苗表达差异[J].华北农学报,2010,2 5(1):104-109.
[15]王 莹,龙亮华.豌豆中抗寒相关性miRNAs功能特异性验证及其克隆的研究[J].辽宁师范大学学报,2010,33(2):232-236.
