L-酪氨酸印迹聚合物的本体聚合法制备及性能
2011-03-07王锦谢迟董新荣雷孝
王锦,谢迟,董新荣,雷孝
(湖南农业大学 理学院,湖南 长沙 410128)
分子印迹聚合物(MIPs)是以化合物的分子结构为模板(模板分子或印迹分子)制备的聚合物,是一种具有“记忆”功能的高分子材料。由于MIPs具有选择性地吸附印迹分子的性能,被广泛应用于各种选择性分离与检测方法中[1-3]。
L-酪氨酸(L-Tyr)是合成多肽类激素、抗生素、L-多巴等药物的主要原料,还常用作食品添加剂和配制人工昆虫饲料。L-Tyr主要从含蛋白质的物质(废丝、酪蛋白和玉米等)的水解液中提取,以葡萄糖为原料,经短杆菌出发诱导的l-酪氨酸生产菌发酵而得[4-5]。由于产品组成复杂或L-Tyr含量低,分离纯化、富集检测都较困难。目前L-Tyr的分离纯化及分析检测仍沿用传统方法,试剂用量大,效率低。笔者用本体聚合法制备的L-Tyr印迹聚合物,能从复杂的体系中选择性吸附L-Tyr,有利于对L-Tyr的快速分离纯化及检测。
1 材料与方法
1.1 主要试剂和仪器
L-Tyr (国药集团化学试剂有限公司);α-甲基丙烯酸(MAA)(天津科密欧化学试剂开发中心);偶氮二异丁腈(AIBN)(天津科密欧化学试剂开发中心) ;二甲基丙烯酸乙二醇酯(EDMA)(美国 CIBA公司,交联度、双酯度98.80%,酯度99.70%,酸度0.08%);甲基丙烯酸羟乙酯(HEMA)(上海华谊丙烯酸有限公司);4-乙烯基吡啶(4-VP)(Alfa Aesar,Johnson Matthey Company);氮气(含量>99.5%)。
日立2500荧光分光光度计(日立公司);恒温水浴振荡器(江苏大地自动化仪器厂); DL-360A超声清洗仪(上海之信仪器有限公司);高速万能粉碎机(天津市泰斯特仪器有限公司);AL-204电子天平(梅特勒-托利多);索氏提取器;分样筛(74 μm);84-1磁力搅拌控温电热套(河南巩义市昌旺仪器厂)。
1.2 方 法
1.2.1 L-Tyr印迹聚合物的合成
称取0.364 6 g L-Tyr于锥形瓶中,加入功能单体和15 mL溶剂,磁力搅拌3 h。再加入交联剂、引发剂AIBN 0.06 g,在超声波清洗仪中活化20 min,通氮气5 min,抽真空,置于水浴中热引发并反应24 h,得白色块状聚合物固体,搅碎,取出固体,洗涤,干燥,粉碎,过74 μm分样筛,得粒径为74 μm微球,用醋酸-醋酸钠缓冲溶液清洗模板分子和未聚合的功能单体和交联剂,得到L-Tyr印迹聚合物。
1) 单因素试验。考察功能单体[6](MAA、4-VP)及用量(模板分子与功能单体量比分别为1∶1、1∶2、1∶4、1∶6)、交联剂(EDMA、HEMA)[7-8]及用量(模板分子与功能单体和交联剂量比分别为1∶4∶10、1∶4∶20、1∶4∶30、1∶4∶40)、反应溶剂[9-10](乙腈、乙醇、氯仿)和引发温度[11](0、20、40、60、80 ℃)变化对制备L-Tyr印迹聚合物的影响。以印迹聚合物的萃取效率、选择性吸附L-Tyr的饱和吸附量为指标考察聚合物的性能。
2) 正交试验。用3水平4因素设计正交试验L9(34),以L-Tyr印迹聚合物的萃取效率、选择性吸附L-Tyr的饱和吸附量为指标,考察功能单体MAA用量(4、8、12 mmoL)、交联剂EDMA用量(20、40、60 mmoL)、溶剂种类(乙腈、乙醇、氯仿)、温度(40、60、80 ℃)对制备L-Tyr印迹聚合物的影响。
1.2.2 L-Tyr印迹聚合物的红外光谱分析
分别将模板分子L-Tyr、L-Tyr印迹聚合物MIPs及萃取去除模板分子L-Tyr后的聚合物、空白印迹聚合物 NMIPs(不加模板分子 L-Tyr的聚合物)与KBr(质量比1∶100)混合压片,用傅立叶红外光谱仪在4 000~400 cm-1范围扫描[12],绘制透光光谱。
1.3 L-Tyr印迹聚合物的性能评价
1.3.1 测定MIPs模板分子萃取效率
将所制备的74 μm微球聚合物MIPs置于真空干燥箱充分干燥后,准确称取其质量,用100 mL醋酸-醋酸钠缓冲溶液于索式提取器中萃取,除去模板分子,每隔24 h取萃取液测定其荧光强度和荧光值后,更换1次醋酸-醋酸钠缓冲溶液,用荧光分析方法测定L-Tyr的质量浓度,待质量浓度低于1 μg/mL时停止萃取,干燥萃取后的固体,并准确称取其质量,计算萃取效率。
1.3.2 测定MIPs饱和吸附量
分别准确称取50 mg已萃取的的印迹分子聚合物MIPs放入具塞的小试管中,加入2.5 mL 6 mmol/L的L-Tyr的醋酸缓冲溶液,置于恒温水浴振荡器中,25 ℃下振荡24 h,离心10 min,取上清液,用荧光分析方法测定L-Tyr的浓度,计算对L-Tyr的饱和吸附量(被吸附的L-Tyr的量与吸附前聚合物的量的比值)。
1.3.3 MIPs对L-Tyr的选择性吸附
称取已萃取的50 mg MIPs置于具塞小试管中,分别加入5 mL 0.4、0.8、1.2、1.6、1.8、3.0、4.0、5.0、6.0 mmol/L的L-Tyr和L-Phe醋酸缓冲溶液,置于恒温水浴振荡器中,25 ℃下振荡24 h后,离心10 min,取上清液,用荧光分析方法测定L-Tyr的浓度,计算对L-Tyr的吸附量。
2 结果与分析
2.1 功能单体对合成印迹聚合物吸附性能的影响
以4-VP为功能单体时,萃取效率、饱和吸附量只能达到36.36%和22.04 μmol/g,而以MAA为功能单体,其用量为8 mmol时,萃取效率87.78%,饱和吸附量71.87 μmol/g,达到最大值,因而MAA适于L-Tyr印迹聚合物的制备。
2.2 交联剂对合成印迹聚合物吸附性能的影响
在交联剂HEMA的作用下没有聚合物生成,而功能单体MAA与交联剂EDMA的量比为1∶4∶20时,生成的L-Tyr印迹聚合物的萃取效率和饱和吸附量分别可达到为87.46 %和76.01 μmol/g。
2.3 溶剂对合成印迹聚合物吸附性能的影响
结果表明,氯仿极性较弱,为溶剂时所得印迹聚合物的萃取效率、饱和吸附量比另2种溶剂要好,分别为87.73 %和71.87 μmol/g,而乙腈及乙醇为溶剂时,其萃取效率、饱和吸附量仅为55.41 %、52.59 μmol/g和50.04 %、31.30 μmol/g。
2.4 引发温度对合成印迹聚合物吸附性能的影响
试验结果显示,0、20 ℃时制备反应不能进行;40 ℃时制备反应进行不完全,只生成少量的白色聚合物;80 ℃时制备得到的聚合物热稳定性差,呈黄色。60 ℃时制备得到的白色印迹聚合物热稳定好,且萃取效率、饱和吸附量能达到87.31 %、76.97 μmol/g。
单因素试验结果表明,在氯仿溶剂中,以MAA为功能单体,EDMA为交联剂,AIBN为引发剂,L-Tyr与MAA、EDMA、AIBN的量比为10∶40∶200∶1.5,在60 ℃水浴引发聚合制备得到的印迹聚合物萃取效率、饱和吸附量最大。
2.5 正交试验结果
正交试验结果(表1)显示,影响萃取效率、饱和吸附量的因素大小依次为交联剂用量、功能单体用量、温度、溶剂种类;最优化理论条件为B2A2C1D2,即功能单体MAA用量8 mmol,交联剂EDMA 40 mmol,其量比为1∶5,溶剂为氯仿,引发温度60 ℃,为L-Tyr印迹聚合物最佳制备条件,与单因素分析结果一致。

表1 MⅠPs印迹聚合物制备L9(34)正交试验结果Table 1 L9 (34) orthogonal result sand analysis of MⅠPs synthesis
2.6 L-Tyr印迹聚合物红外分析
将模板分子L-Tyr、 萃取前L-Tyr印迹聚合物、萃取后L-Tyr印迹聚合物、空白聚合物进行红外光谱分析[10]并比较(图1)发现,模板分子L-Tyr在3 300 cm-1左右处有氨基(-NH2)的N-H伸缩振动峰,在1 450、1 580、1 512、1 600 cm-1左右处有苯的4个特征吸收峰(谱线1)。谱线2为萃取前L-Tyr印迹聚合物的红外图谱,3 300 cm-1处也有氨基(-NH2)的N-H伸缩振动峰,1 450~1 600 cm-1处也有苯的4个特征吸收峰,显示出模板分子L-Tyr已经与功能单体MAA结合形成了聚合物。经过洗脱剂萃取后得到印迹聚合物MIPs(谱线3),3 300 cm-1处没有氨基(-NH2)的N-H伸缩振动峰,在1 450~1 600 cm-1处也没有苯的4个特征吸收峰,与空白聚合物NMIPs红外图谱(谱线4)显示一致,表明模扳分子L-Tyr已被完全洗脱,得到具有空腔结构的印迹聚合物MIPs。
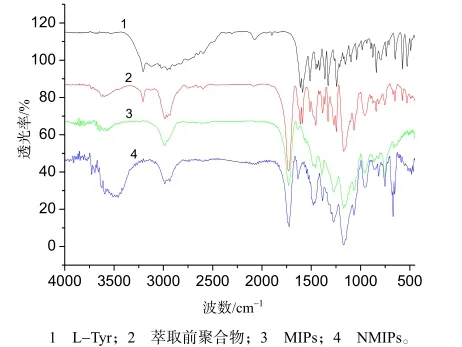
图1 L-Tyr、萃取前聚合物、MⅠPs、NMⅠPs的红外图谱Fig.1 ⅠR spectra of L-Tyr, the polymer before extracting, MⅠPs and NMⅠPs
2.7 L-Tyr印迹聚合物对 L-Tyr的选择性吸附及吸附等温线
用结构与L-Tyr相似的苯丙氨酸L-Phe,考察L-Tyr印迹聚合物特异性吸附情况,如图2所示。结果表明,在MIPs 对L-Tyr的吸附等温线中,随着L-Tyr标准溶液浓度的升高,MIPs的吸附量逐渐增大,这表明MIPs有固定排列且大小及空间位置与L-Tyr互补的空穴。这种空穴对L-Tyr分子具有“记忆” 功能,因而选择性高,吸附能力强。在MIPs对L-Phe的吸附等温线中,L-Phe的吸附量低,这是因为L-Phe的结构与MIPs中印迹空穴不互补,不能与空穴上的位点形成较强的作用力,而造成MIPs对其结合性不强。在NMIPs对L-Tyr的吸附等温线中,随着L-Tyr标准溶液浓度的升高,NMIPs的吸附量则迅速达到饱和,对于相同浓度的L-Tyr标准溶液,MIPs的吸附量均大于NMIPs的吸附量,且二者的吸附量之差随溶液浓度的增加而增大,这表明组成相同的2种聚合物的空间结构存在明显的差异,NMIPs的吸附主要是非特异性吸附,没有选择性,吸附能力弱。
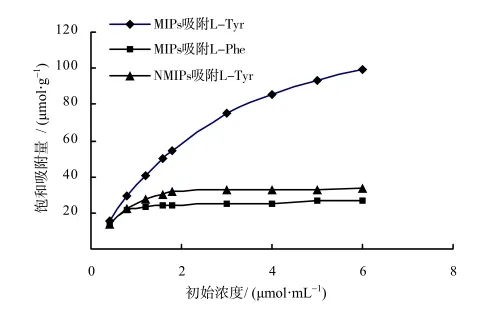
图2 MⅠPs、NMⅠPs的吸附等温线Fig.2 Adsorptive isotherm of MⅠPs and NMⅠPs
从图2可以看出,在MIPs对L-Tyr的吸附等温线中,印迹分子的吸附等温线的形状类似Langumir模型[12]。随着浓度的增大,MIPs对L-Tyr的吸附量逐渐增大,且在6 mmol/L附近趋于饱和。MIPs对L-Tyr的吸附的数据可用于Scatchard[13]方程,其中MIPs各点的回归方程为Q/C=73.81- 0.597 2Q,R2=0.991 2,为一线性方程,说明MIPs表面具有均一选择性的吸附位点。由 Scatchard方程求得Kd=1.674 7 μmol/mL,最大表观结合位点数Qmax=123.593 4 μmol/g。
[1] Wulff G,Sarhan A,Zabrocki K.Enzyme analogue built polymers and their use for the resolution of racemates [J].Tetrahedron Lett,1973,44:4329-4335.
[2] Norrlow O,Glad M,Mosbach K.Acrylic polymer preparation containing recognition sites obtained by imprinting with substrates[J].J Chronatogr,1984,299 (1):29-38.
[3] 张立永,成国祥.分子印迹聚合物微球的制备及应用研究进展[J].功能高分子学报, 2002,15(2):214-218.
[4] 王筱婧,徐江平.作用于蛋白酪氨酸激酶的天然抗肿瘤药物研究进展[J].中南药学,2005,3(10):53-57.
[5] 张志华,黄彦,王晓明.小分子靶向抗癌药物——蛋白酪氨酸激酶抑制剂研究进展[J].药学实践,2006,6(8):50-54.
[6] 胡小刚,汤又文.分子印迹聚合物制备技术研究进展[J].华南师范大学学报:自然科学版,2003,50(3): 150-157.
[7] 汪国松,朱秀芳,王颖臻,等.制备分子模板聚合物的影响因素及控制措施[J].云南化工,2006,33(1): 24-25.
[8] Vlatakisg,Andersson Li,Moller R,et a1. Drug assay using a ntibody mimics made by molecular imprinting [J].Nature,1993,36(1):645.
[9] Mayes A G,Mosbach K.Molecularly imprinted polymer beads:Suspension polymerization using a liquid perfluoro carbon as the dispersing phase[J].Anal Chem,1996,68(8):3769-3774.
[10] 蒋宇翔,赫丽萍,赖承钺,等.头孢氨苄分子印迹聚合物制备及其性能研究[J].化学研究与应用,2009,21(9):1286-1289.
[11] 邴乃慈,许振良,杨座国,等.热聚合制备左氧氟沙星分子印迹聚合物的分子识别特性[J].应用化学,2006,23(10):1085-1089.
[12] 董文国,闫明,吴国是,等.溶剂分子对分子印迹聚合物分子识别能力的影响:实验研究与计算量子化学分析[J].化工学报,2005,56(7):1247-1252.
[13] 张延红,程国斌,马伟.利用Origin软件对吸附等温线拟合进行分析[J].计算机与应用化学,2005,28(10):75-78.
英文编辑:易来宾
