拟南芥psc1突变体降低蔗糖诱导的花青素积累
2011-03-07袁利兵张琨彭志红任春梅
袁利兵,张琨,彭志红,任春梅,
(1.湖南农业大学 生物科学技术学院,湖南 长沙 410128;2.作物基因工程湖南省重点实验室,湖南 长沙 410128)
花青素(anthocyanin)作为植物的次级代谢产物,起吸引昆虫传粉、提高植物耐寒、抗冻、抗旱及渗透应激能力、光保护、清除自由基、抗氧化和抗病虫害等多重作用[1-4]。花青素的生物合成受多基因控制,环境因素会造成植物体内花青素的积累[5],糖作为外界环境信号能诱导植物花青素的积累[6]。拟南芥psc1突变体能够部分抑制coi1突变体对茉莉素的不敏感反应[7],而COI1基因在蔗糖调控花青素生物合成中有着重要作用[8],因此推测psc1突变体可能对蔗糖诱导的花青素积累有影响。笔者以拟南芥野生型Col-0和psc1突变体为材料,研究不同蔗糖浓度下psc1突变体中花青素的积累以及花青素生物合成关键基因DFR[9]的表达,并利用添加表油菜素内酯来进一步研究psc1突变体中花青素的积累。
1 材料与方法
1.1 材 料
拟南芥(Arabidopsis thaliana)野生型(Col-0,WT)和psc1突变体,由作物基因工程湖南省重点实验室植物信号传导课题组提供。表油菜素内酯(epibrassinolide,epi-BL)购自 Sigma公司,TRIzol Reagent购自 Invitrogen公司,反转录试剂盒(Kit-ReverTra Ace-α-TM)购自Toyobo公司。
1.2 方 法
1.2.1 植株的培养和生长条件
拟南芥WT和psc1突变体种子用消毒液浸泡10 min后,无菌水清洗5次,播种于含30 mmol/L蔗糖的1/2MS固体培养基上,经4 °C暗处理3 d后,转入23 °C光照培养7 d(每天光照16 h)。再将拟南芥幼苗转入新的1/2MS培养基,培养基中分别含0、30、60、90、120、150 mmol/L蔗糖,继续生长5 d后提取花青素,同时收取幼苗,经液氮处理后置-80 °C保存。将23 °C光照培养7 d的psc1突变体幼苗转至不添加或添加10 nmol/L表油菜素内酯的含0、90 mmol/L蔗糖[8]的1/2MS培养基,继续光照培养,5 d后提取花青素,将幼苗液氮处理后置-80 °C保存。花青素提取和含量测定参照文献[10]方法进行。
1.2.2 RNA的提取和RT-PCR分析
Trizol法提取于-80 °C保存的幼苗总RNA。RT-PCR分析按照常规操作进行,使用 ABI-2720 Thermal Cycler 型PCR仪,采用反转录试剂盒进行逆转录,得到cDNA第1条链。DFR基因PCR扩增所用的引物为:5'-ATGGTTAGTCAGAAAGAGA CCG-3'和5'-GTCTTATGATCGAGTAATGCGC-3';以ACT2基因为参照基因,所用引物为:5'-TTCCGC TCTTTCTTTCCAAGCTCA-3'和5'-AAGAGGCATC AATTCGATCACTCA-3'。反应体系(20 µL)为:cDNA 1 µL,10×Buffer 2 µL,dNTPs(10 mmol/L) 0.5 µL,Taq酶(5 U/µL)0.3 µL,引物各0.8 µL,补水至20 µL。对DFR和ACT2基因分别进行PCR扩增, PCR反应程序为:95 ℃预变性2 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸60 s,共26个循环,最后72 ℃延伸10 min。RT-PCR产物经2%琼脂糖凝胶电泳检测。
2 结果与分析
2.1 拟南芥psc1突变体在不同蔗糖浓度下花青素的积累
从图1可以看出,WT和psc1突变体的花青素积累量随着蔗糖浓度升高而增加,当蔗糖浓度为30 mmol/L时,WT和psc1突变体中花青素积累量与无糖时相近;浓度为60 mmol/L时,psc1突变体中花青素含量开始低于WT,随着蔗糖浓度的升高,两者的差距变得愈发明显。蔗糖浓度为150 mmol/L时,花青素积累的差异尤为显著,psc1突变体中花青素积累已经远低于WT中的,这说明突变体psc1减少了蔗糖所诱导的花青素积累。

图 1 不同蔗糖浓度下拟南芥花青素的积累Fig.1 Anthocyanin accumulation of Arabidopsis induction by different concentration of sucrose
2.2 不同浓度蔗糖处理下DFR基因的表达
选取0 mmol/L和150 mmol/L蔗糖处理的拟南芥幼苗RNA进行RT-PCR分析,结果(图2)显示,在无蔗糖条件下,WT和psc1突变体中DFR基因几乎不表达;当蔗糖浓度为150 mmol/L时,DFR基因得到表达,但与WT相比,psc1突变体中DFR基因的表达较弱,这与两者花青素积累的变化趋势一致。

图 2 蔗糖诱导DFR基因RT-PCR检测结果Fig.2 RT-PCR anaylsis results of DFR gene induction by sucrose
2.3 表油菜素内酯处理下psc1突变体中花青素的积累
在无糖时,添加表油菜素内酯,对拟南芥psc1突变体花青素的积累影响甚微;当培养基中蔗糖浓度为90 mmol/L时,添加10 nmol/L表油菜素内酯,拟南芥psc1突变体的花青素比未添加的有明显升高。表明表油菜素内酯促进了psc1突变体中蔗糖诱导的花青素积累。
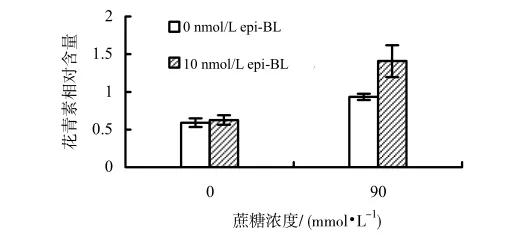
图 3 蔗糖和表油菜素内酯处理下拟南芥psc1突变体花青素的积累Fig.3 Anthocyanin accumulation of psc1 mutant with the treatment of sucrose and epi-BL
2.4 表油菜素内酯处理下psc1突变体中DFR基因的表达
通过RT-PCR分析(图4)得出,当无蔗糖添加时,psc1突变体DFR基因的表达量都非常低;当含有蔗糖处理时,DFR基因得到表达,经10 nmol/L表油菜素内酯处理后,DFR基因表达强烈。说明表油菜素内酯在蔗糖存在情况下促进了psc1突变体中DFR基因的表达。
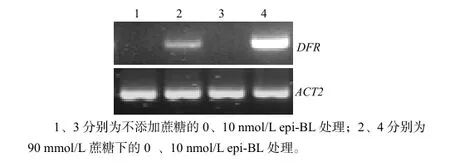
图 4 蔗糖和表油菜素内酯处理下拟南芥psc1突变体DFR基因RT-PCR检测结果Fig.4 RT-PCR anaylsis results of DFR gene of psc1 mutant with the treatment of sucrose and epi-BL
3 讨 论
研究表明,糖与花青素的积累密切相关[11-12],糖作为一种信号分子,通过特异的信号传导途径调节花青素合成相关酶基因的表达,进而影响植物花青素的积累[13]。Teng等[14]和Solfanelli等[15]研究发现,蔗糖能够诱导拟南芥花青素生物合成途径中的某些基因增加其表达量,使植株中花青素的含量增加。本试验用拟南芥WT和psc1突变体研究不同浓度蔗糖诱导花青素的积累,结果与Baier等[16]报道的高糖敏感突变体植株对不同蔗糖浓度表现出相应花青素积累量的研究结果一致,即蔗糖浓度影响花青素的积累。由于psc1突变体是DWF4基因的弱突变体,表现出芸薹素生物合成缺陷型突变体dwf4的部分表型[7],因此用添加外源芸薹素表油菜素内酯进一步研究psc1突变体中蔗糖诱导花青素积累情况。研究发现,表油菜素内酯对花青素的影响需要蔗糖的参与,这与相关研究发现外源植物激素只有在糖存在时才能诱导花青素生物合成相关基因的表达[8]一致。
各种植物激素与糖相互作用形成一个复杂的信号网络,通过综合作用调节花青素的生物合成。不同激素与糖的相互作用对花青素生物合成的影响不同。在拟南芥中,茉莉素和脱落酸对蔗糖有协同作用,都增强花青素合成途径中的大部分基因的表达,而赤霉素却抑制这一类基因的表达[8]。本研究显示,psc1突变体中蔗糖所诱导的花青素积累减少,并且降低蔗糖诱导的DFR基因的表达。而添加表油菜素内酯后能够促进psc1突变体中蔗糖诱导的花青素积累和DFR基因的表达。这意味着芸薹素可能与茉莉素和脱落酸一样,能协同蔗糖调节花青素生物合成的过程。
植物体内调控花青素生物合成的基因除结构基因外,还包括编码调控花青素合成的转录因子的调节基因[17-18],因此,激素与糖之间的相互作用对花青素积累的调控显得更为复杂。此外,植物体内激素之间彼此也存在着复杂的相互作用,psc1突变体中DWF4基因的表达缺陷及外源芸薹素表油菜素内酯在与蔗糖相互作用时是否又与内源激素系统发生复杂的相互作用,从而影响花青素的生物合成,还有待深入研究。
[1] Martin C, Gerats T. Control of pigment biosynthesis genes during petal development[J]. Plant Cell, 1993, 5(10): 1253-1264.
[2] Dixon R A, Steele C L. Flavonoids and isoflavonoids: A gold mine for metabolic engineering[J]. Trends Plant Sci, 1999, 4(10): 394-400.
[3] Harborne J B, Williams C A. Advances in flavonoid research since 1992[J]. Phytochemistry, 2000, 55(6): 481-504.
[4] Shirley B W. Flavonoid biosynthesis:A colorful model for genetics, biochemistry, cell biology, and biotechnology [J]. Plant Physiol, 2001, 126(2): 485-493.
[5] Chalker-Scott L. Environmental significance of anthocyanins in plant stress responses [J]. Photochemistry and Photobiology, 1999, 70(1): 1-9.
[6] Weiss D. Regulation of flower pigmentation and growth: Multiple signaling pathways control anthocyanin synthesis in expanding petals[J]. Physiol Plant, 2000, 110(2): 152-157.
[7] Ren C M, Han C Y, Peng W, et al. A leaky mutation in
DWARF4reveals an antagonistic role of brassinosteroid in the inhibition of root growth by jasmonate inArabidopsis[J]. Plant Physiol, 2009, 151(3): 1412-1420.
[8] Loreti E, Povero G, Novi G, et al. Gibberellins, jasmonate and abscisic acid modulate the sucrose- induced expression of anthocyanin biosynthetic genes inArabidopsis[J]. New Phytol, 2008, 179(4): 1004-1016.
[9] O'Reilly C, Shepherd N S, Pereira A, et al. Molecular cloning of thea1locus ofZea maysusing the transposable elementsEnandMu1[J]. EMBO J, 1985, 4(4): 877-882.
[10] Deikman J, Hammer P E. Induction of anthocyanin accumulation by cytokinins inArabidopsisthaliana[J]. Plant Physiol, 1995, 108(1): 47-57.
[11] Moalem-Beno D, Tamari G, Leitner-Dagan Y, et al. Sugar-dependent gibberellin-induced chalcone synthase gene expression in petunia corollas[J]. Plant Physiol, 1997, 113(2): 419-424.
[12] Neta-Sharir I, Shoseyov O, Weiss D. Sugars enhance the expression of gibberellin-induced genes in developing petunia flowers[J]. Physiologia Plantarum, 2000, 109(2): 196-202.
[13] Sheen J, Zhou L, Jang J C. Sugars as signaling molecules [J]. Current Opinion in Plant Biology, 1999, 2(5): 410-418.
[14] Teng S, Keurentjes J, Bentsink L, et al. Sucrose-specific induction of anthocyaninbiosynthesis inArabidopsisrequires theMYB75/PAP1gene[J]. Plant Physiol, 2005, 139(4): 1840-1852.
[15] Solfanelli C, Poggi A, Loreti E, et al. Sucrose-specific induction of the anthocyanin biosynthetic pathway inArabidopsis[J]. Plant Physiol, 2006, 140(2): 637-646.
[16] Baier M, Hemmann G, Holman R, et al. Characterization of mutants inArabidopsisshowing increased sugarspecifc gene expression, growth, and developmental responses[J]. Plant Physiol, 2004, 134(1): 81-91.
[17] Holton T A, Cornish E C. Genetics and biochemistry of anthocyanin biosynthesis[J]. Plant Cell, 1995, 7(7): 1071-1083.
[18] Springob K, Nakajima J, Yamazaki M, et al. Recent advances in the biosynthesis and accumulation of anthocyanins [J]. Nat Prod Rep, 2003, 20(3): 288-303.
英文编辑:易来宾
