猪传染性胃肠炎病毒S基因的SYBR Green I荧光定量RT-PCR检测
2011-03-07张云王亚宾陈丽颖张红英侯贝贝崔保安胡慧
张云,王亚宾,陈丽颖,张红英,侯贝贝,崔保安,胡慧
(河南农业大学 牧医工程学院,河南 郑州 450002)
猪传染性胃肠炎(transmissible gastroenteritis of swine,TGE)是由猪传染性胃肠炎病毒(transmissible gastroenteritis virus,TGEV)引起的一种以严重腹泻、呕吐和脱水为临床特征的高度接触性传染病。不同年龄和品种的猪均可感染,3周龄以下仔猪的致死率可达100%。该病呈全球性分布,已成为重要的猪病毒性腹泻病之一[1]。混合性感染和细菌继发感染常使临床症状复杂化,根据流行病学和临床症状,只能对该病作出初步诊断,特别是不能有效地区分TGEV与猪流行性腹泻病毒(PEDV)及猪轮状病毒(PRV)感染[2-4],因此,猪传染性胃肠炎病毒快速检测方法的研究对猪传染性胃肠炎的预防和控制具有重要意义。目前,检测TGEV的常规方法主要有病毒分离鉴定、电镜观察、ELISA、免疫荧光抗体试验、病毒中和试验、常规RT-PCR和多重RT-PCR技术等,但这些方法操作繁琐,不能进行定量分析且灵敏度不高[5-9]。实时荧光定量PCR技术(real-time PCR)可以对初始模板定量,具有操作简便快捷、灵敏度高、特异性强等特点,且整个过程无需对PCR产物进行琼脂糖凝胶电泳等后期处理,可以有效防止检测过程中的污染及假阳性,可大大提高检测效率。该方法在病原体定性和定量检测方面已经得到了广泛应用[10]。笔者以猪传染性胃肠炎病毒纤突糖蛋白S基因为靶基因,旨在建立一种特异性强、敏感性高的实时荧光定量RT-PCR方法,对TGE的快速诊断与监测提供理论依据。
1 材料与方法
1.1 毒株和菌株
猪传染性胃肠炎病毒(TGEV)疫苗株、猪瘟病毒(CSFV)、猪蓝耳病病毒(PRRSV)、猪伪狂犬病毒(PRV)、猪圆环病毒Ⅱ型病毒(PCV-2)、猪细小病毒(PPV)和猪乙型脑炎病毒(JEV)以及大肠杆菌DH5α均由河南省动物性食品安全重点实验室保存。
1.2 主要试剂和仪器
pGEM-T Easy载体、反转录试剂盒和T4DNA连接酶均购自Promega公司;限制性内切酶、PCR相关试剂、DNA Marker、异丙基-β-D-硫代半乳糖苷(IPTG)、5-溴-4-氯-3-吲哚半乳糖苷(X-gal)、DNA凝胶回收试剂盒购自大连宝生物公司;TRIzol试剂购自Invitrogen公司;SYBR® Premix ExTaq™Ⅱ聚合酶购自上海生工生物工程技术服务有限公司。PCR仪(PTC 200)为美国MJResearch公司产品;Rotor-Gene 3000型实时定量PCR扩增仪为澳大利亚Corbett Reseach公司产品。其他常规试剂及仪器均由河南省动物性食品安全重点实验室提供。
1.3 引物的设计与合成
应用Primer Premier 5.0生物软件,参照GenBank发表的TGEVS基因序列(NC002306)设计1对引物,上游引物序列为5′-GTATTGGGATTATGCT-3′;下游引物序列为5′-CCACAATTTGCCTCTG-3′,预计扩增片段为258 bp。引物由上海生工生物工程技术服务有限公司合成。
1.4 TGEV S基因的RT-PCR
按Invitrogen公司的TRIzol试剂说明书提取病毒总RNA,提取的RNA用20 µL无RNase水溶解沉淀,-20 ℃保存。以提取的RNA为模板,按照反转录说明书进行cDNA合成,随后进行PCR或置于-20 ℃保存。
PCR扩增体系为25 µL,其中PremixTaq12 µL,cDNA 2 µL,上、下游引物各0.5 µL (50 pmol/µL),加去离子水至25 µL。PCR反应参数为95 ℃预变性5 min,95 ℃变性50 s,48 ℃退火30 s,72 ℃延伸30 s,35个循环,最后72 ℃延伸 10 min。反应结束后取5 µL扩增产物进行琼脂糖凝胶电泳检测。
1.5 重组质粒模板的制备
将PCR产物纯化回收后连接到pGEM-T Easy载体,并将其转化DH5α感受态细胞,挑取疑似阳性菌落进行培养,提取重组质粒,对重组质粒进行PCR、酶切鉴定,将鉴定正确的阳性重组质粒菌液送宝生物工程(大连)有限公司测序验证。
1.6 SYBR Green Ⅰ实时荧光定量RT-PCR扩增及标准曲线的制备
取经序列测定验证的阳性重组质粒,用紫外分光光度计测定质粒模板的浓度,计算标准品的拷贝数。按10倍梯度稀释,将其作为实时荧光定量PCR阳性标准模板进行荧光定量PCR扩增。通过预试验对TGEVS基因的SYBR GreenⅠ荧光定量PCR的反应条件进行优化,选取最佳反应体系和反应条件。反应体系为20 µL,其中,上、下游引物各0.5 µL,SYBR® Premix ExTaq™ Ⅱ聚合酶10 µL,模板1 µL,灭菌去离子水8 µL。将上述反应体系混匀后进行实时荧光定量PCR扩增,反应参数为:95 5 min℃ ,95 10 s℃ ,56 15 s℃ ,72 15 s℃ ;45个循环。利用随机软件进行分析,得到动力学曲线及标准曲线。
1.7 特异性、重复性和敏感性试验设计
分别提取CSFV、PRRSV、PRV、PCV-2、PPV和JEV阳性样品的RNA/DNA,其中,CSFV、PRRSV和JEV为提取病毒RNA后经反转录的cDNA,以PBS为阴性对照,按本试验所优化的条件进行荧光定量PCR,通过对Ct值和溶解曲线峰值温度进行分析,验证其特异性。
将已制备的TGEVS基因的阳性质粒进行10倍梯度稀释,进行荧光定量PCR检测,以此计算出荧光定量PCR所能检出的最低模板拷贝数。
选取TGEV同一浓度的阳性质粒标准品进行SYBR Green I荧光定量PCR反应,每一个样品同时做2个重复,验证TGEV SYBR Green I荧光定量PCR方法的重复性。
1.8 临床样品检测结果比较
取60份临床病料进行处理,提取RNA,用所建立的荧光定量RT-PCR方法和普通RT-PCR方法同时进行检测,比较2种方法的检出情况,同时设置阳性病料和阴性病料作为对照。
2 结果与分析
2.1 TGEV S基因的PCR扩增结果与测序分析
以TGEVS基因设计引物并进行反转录PCR扩增,得到约250 bp的目的片段,与预期的条带一致(图1)。将阳性目的片段切胶回收、纯化、克隆到pGEM-T Easy载体,得到阳性重组质粒。将其测序结果与GenBank进行BLAST比对,结果证实该扩增产物与TGEVS基因相应区域的同源性为100%。

图1 TGEV S基因的RT-PCR扩增结果Fig.1 RT-PCR result of S gene of TGEV
2.2 TGEV S基因的荧光定量PCR扩增结果
将标准样品按10倍倍比稀释,通过预试验,筛选出3×106、3×105、3×104、3×103、3×102拷贝/µL共 5个稀释度的重组质粒,分别以此为模板进行荧光定量PCR扩增,根据得到质粒标准模板的real-time PCR扩增曲线绘制出标准曲线(图2)。结果表明,标准品浓度为3×106~3×102拷贝/µL时可以得到较为理想的标准曲线,相关系数为0.984 5。
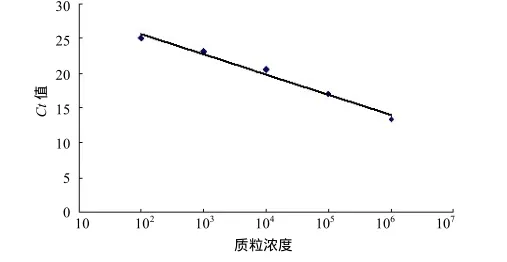
图2 TGEV S基因荧光定量PCR标准曲线Fig.2 Standard curve of real-time PCR for TGEV S gene
7个浓度标准品的溶解温度为87.7~88.5 ℃,约有1 ℃的波动,属于正常范围,平均溶解温度约为88.1 ℃,波峰高度与质粒浓度呈正相关(图3)。

图3 TGEV S基因荧光定量PCR的溶解曲线Fig.3 The melting curves of real-time PCR for TGEV S gene
2.3 荧光定量PCR的特异性试验结果
按照上述SYBR Green I荧光定量反应体系对TGEV、CSFV、PRRSV、PRV、PCV-2、PPV和JEV的阳性样品进行荧光定量PCR检测,只有TGEV出现了单一的S型扩增曲线,而CSFV、PRRSV、PRV、PCV-2、PPV和JEV均不能检测出S型曲线(图4),表明所建立的针对TGEV的荧光定量PCR方法具有较强的特异性。
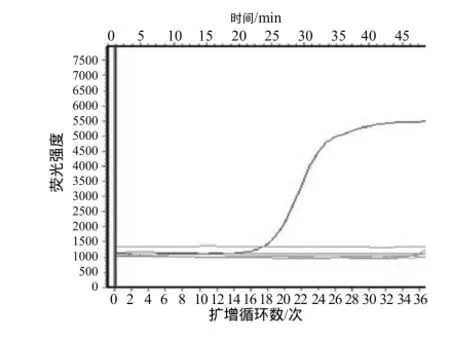
图4 TGEV S基因荧光定量PCR的特异性检测Fig. 4 Specificity of real-time PCR for TGEV S gene
2.4 荧光定量PCR的敏感性试验结果
将制备的质粒模板按10倍倍比分别稀释成3×106、3×105、3×104、3×103、3×102、3×10、3拷贝/µL的标准品,并分别以此为模板进行荧光定量PCR扩增,得到不同浓度质粒标准模板的real-time PCR扩增曲线(图5)。结果显示其灵敏度为30拷贝/µL。

图5 TGEV S基因荧光定量PCR的敏感性试验结果Fig.5 Sensitivity of real-time PCR for TGEV S gene
2.5 荧光定量PCR的重复性试验结果
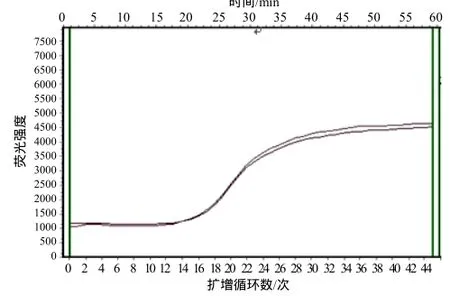
图6 TGEV S基因荧光定量PCR的重复性试验结果Fig.6 Repeatability of real-time PCR for TGEV S gene
由图6可知,同一浓度所得的S型曲线相似,实际所得的Ct值基本相同,变异很小,可见所建立的TGEVS基因的荧光定量PCR方法具有较好的重复性。
2.6 临床样品检测
通过对60份疑似TGEV粪样用SYBR GreenⅠ荧光定量PCR进行检测,共检测到28份阳性、32份阴性,而普通RT-PCR检测到20份阳性、40份阴性,说明SYBR GreenⅠ荧光定量方法检测TGEV的灵敏度比普通RT-PCR方法高,能检出普通RT-PCR不能检出的病料。
3 结论与讨论
本试验中,根据GenBank收录的TGEV-Miller毒株的S蛋白基因序列,设计合成1对特异性引物,用RT-PCR方法从疫苗株中扩增TGEVS基因的部分保守片段,并克隆到pGEM-T Easy载体上,得到重组质粒作为荧光定量RT-PCR检测的标准模板,进行SYBR GreenⅠ荧光定量RT-PCR扩增,并制作标准曲线,建立了TGEV的荧光定量RT-PCR检测方法。结果表明:该方法检测灵敏度可达30 拷贝/μL,与猪圆环病毒、猪乙型脑炎病毒、猪伪狂犬病毒、猪瘟病毒和猪流感病毒和猪细小病毒不发生交叉反应,具有重复性好、特异性强、灵敏度高等优点,可用于临床TGEV感染的早期诊断以及分子流行病学调查。
TGEV纤突糖蛋白(S蛋白)是由约4. 35 kb的S基因编码的糖蛋白,是唯一能诱导机体产生中和抗体和提供免疫保护作用的结构蛋白,是免疫预防和诊断研究的重点。在S基因的近N端包含了4个主要的抗原决定位点A、B、C、D,而呼吸道冠状病毒(PRCV)是TGEV的基因缺失变异株,二者核苷酸序列的同源性达96%,与TGEV相比,PRCV在S基因N末端有621~681个碱基不等的缺失[8]。本试验中根据TGEV的S基因序列,选取了扩增PRCV缺失的部分S基因,建立的实时荧光定量RT-PCR方法在临床上可以用来区分TGEV和PRCV。
TGEV检测的发展趋势是检测方法必须简便、快速、特异、灵敏和批量检测。荧光定量PCR技术应用于TGEV检测,能在病毒隐性感染和猪发病早期进行快速确诊和实时监测,但目前的研究尚少。Chen等[10]以Invitrogen公司的LUX (light upon extensi on, LUX)引物为基础建立了检测 TGEV的荧光定量PCR方法,其检测敏感性比常规RT-PCR方法提高了10倍。白兴华[11]等根据TGEV的N基因和猪肌动蛋白的基因序列设计合成引物和探针,进行TaqMan荧光定量RT-PCR扩增,其检测敏感性达15.3拷贝/µL。徐丽秋等[12]根据TGEVN基因的保守区序列设计合成引物和探针,建立了一种特异、灵敏、快速的TaqMan荧光定量RT- PCR方法,与常规RT-PCR检测方法相比,其灵敏度高100倍。与TaqMan 探针法相比,SYBR GreenⅠ荧光定量PCR方法更加简便,只需在SYBR GreenⅠ反应混合液中加入引物和待测样品,其成本相对低廉,且无需合成价格昂贵的探针。选用SYBR GreenⅠ荧光定量PCR来检测TGEV具有良好的重复性和特异性,其最低检测限为30 拷贝/µL。与普通RT-PCR相比,SYBR GreenPCRⅠ 的扩增和检测都在同一管内完成,不需要后续的电泳检测,有效解决了污染问题,而且操作更简便,检测时间不到3 h,是一种快速、有效检测TGEV的方法,可用于临床TGEV感染检测。
[1] 殷震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997:1137-1182.
[2] Jung K,Kim J,Kim O,et al.Differentiation between porcine epidemic diarrhea virus and transmissible gastroenteritis virus in formalin-fixed paraffin-embedded tissues by multiplex RT-nested PCR and comparison with in situ hybridization[J].J Virol Methods,2003,108(1):41-47.
[3] Song D S,Kang B K,Oh J S,et al.Multiplex reverse transcription-PCR for rapid differential detection of porcine epidemic diarrhea virus,transmissible gastroenteritis virus,and porcine group a rotavirus[J].J Vet Diagn Invest,2006,18(3):278-281.
[4] Ben S A,Chupin S A,Bjadovskaya O P,et al.Multiplex nested RT-PCR for the detection of porcine enteric viruses[J].J Virol Methods,2010,165(2):283-293.
[5] 徐丽秋,贾斐,刘海防,等.猪传染性胃肠炎分子生物学诊断方法[J].中国动物检疫,2008,25(8) :52-54.
[6] 李小兰,聂福平,李应国,等.猪传染性胃肠炎病毒NASBA检测方法的建立[J].中国预防兽医学报,2010,32(6) :451-454.
[7] Liu C,Kokuho T.A serodiagnostic ELISA using recombinant antigen of swine transmissible gastroenteritis virus nueleoprotein[J].J Vet Med Sci,2001,63(11) :1253-1256.
[8] Carman S,Josephson G.Field validation of a commercial blocking ELISA to diferentiate antibody to transmissible gastroenteritis virus (TGEV) and porcine respiratory colonavirus and to identify TGEV infected swine herds[J].Vet Diagn Invest,2002,14(2):97˜-105.
[9] 贾赞,胡传伟,简中友,等.检测猪传染性胃肠炎病毒RT-PCR方法的建立[J].检验检疫科学,2006,16(4):12-15.
[10] Chen R,Huang W M,Lin Z X,et a1.Development of a novel real-time RT-PCR assay with LUX primer for the detection of swine transmissible gastroenteritis virus[J].J Vir Met,2004,122:57-61.
[11] 白兴华,原志伟,李军民,等.TaqMan荧光定量RT-PCR检测猪传染性胃肠炎病毒的研究[J].检验检疫学刊,2009,19 (5):17-20.
[12] 徐丽秋,苏永生,赵玉军,等.检测猪传染性胃肠炎病毒TaqMan荧光定量RT-PCR方法的建立与初步应用[J].畜牧与兽医,2009,41(9):14-17.
