嗜水气单胞菌感染后褶纹冠蚌抗氧化[0]因子的变化
2011-03-07吴丹李琰胡宝庆文春根
吴丹,李琰,胡宝庆,文春根
(南昌大学 生物科学系,江西 南昌 330031)
活性氧(ROS)是需氧生物生命活动中的代谢产物及其衍生的氧自由基,在生物体内参与能量的产生、细胞的吞噬、细胞生长的调节和细胞内信号的传导,以及一些重要生物复合物的合成[1]。自由基过多会引起 DNA 损伤、酶失活、脂质过氧化等一系列氧化损伤,从而导致生物体的生理病变[2]。在正常机体内,ROS会被抗氧化系统的酶降解,以维持机体的健康状态,即超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽(GSH)等抗氧化因子调节体内ROS的水平,以适应外界环境,保护机体免受损伤[3-4]。贝类受到外源异物刺激后,其血细胞会产生典型的呼吸爆发现象,同时产生具有杀菌作用的ROS[5]。贝类血细胞通过吞噬和包囊作用来清除细胞内病原体和胞外寄生虫[6-7]。这一过程被认为是吞噬细胞的氧依赖性杀菌途径之一[8-9]。大量产生的ROS会引起贝类体内各种抗氧化酶活力的变化。外源微生物或其他刺激物对贝类抗氧化系统的影响已有相关研究[10-11],且主要是关于对海洋贝类的研究,对淡水贝类的研究尚少。
褶纹冠蚌 (Cristaria plicata) 是中国主要淡水育珠蚌之一,具有较高的经济价值。嗜水气单胞菌(Aeromonas hydrophila) 是水环境中的条件致病菌,可以引起贝类等水生动物组织或器官病变,也能影响抗氧化系统相关酶的活性[12]。笔者用嗜水气单胞菌感染褶纹冠蚌,研究感染后褶纹冠蚌抗氧化因子的变化,以期为淡水贝类非特异免疫功能的研究提供理论依据。
1 材料与方法
1.1 材 料
嗜水气单胞菌菌种由中国科学院水生生物研究所提供,由南昌大学水产动物寄生虫与免疫学研究室保种。褶纹冠蚌采自鄱阳湖。测定超氧化物歧化酶 (SOD)、谷胱甘肽过氧化物酶 (GPX)、谷胱甘肽 (GSH)、过氧化氢 (H2O2) 及丙二醛 (MDA)的试剂盒由南京建成生物工程研究所提供,其产品批号均为20100601。
1.2 方 法
1.2.1 试验设计
选择壳长(9.66±1.07) cm、壳高(6.58±0.85) cm的健康蚌,在水族箱中连续充气暂养1周,每天换水1次,水温保持(25±1) ℃。
将保存的嗜水气单胞菌接入胰蛋白胨大豆液体培养基(TSB),30 ℃、200 r/min 振荡培养至OD600nm为 0.6 左右,于4 ℃ 冰箱中保存,备用。选取健康的褶纹冠蚌 40 只,随机分成 2 组,分别用微量注射器从试验组每只蚌后闭壳肌注射浓度为 109个细胞/mL的嗜水气单胞菌菌液0.1 mL,对照组注射等量的无菌生理盐水。
1.2.2 血清样品和肝胰腺提取液的制备
注射嗜水气单胞菌后,分别在注射后3、6、12、24、48 h 用注射器从试验组和对照组各蚌的闭壳肌血窦中取血[13],每个时段各取 4 只蚌,每只蚌取血10 mL,分别装入10 mL的离心管,然后分别以4 ℃,3 600 r/min离心10 min,移出上清液,获得试验所用血清样品,置于4 ℃冰箱中保存。
取血后,每只蚌取出适量肝胰腺,滤纸吸干水分后称重,加入无菌生理盐水,使组织匀浆液的质量浓度达到0.1 g/mL,于冰浴中匀浆后,以4 ℃、3 000 r/min离心10 min,其上清液即为肝胰腺组织提取液,置于4 ℃冰箱中保存。
1.2.3 血清和肝胰腺抗氧化指标的测定
SOD 活性测定采用羟胺法。血清中SOD活性为每1 mL反应液中SOD抑制率达50%时所对应的SOD量,单位为U/mL;组织匀浆中SOD活性为每1 mg组织蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD量,单位为U/mg。GPX活性测定采用2-硫代2-硝基苯甲酸间接法。因GPX可以促进H2O2与GSH反应生成H2O及氧化型谷胱甘肽(GSSG),因此,GPX的活力以催化GSH的反应速率来表示,即用单位时间内GSH减少的量来表示。在GPX催化下,GSH和DTNB作用生成黄色的5-硫代2-硝基苯甲酸阴离子,测定该离子的浓度,即可计算出GSH减少的量。组织中GPX活性用扣除非酶反应作用后,每1 mg蛋白质每1 min反应体系中GSH浓度降低1 μmol/L时GPX的量表示。由于GSH在没有酶的条件下也能进行氧化反应 (非酶反应),所以,最后计算酶活性时,必须扣除非酶反应引起的GSH的减少量。组织中GPX活性为扣除非酶反应作用后,反应体系中GSH浓度降低1 μmol/L时GPX的量;血清中GPX活性为每 0.1 mL血清在37 ℃反应5 min,扣除非酶促反应作用后,反应体系中GSH浓度降低1 μmol/L时GPX的量。MDA含量的测定采用TBA法。可溶性蛋白质含量用考马斯亮蓝法测定。
1.3 数据处理
采用SPSS 13.0软件对试验数据进行处理。利用方差分析和t检验进行统计学分析。
2 结果与分析
2.1 嗜水气单胞菌感染对褶纹冠蚌血清和肝胰腺中SOD活性的影响
经嗜水气单胞菌感染后,褶纹冠蚌血清和肝胰腺中的SOD活性均先降低后升高再降低 (表1,表2)。感染后3 h,血清和肝胰腺中SOD的活性均最高。血清中SOD的活性在 6 h 时最低,12~24 h变化不大 (表1);肝胰腺中SOD的活性在6~12 h逐渐降低,24 h时略有升高,然后逐渐降低,48 h时最低(表2)。对照组血清中SOD活性先升高后降低,在12 h时最高;肝胰腺中SOD活性先升高后降低,12 h时最高。t检验结果显示:试验组与对照组中血清SOD活性在3 h时有显著差异(P<0.05),肝胰腺中SOD活性各时段均无显著差异。
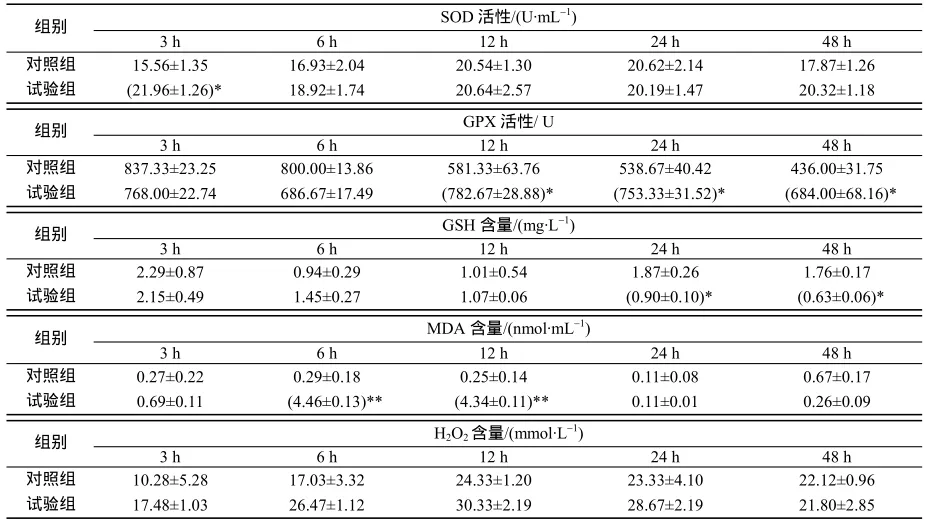
表1 嗜水气单胞菌感染后褶纹冠蚌血清中的抗氧化因子Table 1 Antioxidant factors in blood serum from Cristaria plicata infected with Aeromonas hydrophila

表2 嗜水气单胞菌感染后褶纹冠蚌肝胰腺中的抗氧化因子Table 2 Antioxidant factors in hepatopancreas from Cristaria plicata infected with Aeromonas hydrophila
2.2 嗜水气单胞菌感染对褶纹冠蚌血清和肝胰腺中GPX活性的影响
经嗜水气单胞菌感染后,血清中GPX的活性3 h后开始缓慢下降,至6 h后又逐步上升,到12 h时最高,然后缓慢下降,48 h时基本恢复(表1)。肝胰腺中GPX的活性先升高,6 h后开始下降,到12 h降至最低,然后再上升,升至24 h后再下降,48 h后降至最低水平(表2)。对照组血清中GPX的活性缓慢下降,48 h降至最低。对照组肝胰腺中 GPX活性先逐步升高,在24 h时最高,然后下降。t检验结果显示:试验组与对照组血清中 GPX的活性在12、24和48 h时均有显著差异(P<0.05),肝胰腺中GPX的活性没有显著差异。
2.3 嗜水气单胞菌感染对褶纹冠蚌血清和肝胰腺中GSH含量的影响
经嗜水气单胞菌感染后,褶纹冠蚌血清中GSH的含量在3~48 h呈下降趋势(表1);肝胰腺中GSH的含量在3~6 h升高,6 h后持续下降,48 h降至最低(表2)。对照组血清中GSH的含量先降低后升高,6 h时最低,24 h时最高;肝胰腺中GSH的含量先升高后降低,再升高至24 h的最高后降低。t检验结果显示:试验组与对照组血清中GSH的含量在24 h和48 h时有显著差异(P<0.05,表1);肝胰腺中GSH的含量在24 h时有显著差异(P<0.05,表2)。
2.4 嗜水气单胞菌感染对褶纹冠蚌血清和肝胰腺中MDA含量的影响
经嗜水气单胞菌感染后,褶纹冠蚌血清中MDA的含量变化很大,3 h后迅速降低,24 h时恢复到正常水平(表1);肝胰腺中MDA含量在3~6 h基本无变化,6 h后持续下降,至24 h降至最低,然后开始恢复,至48 h恢复到初始水平(表2)。对照组血清中MDA含量在6~24 h基本无变化;肝胰腺中MDA含量在3~24 h下降明显,24 h时最低点,24 h后有所升高。t检验结果显示:试验组与对照组血清中MDA含量在6 h和12 h时差异极显著(P<0.01)。
2.5 嗜水气单胞菌感染对褶纹冠蚌血清和肝胰腺中H2O2含量的影响
经嗜水气单胞菌感染后,血清中 H2O2的含量与对照组血清中 H2O2的含量变化趋势基本一致,均在12 h时最高,之后平缓下降(表1)。t检验结果显示:试验组与对照组血清中 H2O2含量均无显著差异(P>0.05)。经嗜水气单胞菌感染后,肝胰腺中H2O2的含量在12 h时最高,在12~48 h变化不大(表2)。对照组肝胰腺中H2O2的含量在3~48 h变化不明显。t检验结果显示:试验组与对照组肝胰腺中H2O2含量无显著差异(P>0.05)。
3 结论与讨论
褶纹冠蚌经嗜水气单胞菌感染后,由SOD、GPX活性及GSH、H2O2、MDA含量的变化可以看出,感染后的褶纹冠蚌由于呼吸爆发产生了更多的ROS。SOD和GPX活性增加,GSH含量随试验时间的延长而降低,这说明在一定程度上嗜水气单胞菌能诱导SOD和GPX的活性,清除活性氧自由基,但MDA含量的变化表明嗜水气单胞菌对褶纹冠蚌造成了氧化损伤。
适当的刺激会导致吞噬细胞经历呼吸爆发并产生大量的细胞毒氧化剂,即胞毒活性氧[14]。在绝大多数双壳或腹足贝类中都发现了伴随吞噬的呼吸爆发现象[5]。呼吸爆发产生的ROS可以对细菌等外来异物进行杀灭,在抗菌、抗病中起着关键作用。不同外源物刺激贝类所产生的呼吸爆发现象存在差别。用海洋酵母细胞和酵母聚糖刺激皱纹盘鲍,其血细胞在吞噬活动中明显地产生呼吸爆发现象和活性氧[15]。褶纹冠蚌经嗜水气单胞菌感染后,血清和肝胰腺中过氧化氢的含量均稍高于对照组,且肝胰腺中的过氧化氢含量比血清中的高得多,这表明感染后的褶纹冠蚌由于呼吸爆发产生了更多的ROS。肝胰腺中过氧化氢含量比血清高,可能是由于肝胰腺的抗氧化能力高于血清。肝胰腺抗氧化酶种类和数量较多,抗氧化物质较为丰富,尤其是肝胰腺中 SOD等过氧化物酶的含量较高,所以,其清除活性氧的能力较强,且 SOD歧化超氧阴离子时也会产生过氧化氢[16-17]。
虽然呼吸爆发产生的活性氧具有杀菌作用,但ROS对贝类本身也有毒害作用,必须及时清除[18]。SOD、CAT、GPX等抗氧化酶可以清除活性氧自由基,维持正常生理活动。背角无齿蚌经嗜水气单胞菌感染后,其血清和肝胰腺SOD活性均是先升高后降低,12 h时达到最高点;肝胰腺SOD活性在12~48 h下降平缓[19]。SOD活性的升高,意味着有大量超氧阴离子氧化自由基产生,表明生物有机体抗氧化性和免疫能力增强。褶纹冠蚌经嗜水气单胞菌感染后,其血清和肝胰腺SOD的活性都在短时间内显著升高,说明嗜水气单胞菌能在短时间内提高SOD活性,清除体内多余的活性氧自由基,在体内自由基达到平衡时,SOD的活性恢复到正常水平。
GPX是生物机体内重要的抗氧化酶之一,它可以消除机体内的过氧化氢及脂质过氧化物,使细胞膜和其他生物组织免受过氧化损伤[20]。褶纹冠蚌经嗜水气单胞菌感染后,开始时血清中 GPX活性比对照组的稍低,这可能是由于嗜水气单胞菌在短时间内还未能激活血清中GPX的活性;6 h后血清中GPX的活性比对照组的高,肝胰腺中GPX的活性在3~48 h都比对照组的高,这表明肝胰腺的GPX对嗜水气单胞菌的刺激反应较快,而血清中的GPX对菌的刺激反应迟缓。
GSH是抗氧化系统中重要的一类清除活性氧自由基的小分子物质。当机体受到外源化学物的攻击时,GSH与外源化学物结合的功能及抗氧化功能在保持细胞和细胞器膜结构的完整性和肝脏解毒方面起着非常重要的作用[21]。用 10 μg/L MC-LR处理鲤肝细胞,6 h后GSH含量明显下降,而对照组GSH只略微下降,表明GSH参与了防御MC-LR造成的氧化损害[22]。经嗜水气单胞菌感染后,褶纹冠蚌血清中GSH的含量一直呈下降趋势,表明GSH参与了对活性氧的清除;肝胰脏中 GSH含量的变化,可能是肝胰腺的 ROS对嗜水气单胞菌的刺激处于氧化应激状态,当SOD、GPX等抗氧化酶活性还未起作用时,GSH含量升高,而抗氧化酶活性升高时会消耗GSH,从而使其含量下降。
MDA含量的变化可反映机体受氧化损伤的程度。用高浓度的 Ce(NO3)3处理蚌[0]3 d时,肝脏MDA含量显著降低,饲养15 d后,MDA含量均显著高于对照组,说明Ce(NO3)3超过一定浓度可诱发机体脂质过氧化,也表明Ce对三角帆蚌机体产生影响的原因之一是随着体内Ce含量的增加,体内自由基积累,加剧了膜脂过氧化,使膜的结构和功能遭受破坏,进而引起一系列代谢紊乱,最终对三角帆蚌造成毒害[23]。经嗜水气单胞菌感染后,褶纹冠蚌肝胰腺中 MDA含量略高于对照组,血清中MDA含量在3~24 h明显高于对照组,这表明嗜水气单胞菌对机体造成了一定程度的氧化损伤,也可能是因为机体受嗜水气单胞菌刺激产生了氧化胁迫。
[1] Loughlin K R,Manson K,Cragnale D,et al.The use of hydrogen peroxide to enhance the efficacy of doxorubicin hydrochloride in a murine bladder tumor cell line[J].J Urol,2001,165(4):1300-1304.
[2] Jin L H,Bahn J H,Eum W S,et al.Transduction of human catalase mediated by an HIV-1 TAT protein basic domain and arginine-rich peptides into mammalian cells[J].Free Radic Biol Med,2001,31(11):1509-1519.
[3] Leinö S,Lehtonen K K.Seasonal variability in biomarkers in the bivalvesMytilus edulisandMacoma balthicafrom the northern Baltic sea [J].Comparative Biochemistry and Physiology,2005,140:408-421.
[4] Soldatov A A,Gostyukhina O L,Golovina I V. Antioxidant enzyme complex of tissues of the bivalveMytilus galloprovincialisLam.under normal and oxidative-stress conditions:A review[J].Applied Biochemistry and Microbiology,2007,43(5):556-562.
[5] 张峰,李光友.皱纹盘鲍血细胞吞噬发光的研究[J].海洋与湖沼,2000,31(4):386-391.
[6] Arumugam M,Romestand B,Torreilles J,et al.In vitroproduction of superoxide and nitric oxide (as nitrite and nitrate) by Mytilus galloprovincialis haemocytes upon incubation with PMA or laminarin or during yeast phagocytosis[J].European Journal of Cell Biology,2000,79(7):513-519.
[7] Tafalla C,Go´mez-Leo´n J,Novoa B,et al.Nitric oxide production by carpet shell clam (Ruditapes decussates) hemocytes[J].Developmental and Comparative Immunology,2003,27:197-205.
[8] Ortuno J,Esteban M A,Meseguer J.Kinetics of hydrogen peroxide production duringin vitrorespiratory burst of seabreamSparus aurataL.head-kidney leucocytes,as measured by a flow cytometric method[J].Fish & Shellfish Immunol,2000,10:725-729.
[9] 马洪明,麦康森.贝类血细胞的吞噬作用和非我识别[J].海洋科学,2003,27(2):16-18.
[10] 孙虎山,王宜艳,杨静,等.病毒感染对栉孔扇贝血淋巴中过氧化氢酶和过氧化物酶活力的影响[J].水产科学,2004,23(8):4-6.
[11] 王淑红,王艺磊,张朝霞,等.弧菌和大肠杆菌感染对杂色鲍无细胞血淋巴中几种酶活力的影响[J].中国水产科学,2004,11(1):37-40.
[12] 王玥,胡义波,姜乃澄.氨态氮、亚硝态氮对罗氏沼虾免疫相关酶类的影响[J].浙江大学学报:理学版,2005,32(6):698-705.
[13] 谢彦海,胡宝庆,文春根.背角无齿蚌(Anodonta woodiana) 血细胞的分类[J].湖南农业大学学报:自然科学版,2010,36(1):61-64.
[14] Allen R C,Stjemholm R L,Steele R H.Evidence for the generation of an electronic excitation state(s) in human polymorphonuclear leukocytes and its participation in bactericidal activity[J].Biochemical and Biophysical Research Communications,1972,47(4):679-684.
[15] 张峰,李光友,张培军.皱纹盘鲍血细胞活性氧产生的研究[J].中国水产科学,1999,6(3):37-39.
[16] 孔祥会,王桂忠,艾春香,等.锯缘青蟹不同器官组织中总抗氧化能力和SOD活性的比较研究[J].台湾海峡,2003,22(4):469-474.
[17] 谭树华,邓先余,蒋文明,等.高浓度铬对克氏原螯虾抗氧化酶系统的影响[J].农业环境科学学报,2007,26(4):1356-1360.
[18] Pipe R K,Porte C,Livingstone D R.Antionxidant enzymes associated with the blood cells and haemolymph of the musselsMytilus edulis[J].Fish Shellfish Immunology,1993,3:221-233.
[19] 饶玉才,胡宝庆,文春根.嗜水气单胞菌感染对背角无齿蚌5种免疫相关酶活力的影响[J].水生生物学报,2009,33(3):406-412.
[20] 王咏梅.自由基与谷胱甘肽过氧化物酶[J].解放军药学学报,2005,21(5):369-371.
[21] 李雪婷,邱飞婵,贾凤兰,等.双氯灭痛对小鼠肝脏氧化应激的诱导作用[J].卫生毒理学杂志,2004,18(1):4-7.
[22] 李效宇,刘永定,宋立荣,等.鲤肝细胞抗氧化系统对微囊藻毒素毒性的反应[J].水生生物学报,2003,27(5):272-275.
[23] 杨晓斌,金叶飞,吴波.铈对三角帆蚌肝脏抗氧化酶活性及丙二醛含量的影响[J].水利渔业,2008,28(3):16-18.
